1株产铁载体辣椒内生细菌的分离鉴定及其促生长作用
雷 平,黄 军,黄彬彬,毕世宇,郭照辉,刘清术,唐 滢*
(1.湖南省微生物研究院,长沙410009;2.湖南省农用微生物应用工程技术研究中心,长沙410009)
我国是世界第一大辣椒生产国与消费国,年播种面积约133万公顷[1]。但是在辣椒种植上普遍存在盲目施肥和过度施肥的现象,大量化肥的施用导致土壤板结及肥力下降,最终造成辣椒产量和品质的下降,这一现象已经影响到我国农业的可持续发展[2]。
过量施用化肥会造成肥料利用率低、生态环境恶化等一系列问题。因此,能替代化肥的新型安全高效肥料的研制迫在眉睫。拥有多种促生功能且性能稳定的生物有机肥的研发及应用具有重要的研究意义和广阔的市场前景[3]。生物有机肥中的菌株来源于土壤或植物材料,对环境无毒无害,施用后可以改良土壤,增加土壤有机质的含量,还可促进作物的生长发育,从而起到提高产量和改善品质的作用[4-5]。
内生菌作为一类未被完全发掘的微生物资源,近年已成为植物促生抗病微生物筛选的热点。筛选和利用辣椒内生菌来防治植物病害的研究已经有大量报道[6-8],本课题组前期也分离筛选了大量内生菌资源,主要集中在芽孢杆菌(Bacillus)和链霉菌(Streptomyces)2大类[9-10]。关于辣椒内生菌的促生长研究还不太多,特别是假单胞菌(Pseudomonas)作为植物内生菌对辣椒促生长的报道很少。本研究从湖南省辣椒主栽品种兴蔬215中分离到1株产铁载体的内生假单胞菌PEB40,该菌株能在铬天青(chrome azurol S,CAS)平板上产生较大的噬铁圈,同时还具备产生吲哚 -3-乙酸(indole-3-acetic acid,IAA)、溶磷、解钾、固氮等能力,盆栽试验中亦显示出很好的促生长效果,其分子生物学分类鉴定及形态特征表明该菌很可能为假单胞菌属的1个新种。
1 材料和方法
1.1 试验材料
试验材料为2017年湖南省农科院蔬菜所常年种植辣椒的试验田内采集的辣椒健康植株,其品种为兴蔬215。将植株根上的土用力抖落,用无菌剪刀剪下其根系置于冷藏盒中,带回实验室后进行根系微生物分离。
常规细菌的分离培养采用LB(Luria-Bertani)和1/10 LB培养基。其液体培养基的成分为:蛋白胨10 g、牛肉浸膏10 g、氯化钠 3 g、蒸馏水 1 000 mL,pH值为6.5±0.5(25℃)。将LB液体培养基稀释10倍,并调节pH值至6.5±0.5(25℃)即为1/10 LB液体培养基。在相应液体培养基中加入1.8%~2.3%琼脂粉即得固体培养基。
本文采用CAS平板检测细菌产铁载体的情况,具体配置参考荣良燕等[11]的研究中的方法,稍有调整。首先配置溶液I:60.5 mg CAS溶于50 mL超纯水中,与10 mL Fe3+溶液混合,加入到十六烷基三甲基溴化胺(hexadecyl trimethyl ammonium bromide,HTAB)溶液中。再配溶液II,其组分为:KH2PO40.3 g、NaCl 0.5 g、NH4Cl 1.0 g、琼脂粉 15 g、呱嗪二乙酸磺酸钠(Pipes)30.24 g,pH 6.8。20%蔗糖溶液、10%酸水解酪素、1 mmol/L CaCl2和10 mmol/L MgSO4分别单独灭菌,待冷却至50℃,按比率混合后倾注至平板上。
1.2 试验方法
1.2.1 辣椒内生细菌的分离
内生菌的分离参考袁珊珊[12]的方法,并进行了细微的调整。将田间采集的辣椒主根及侧根剪下,用自来水洗净泥沙,放入超净工作台中吹干根表水分;然后将根系剪成小段,放入Na2HPO4溶液中进行超声,进一步去除根系表面的杂质;取出根系依次用无水乙醇、4%次氯酸钠溶液、硫代硫酸钠溶液进行表面消毒,消毒后用大量无菌超纯水洗去残留的消毒剂;取最后一次清洗液涂布于无菌LB平板上检测根系表面消毒是否彻底;将表面消毒彻底的根系置于超净工作台中吹干并放入无菌研钵中,加入适量无菌水研磨成浆液,取1、10、50 μL分别涂布于LB和1/10 LB平板上,30℃培养箱中培养3~7 d,挑取单菌落划线至LB平板上,经过多次划线分离,最终获得菌落形态一致的纯培养细菌菌落。
1.2.2 根系内生菌产铁载体能力的测定
采用CAS平板法对细菌的产铁载体能力进行测定[11]。将上述分离到的辣椒内生菌株接种到LB平板上培养24~36 h后,采用点接种法,用灭菌的牙签将菌种接在CAS固体检测平板上,每个菌种3个重复,置于30℃培养箱培养2~7 d。观察菌落周围是否产生黄色晕圈,即噬铁圈,并测定黄色透明圈的直径。选择晕圈直径大小在(5.0±0.5)mm且在LB培养基中菌落呈浅黄绿色、表面光滑、无芽胞、杆状的革兰氏阴性细菌进行后续试验。
1.2.3 内生菌PEB40促进植物生长指标的检测
为检测内生菌PEB40除了产生铁载体之外,是否还具备其他促进植物生长的潜力,我们根据文献报道的方法[13-14],对其进行了产IAA、溶解有机磷、无机磷、解钾及固氮等能力的测定。
1.2.4 内生菌PEB40的16S rDNA序列测定及初步菌种鉴定
根据前期建立的方法[9-10]进行菌种鉴定,具体如下:挑单菌落接种于LB液体培养基中,过夜培养后收集菌液,用无菌水洗涤1次后,取1 μL菌悬液作为模板,用细菌通用的16S rDNA扩增引物27F/1492R扩增待测菌株16S rDNA。菌落PCR扩增体系为:PCR Mix 25 μL、引物 27F(10 μmol/L)1 μL、引物 1492R(10 μmol/L)1 μL、模板 1 μL,加重蒸水至 50 μL。扩增条件为:98 ℃ 10 min,98 ℃ 15 s,55 ℃ 15 s,72 ℃35 s,35个循环;72℃ 10 min。采用DNA胶回收试剂盒,通过琼脂糖凝胶电泳回收目标DNA片段,送湖南擎科生物技术有限公司测序。测序结果用Ez-BioCloud(https://www.ezbiocloud.net/)进行在线分析[15],选取同源性在98.39%至95.35%的假单胞菌属的模式菌株进行Clustal Omega多序列比对,利用软件Mega X构建系统进化树,采用自举法(Bootstrap)评估分支可信度,Bootstrap取样值大于1 000。
1.2.5 产铁载体菌株的促生长田间小区试验
活化假单胞菌PEB40,并接种于LB液体培养基中,于28℃、150 r/min培养至对数生长期得到种子液。种子液按2%的接种量转接于新鲜LB液体培养基中,28℃、150 r/min震荡培养 40~48 h得到发酵液。将发酵液倒出后,通过平板计数的方式计算发酵液中的有效活菌数。菌液离心后弃去上清,用水将发酵液稀释成菌液浓度为108CFU/mL的溶液,用于辣椒盆栽试验。盆栽试验设置2个组,即空白组(check,CK)、处理组(PEB40),每组种植 20株,盆栽土壤采用取自田间的菜地土,每盆装2 kg。移栽前,处理组的辣椒苗用PEB40菌液浸根处理30 s,而后每10 d对辣椒植株浇灌1次制备的菌剂(菌液浓度为108CFU/mL),菌剂用量为每株10 mL,共浇灌3次;空白组用清水替代菌剂进行浸根处理和辣椒植株的浇灌,处理组和对照组的其他水肥管理条件完全相同,按农民惯用的施肥用量进行施肥,统一不使用防治病害的药剂。种植50 d后,观察辣椒的生长情况,记录株高和展幅等指标,统计辣椒植株从开始结果到有效采收期(50 d)内所有成熟辣椒的鲜重,结果数是采收辣椒的总数量。所有数据均用SPSS 22.0软件进行统计分析。
2 结果与分析
2.1 产铁载体内生菌的分离和筛选结果
本文从辣椒根系样品中分离到内生细菌52株。将这些菌株分别点接到CAS平板上,其中7株内生菌能产生不同大小的黄色噬铁圈,分别为PEB5、PEB5、PEB15、PEB21、PEB23、PEB40、PEB73、PEB99,表明这些菌株能产生铁载体以螯合培养基中的铁(表1)。本研究对各菌株产生的噬铁圈大小进行了测定,通过比较噬铁圈大小发现,PEB40菌株产生的噬铁圈最大,半径为(5.0±0.5)mm,如图 1a所示,因此我们选取该菌株进行后续的促生长试验。
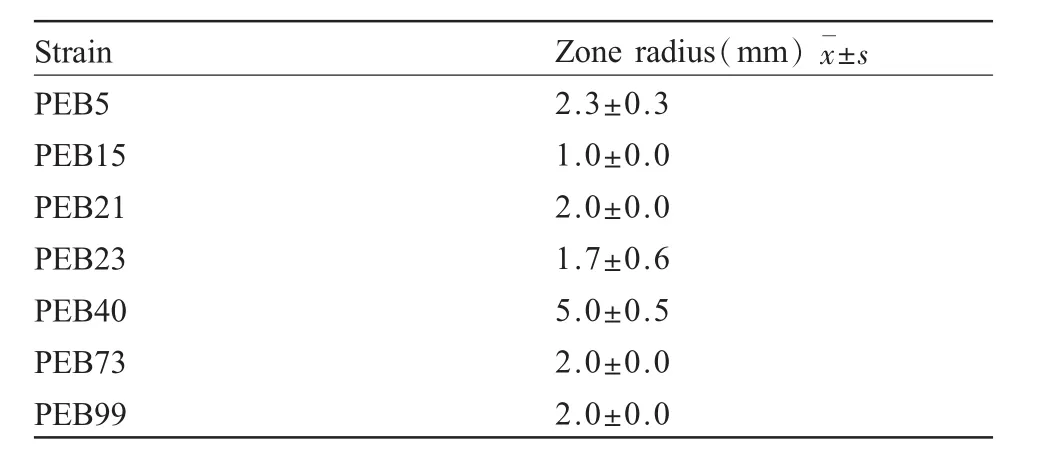
表1 不同辣椒内生菌产铁载体能力测定Tab.1 CAS assay for analysis of siderophores produced by different capscium endophytes
2.2 产铁载体内生菌PEB40的形态学观测
经革兰氏染色,PEB40菌体在显微镜下呈现红色,推测其应为革兰氏阴性菌。同时其菌体呈短杆状,两端钝圆,不形成芽孢(图1b)。在LB固体培养基上,PEB40菌株形成的菌落呈淡黄色(图1c)。
2.3 产铁载体内生菌PEB40促进植物生长潜能的测定
内生菌PEB40产IAA、溶磷、解钾、固氮等能力测定结果显示,其除了能产生铁载体外,还能在添加色氨酸的情况下产生植物生长激素IAA。此外,该菌还能在以有机磷为唯一磷源的测定培养基上产生较大的透明水解圈,说明其具有较强的溶解有机磷的能力。在以无机磷为唯一磷源的培养基上亦能产生水解圈。该菌也可在钾长石和阿须贝无氮培养基上很好地生长,说明其可能还具有解钾和固氮能力,详见表2。因此,内生菌PEB40具有较大的促进植物生长的潜力。
2.4 内生菌PEB40对辣椒的促生长效果
本文采用盆栽试验测定了PEB40菌株对辣椒的促生长效果。从表3中可看出,处理组的辣椒植株比对照组长势更茂盛,处理50 d后,辣椒的结果数、产量、株高、展幅与空白组相比,各指标均存在显著的优势(P<0.05),其中株高增加了18.9%,展幅增加了20.7%,产量增加了35.3%。这表明产铁载体内生菌PEB40对辣椒具有明显的促生长效果,具有开发为微生物肥料的潜力。
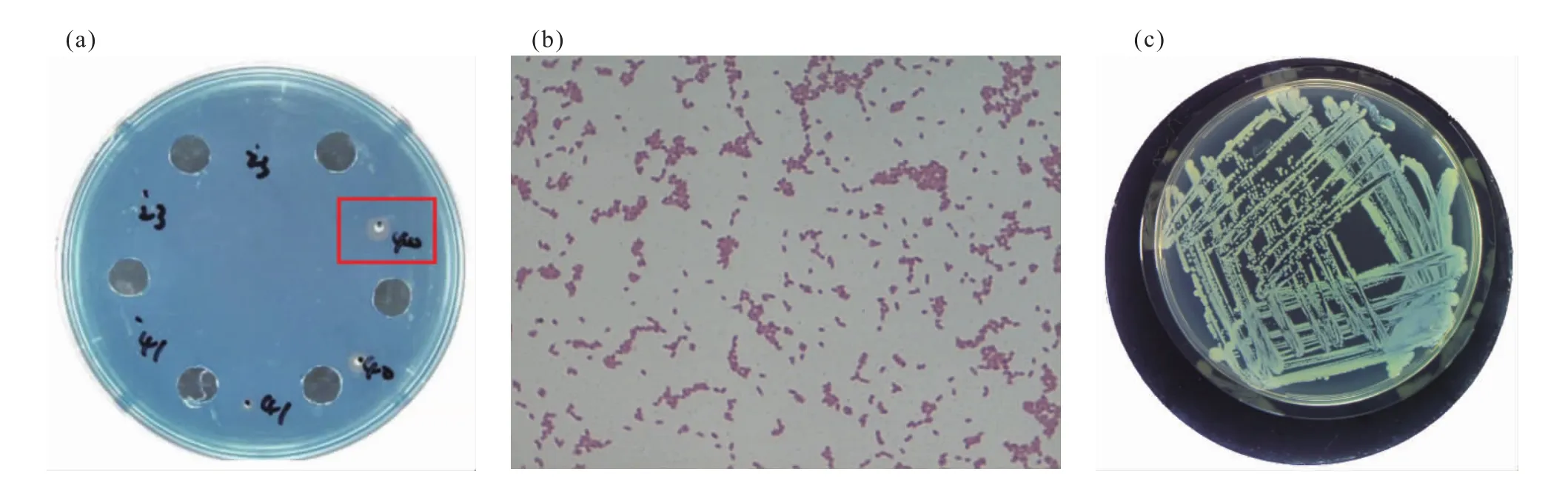
图1 PEB40菌株Fig.1 Strain PEB40

表2 内生菌PEB40促生指标测定Tab.2 Detection of the plant-promoting ability of endophytic bacteria PEB40
2.5 产铁载体内生菌PEB40的16S rDNA序列分析及初步鉴定
16S rRNA基因序列同源性为细菌新种鉴定的重要指标之一。微生物分类学界权威人士,EzBio-Cloud创始人、首尔大学教授Chan[16]报道,98.7%为判定新种的分界点。微生物分类学权威杂志International Journal of Systematic and Evolutionary Microbiology(IJSEM)上发表的新种,其最高同源性也在该范围内[17]。以PEB40的基因组为模板,27F/1492R为引物,成功扩增到了1.5 kb左右的条带,切胶纯化后进行测序,将所得序列提交至GenBank(ID:MT703-863),并与EzBioCloud数据库中的模式菌株进行比对。比对结果显示与该菌16S rDNA同源性最高的菌株为硝基还原假单胞菌(Pseudomonas nitroreducensDSM 14399),同源性为98.38%,低于阈值(98.7%)。将该16S rDNA序列与假单胞菌属(Pseudomonas)的代表菌株进行多序列比对,构建系统发育树(图2),从中可看出,PEB40与硝基还原假单胞菌(P.nitroreducens)DSM 14399在进化树上位于不同分支,分支处Bootstrap值为91,可信度高,且距离较远,为新种可能性大。菌株、菌落形态特征表明PEB40应为假单胞菌属的菌株。

表3 内生菌PEB40对辣椒的促生长效果Tab.3 Growth promotion effect of endophyte PEB40 on capscium

图2 内生菌PEB40的16S rDNA进化树(邻位法)Fig.2 Neighbour-joining phylogenetic tree of the endopytic bacterium PEB40 based on its 16S rRNA gene sequence
3 讨论
关于辣椒内生菌分离的研究报道较多,主要集中在辣椒病害拮抗菌的筛选上。已报道的辣椒促生长菌株主要为根际促生长菌株(plant growth promoting rhizobacteria,PGPR),而对于从内生菌中筛选促进植物生长的微生物菌株并不多见[6-10]。内生菌具有较强的定植和靶向能力,在施入土壤后,能通过根系进入植物体内实现稳定的定植,并行使相关功能,因此,内生菌相比于土壤及根际微生物而言,将更有优势[18-20]。本研究从多年种植辣椒的基地采集了健康植株的根系,表面消毒后从根系中分离到1株内生细菌PEB40,该菌株能在CAS平板上产生较大的噬铁圈,还具有较好的产IAA和溶解有机磷的能力,显示了很好的植物促生长潜能。盆栽试验显示,PEB40菌株对辣椒具有显著的促生长效果,施用该菌剂后,辣椒的结果数、产量、株高、展幅与空白组相比均存在显著的优势(P<0.05),具有开发为微生物肥料的潜力。经16S rDNA序列及进化树分析,PEB40很可能是假单菌属的一个新种,与其同源性最高的菌株为硝基还原假单胞菌(P.nitroreducens)DSM 14399。
铁在地壳中含量丰富,但中性pH下,可溶性游离铁离子的浓度仅为10-10~10-9mol/L,远达不到生物体能利用的浓度(10-7~10-5mol/L)[21]。铁载体能螯合环境中的铁离子,将其转化为生物体可利用的形式。植物能从其自身及其他微生物的铁载体中获取铁离子,有些植物甚至能够通过分泌酚类物质调节根际微生物群落,使能产生铁载体的微生物的丰度增加。多篇报道亦表明假单胞菌属(Pseudomonas)和链霉菌属(Streptomyces)的多株细菌能够通过产生铁载体促进植物生长[22-23]。此外,根际细菌产生的铁载体也可以通过与植物病原菌竞争铁离子,进而抑制其生长,提高植物的抗病能力[24]。铁载体还可以螯合许多有害的金属离子,如 Cr3+、Al3+、Cu2+、Eu3+、Pb2+等,改善土壤理化性质[25]。部分有益根际微生物亦可定植于植物体内成为内生菌。内生菌PEB40具有较强的产铁载体能力及促生性能,然而其中的机理仍有待进一步研究。接下来,我们将深入研究菌株PEB40对土壤理化性质及根际微生物群落结构的影响,进行生理生化及化学成分分析以完善该菌的新种鉴定工作,继续开展PEB40菌株的生物安全性评价、高水平发酵工艺以及与其他微生物肥料功能菌株的复配工艺、田间施用技术等,推动将PEB40菌株作为新微生物肥料生产菌株的开发和应用。

