儿童支原体肺炎肺部影像学特征及临床分析
戴天生,郭辉,张林
(吉安市妇幼保健院,江西 吉安 343000)
支原体肺炎(MPP)是儿科常见呼吸系统疾病,发病率较高,可累及多系统,会产生严重的肺部损伤及其他系统并发症,占住院儿童社区获得性肺炎(CAP)的10%~40%[1-2]。不同年龄患儿临床症状、体征及胸片表现差异较大[3],因此儿科医师精准诊疗有一定难度。为提高儿童支原体肺炎的诊疗水平,本研究对我院近1年住院的支原体肺炎患儿的肺部影像学及临床特点进行回顾性分析。报告如下。
1 资料与方法
1.1 一般资料
选取2018年7月—2019年7月住院治疗的65 例MPP患儿,按肺部影像学表现分为A组(支气管肺炎组,35 例)和B组(节段性/大叶性肺炎组,30 例)。A组以点片状改变或间质性浸润为表现,B组以肺段实变、胸腔积液、肺不张为表现。A组男19 例,女16 例,年龄(3.60±1.20) 岁;B组男16 例,女14 例,年龄(5.79±2.87) 岁。两组患儿一般资料比较差异无统计学意义(P>0.05),有可比性。
1.2 诊断及排除标准
儿童MPP诊断标准参照儿童社区获得性肺炎指南[3-4]:临床表现为发烧、咳嗽,部分儿童有喘息,肺部听诊可闻及啰音;胸部X线片出现大小叶肺实变,间质侵袭性和/或肺门淋巴结肿大等多样性改变;急性期单份血清肺炎支原体抗体(MP-IgM)≥1∶160或支原体PCR阳性[4]。排除合并其他细菌及病毒感染、其他呼吸系统疾病、严重内外科及免疫性疾病、临床资料不全等患儿。
1.3 数据收集
收集患儿入院后的临床资料:C反应蛋白(CRP)、降钙素原(PCT)、血生化等实验室检查结果;临床表现:包括发热时间、住院时间、咳嗽特点、是否伴有喘息及呼吸急促、肺部啰音情况、肺部影像学、治疗及预后情况。
1.4 统计学方法
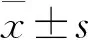
2 结 果
2.1 临床表现
A组影像学表现为点片改变27 例、间质性浸润改变8 例,5 例无发热。B组影像学表现均有肺段实变影改变,其中胸腔积液7 例(23.33%)、肺不张1 例(3.33%),均反复高热。两组患儿均出现阵发性咳嗽。两组临床表现比较见表1。
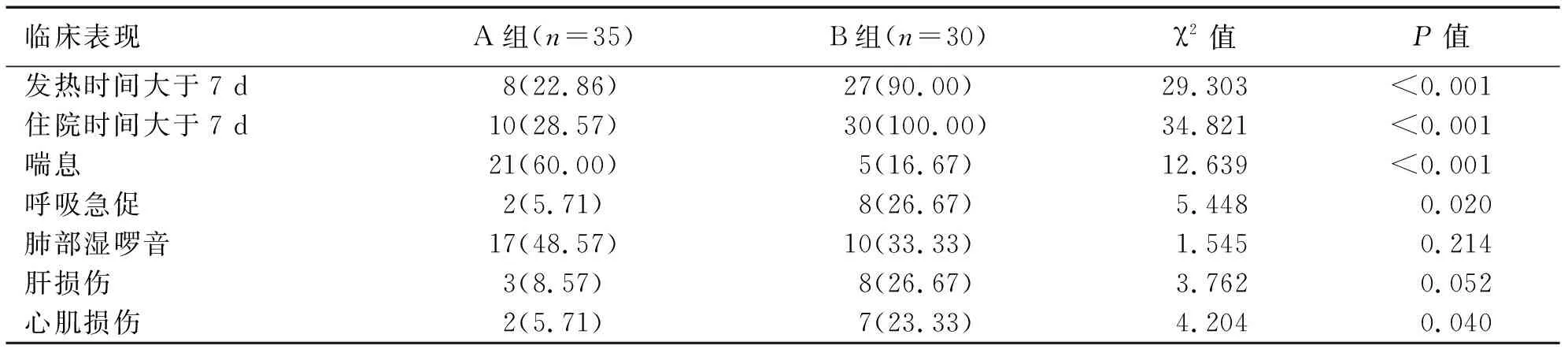
表1 两组临床表现比较 例(%)
2.2 实验室结果
两组CRP比较差异有统计学意义(P<0.05),两组PCT比较差异无统计学意义(P>0.05)(见表2)。

表2 两组CRP和PCT比较
2.3 治疗及预后
A组患儿给予阿奇霉素(国产)静脉滴注抗感染治疗5~7 d,均好转出院,出院后口服希舒美序贯治疗1个月。B组患儿静脉使用希舒美抗感染联合小剂量甲强龙抗炎等治疗7 d。静脉应用糖皮质激素指证依据2015年儿童MPP专家共识[5]。小剂量静脉应用甲强龙每次1 mg/kg,每日3次,依据患儿临床症状及体征每2~3 d减量,一周减停后酌情改口服泼尼松,总疗程1~2周,其中5 例患儿采用丙种球蛋白免疫治疗,4 例转上级医院行支气管镜灌洗治疗,后均好转出院,出院后口服希舒美序贯治疗1个月,复查胸片痊愈。
3 讨 论
MPP患儿临床表现差异较大,通常表现为发热、呼吸道症状,可损伤肺部及肺外其他系统。目前儿童MPP的发病机制仍在研究,国内外多数儿科专家认为,与以下因素有关[5-6]:第一,肺炎支原体(MP)侵入呼吸道后,借滑动运动定位于纤毛之间,通过黏附细胞器的P1黏附素等黏附于呼吸道上皮细胞表面,抵抗黏膜纤毛的清除作用和吞噬细胞的吞噬作用;第二,支原体黏附宿主呼吸道上皮后,产生过氧化氢,刺激呼吸道上皮发生氧化应激反应,分泌社区获得性肺炎呼吸窘迫综合征(CARDS)毒素等对呼吸道上皮造成损伤;MP感染后发生宿主免疫反应过激发生自身损伤。MPP患儿的影像学改变多不典型,可有多种不同表现,通常其肺炎影像学较临床症状明显,出现时间更早,是儿童MPP的临床特征之一[3]。其影像学表现主要是间质性病变、斑片状浸润影、大片状实变影、胸腔积液等。研究发现不同严重程度的MPP患儿肺部影像学表现明显不同,表明肺部影像学改变能判断MPP患儿的病情,对MPP患儿的精准诊疗及预后改善有重要意义[7]。A组患儿的肺部影像学表现以点片状改变或间质性浸润为主,且年龄多数<5 岁;而B组以肺段实变、胸腔积液、肺不张为表现,且年龄多数≥5 岁。B组患儿的肺部影像学改变比A组患儿严重,肺部损伤更明显,且多数为重症支原体肺炎,与国内相关报道一致[8-9]。考虑与年长儿童免疫功能相对成熟容易导致过度的免疫炎性反应、局限感染范围能力较强有关。本研究A组患儿发热及住院治疗时间相对短,以阵发性咳嗽、喘息等为主要临床表现,且肺外损伤表现不明显。B组患儿发热时间一般为1周以上,以反复高热、精神差、烦躁不安为主,咳嗽不明显,咳少许白色黏痰,呼吸急促、口唇发绀,肺部或肺外系统有损伤;其肺部影像学主要表现为大片状云雾影、大片状肺实变影、胸腔积液等,进一步表明节段性/大叶性肺炎患儿MP感染后细胞及体液免疫反应紊乱,释放大量的炎症介质,产生瀑布式免疫自身损伤,出现肺部或其他脏器损伤。国内外有研究表明,MP两个致病因素是对宿主呼吸道的直接损害和机体的免疫反应紊乱[10]。因此,考虑5 岁以下患儿免疫系统尚未健全,对外界病原微生物入侵未能进行有效及时的免疫应答,故感染MP后直接对呼吸道造成损害,临床上主要表现为呼吸道症状;而5 岁以上患儿机体免疫系统相对成熟,感染MP后,机体的免疫反应紊乱,产生免疫过激损伤,临床表现以发热等全身症状为主。本研究中B组患儿合并肝脏和/或心脏损害比例明显高于A组,表明患儿免疫反应越强,出现肺部和/或其他脏器损伤越重。因此,对于影像学表现肺段以上实质浸润型MPP患儿应高度重视,积极给予希舒美抗感染及小剂量甲强龙抗炎等对症支持治疗,抑制其病情进展,尽量减少肺部及其他系统损害的发生。本组患儿应用希舒美及激素时间相对较早,所以未发现严重并发症患儿,均痊愈出院,随访3个月复查胸片痊愈。CRP和PCT是临床常用的炎症指标,常用于炎症的鉴别诊断,指导临床合理用药。有研究指出[11-12],支原体肺炎患儿的CRP会升高,其升高水平与病情严重程度有关,本研究显示在两组MPP患儿中PCT变化不明显,而CRP在B组明显升高,提示肺段以上实质浸润型MPP患儿,CRP显著增加,体内炎症反应相对强,病情更重,其发病机制以免疫反应异常为主。
本研究发现B组患儿的临床表现及炎症反应较重,需尽早给予希舒美联合小剂量糖皮质激素治疗,必要时联合免疫球蛋白、支气管镜灌洗治疗,以利于肺部病变吸收好转,减少后遗症。因为MP缺乏肽聚糖细胞壁,所以大环内酯类、喹诺酮类、四环素类、氨基糖苷类等抗菌药物能抑制或影响蛋白质合成,但四环素类药、喹诺酮类药物、氨基糖苷类药物不良反应较多,因此这三种药物使用不多。希舒美是进口阿奇霉素,其药物纯度好,生物利用度高,在肺组织浓度高,半衰期长,具有更好的抗菌及降低体内炎症因子的作用。糖皮质激素作为抑制免疫炎症的常用药物,两者联合使用,可加快患儿病情恢复,缩短住院时间[13]。临床研究表明部分B组患儿有呼吸道痰液阻塞,甚至细支气管分泌物栓塞,少数有支气管炎症性狭窄甚至肉芽增生,及时解除呼吸道阻塞对减轻高热症状、促进肺复张、减少后遗症的发生有重要意义[14]。儿科纤维支气管镜的治疗价值在于通过局部灌洗可以通畅呼吸道,而结合异物钳或活检钳、细胞毛刷等,可清除下呼吸道分泌物与痰栓[4]。
综上所述,5 岁以上儿童的MPP,发热时间长,炎症指标高,住院时间长,需早期静脉使用希舒美联合小剂量甲强龙治疗,部分重症患儿需考虑使用丙种球蛋白及小儿支气管镜灌洗治疗。早期识别MPP患儿的不同影像学表现,有利于早诊断、早治疗,减少后遗症。

