miR-378c靶向AKT1调控骨关节炎软骨细胞增殖、凋亡的机制
张健博 宋建锋 武海发
(永煤集团总医院骨科,河南 永城 476600)
骨关节炎(OA)是一种由遗传、机械和环境等多因素引起的复杂关节退行性病变,临其床表现主要为缓慢发展的关节疼痛、压痛、僵硬、关节肿胀、活动受限和关节畸形等〔1〕。OA的发病机制复杂,软骨细胞的异常凋亡,导致软骨的完整性破坏,负重功能及骨损伤、重塑平衡功能的丧失可能是其发生的主要原因〔2〕。因此,如何维持软骨细胞增殖和凋亡的动态平衡是防治OA的关键环节。蛋白激酶B(AKT)是一种丝氨酸/苏氨酸蛋白激酶,在调控细胞存活和凋亡中起重要作用〔3〕。有研究〔4〕发现,AKT参与关节炎的病理过程,磷酸化(p)-AKT在骨关节炎软骨细胞中表达下调。黄连素可通过激活AKT促进骨关节炎软骨细胞的存活〔5〕。miR-378c是miR-378家族的主要成员,荆琳等〔6〕在研究膝骨关节炎患者软骨组织与血浆中miRNA表达变化及意义时发现,miR-378c在OA软骨组织中表达上调,但miR-378c对骨关节炎软骨细胞的增殖和凋亡的影响及miR-378c能否介导AKT1表达参与调控OA软骨细胞的增殖和凋亡尚未可知。因此,本研究通过检测miR-378c和p-AKT1在正常软骨组织和OA软骨组织中的表达差异,探讨miR-378c靶向AKT1对OA软骨细胞增殖和凋亡的影响。
1 材料与方法
1.1实验材料与主要试剂、仪器 18例OA软骨组织和18例正常软骨组织由永煤集团总医院骨科于2017年1月至2018年1月收集。成人OA-软骨细胞HC-OA购于处实(上海)生物科技有限公司。DMEM/F12和胎牛血清(FBS)购于Thermo公司;LipofectamineTM 2000相关转染试剂和TRIzol试剂购于美国Invitrogen公司;RT-PCR引物、miR-378c抑制物(anti-miR-378c)、miRNA抑制物阳性对照(anti-miR-NC)、小干扰RNA无序阳性对照(si-NC)、AKT1小干扰RNA(si-AKT1)、野生型(WT)-AKT1及突变型(MUT)-AKT1的构建和测序由上海生工公司提供;噻唑蓝(MTT)试剂、二喹啉甲酸(BCA)蛋白定量试剂盒、聚偏氟乙烯(PVDF)膜、Western印迹相关试剂购于北京索莱宝公司;p-AKT1、磷酸甘油醛脱氢酶(GAPDH)、细胞周期素(Cyclin)D1、P21、Bax和Bcl-2一抗购于Santa Cruz公司;辣根过氧化物酶(HRP)标记的二抗和RIPA裂解液购于上海生工公司;双荧光素酶报告基因检测试剂盒购于美国Promega公司;SYBR Green PCR试剂盒购于TaKaRa;酶标仪和LightCycler 480实时荧光定量PCR仪购自美国Thermo公司;流式细胞仪购自美国Beckman公司。
1.2细胞培养与转染 采用DMEM/F12培养基(含有10% FBS)在37℃、CO2体积分数5%的培养条件下培养人OA软骨细胞HC-OA,每隔1 d更换液1次,当细胞融合率达到80%时,用胰酶消化后进行传代。细胞转染:取对数期生长良好的HC-OA细胞,调整细胞浓度,以2×105个/孔细胞数接种于96孔培养板,当细胞融合度达到50%时,利用LipofectamineTM2000将anti-miR-378c、anti-miR-NC、si-NC和si-AKT1分别转染H9c2细胞,于细胞培养箱常规培养24 h后,进行后续实验分析。实验分组如下:anti-miR-378c组(转染anti-miR-378c)、anti-miR-NC组(转染anti-miR-NC)、si-NC组(转染si-NC)、si-AKT1组(转染si-AKT1)、anti-miR-378c+si-NC组(转染anti-miR-378c和si-NC)和anti-miR-378c+si-AKT1组(转染anti-miR-378c和si-AKT1)。
1.3qRT-PCR检测 按照TRIzol试剂使用说明从18例正常软骨组织和18例OA软骨组织及各组HC-OA细胞中提取总RNA,逆转录为cDNA后,用SYBR Green PCR试剂盒进行RT-PCR反应,用LightCycler 480系统进行信号收集荧光信号并进行熔炉曲线分析。以U6作为miR-378c和p-AKT1 mRNA的内参,用2-ΔΔCt方法计算miR-378c和p-AKT1 mRNA的相对表达量。
1.4MTT实验检测细胞增殖活力 取转染24 h的HC-OA细胞,以细胞密度为1×104个/孔接种于96孔板进行培养。分别在培养24 h、48 h、72 h时向每个孔中加入20 μl的MTT试剂,室温反应4 h,吸去孔内上清液,每孔再加入二甲基亚砜(DMSO)150 μl,缓慢摇动10 min至完全溶解。用酶标仪在490 nm波长处检测各孔的OD值(以空白孔进行调零)。
1.5流式细胞术检测细胞凋亡 取各组HC-OA细胞,用不含乙二胺四乙酸(EDTA)的胰酶消化后离心,弃上清收集各组细胞,用预冷的1×磷酸盐缓冲液(PBS)漂洗细胞,加入适量的1×结合缓冲液轻轻吹打重悬细胞,然后加入5 μl的膜联蛋白(Annexin)V-异硫氰酸荧光素(FITC)混匀,室温避光孵育15 min后,加入5 μl的碘化丙啶(PI)染色,随后用流式细胞仪检测细胞凋亡情况。
1.6双荧光素酶报告基因检测 利用靶基因预测数据库Targetscan网站(http://www.targetscan.org/vert/)预测miR-378c的靶基因。发现miR-378c的5′端可与AKT1的3′-UTR特异性结合,猜测AKT1是miR-378c的靶基因。为验证这一猜想,构建WT-AKT1和MUT-AKT1的AKT13′-UTR荧光素酶报告载体。利用LipofectamineTM 2000将miR-378c和miR-NC分别与WT-AKT1和MUT-AKT1共转染HC-OA细胞,然后将各组HC-OA细胞于细胞培养箱内培养48 h,收集各组细胞,按照双荧光素酶报告基因检测试剂盒说明书对各组HC-OA细胞的荧光素酶活性进行检测。
1.7Western印迹检测 按照用RIPA裂解液使用说明书裂解各组HC-OA细胞和正常软骨组织和OA软骨组织,收集细胞总蛋白,BCA试剂盒测定蛋白浓度。用十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离蛋白,将蛋白转至PVDF膜上,用洗涤液洗膜后加入封闭液室温封闭1 h,吸尽封闭液,加入相应的抗p-AKT1、GAPDH、CyclinD1、P21、Bax和Bcl-2一抗(1:1 000)4℃孵育过夜,用洗涤液洗膜3次,每次10 min,随后加入稀释好的HRP标记的二抗(1:1 000)室温孵育2 h,再次洗膜3次后于暗室加入显影液进行显色并拍照,用凝胶图像处理系统分析目标带光密度值(以GAPDH作为内参)。
1.8数据处理 采用统计学软件SPSS20.0进行t检验、单因素方差分析。
2 结 果
2.1miR-378c、AKT1在OA患者软骨组织和健康人正常软骨组织中的表达 与正常软骨组织相比,OA软骨组织中miR-378c表达显著升高,p-AKT1蛋白表达显著降低(P<0.05)。见图1,表1。

图1 软骨组织p-AKT1蛋白的表达

表1 miR-378c、AKT1在OA软骨组织和正常软骨组织中的表达
2.2抑制miR-378c表达对HC-OA细胞增殖的影响 anti-miR-378c组中miR-378c的表达显著低于anti-miR-NC组(P<0.05),表明成功构建了抑制miR-378c表达的HC-OA细胞株。与anti-miR-NC组相比,anti-miR-378c组中HC-OA细胞在24 h、48 h、72 h时的细胞活力显著升高,CyclinD1蛋白的表达显著升高,P21蛋白的表达显著减低(P<0.05)。见图2、表2。
2.3抑制miR-378c表达对HC-OA细胞凋亡的影响 与anti-miR-NC组相比,anti-miR-378c组HC-OA细胞凋亡率显著降低,Bax蛋白的表达显著降低,Bcl-2蛋白的表达显著升高(P<0.05)。见图3、图4、表3。

图2 抑制miR-378c表达对HC-OA细胞增殖蛋白表达的影响

表2 抑制miR-378c表达对HC-OA细胞增殖的影响
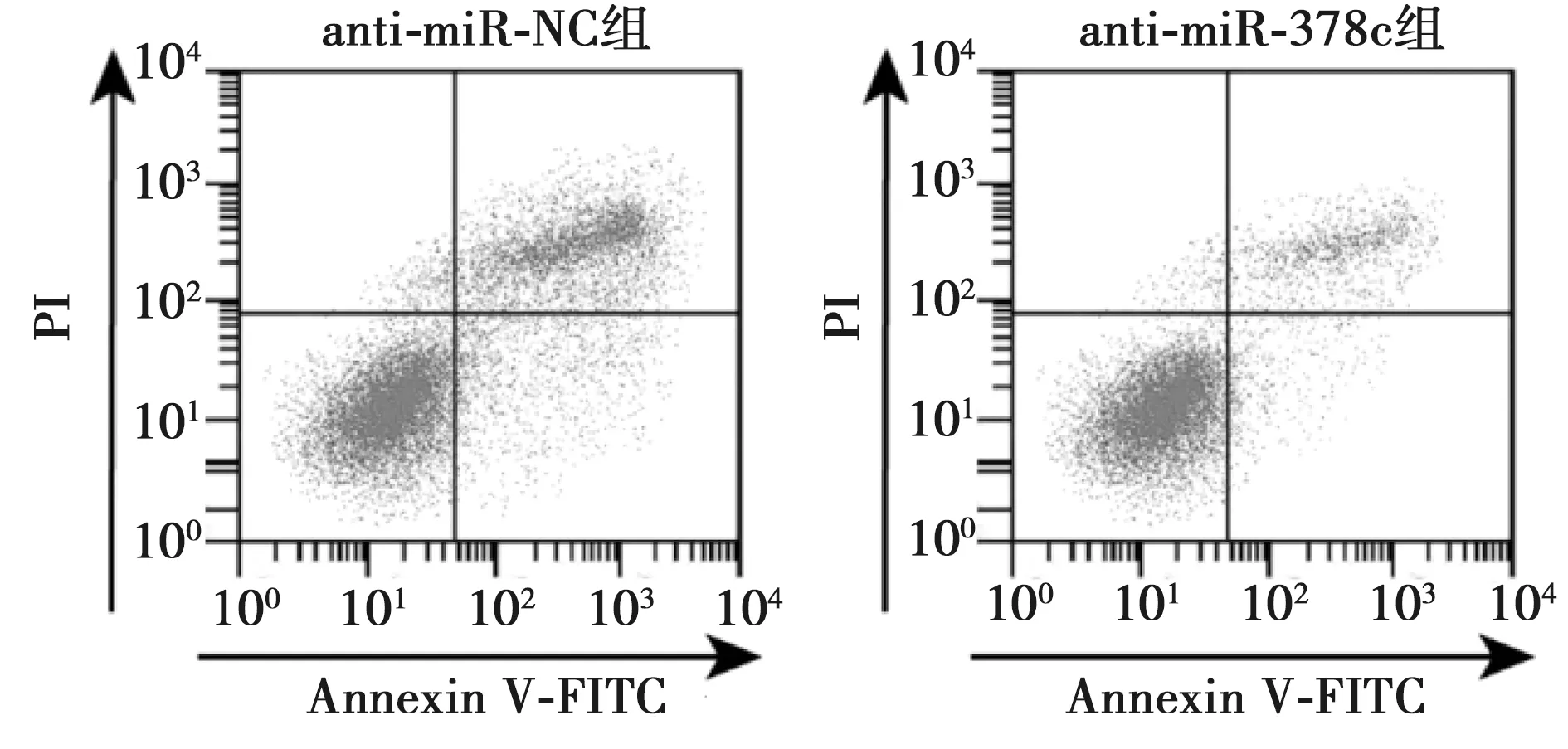
图3 抑制miR-378c表达对HC-OA细胞凋亡率影响

图4 抑制miR-378c表达对HC-OA细胞凋亡蛋白表达的影响

表3 抑制miR-378c表达对HC-OA细胞凋亡的影响
2.4miR-378c靶向调控AKT1 miR-378c与WT-AKT1的3′UTR之间存在特异性结合位点见图5。野生型AKT1基因荧光素酶表达载体WT-AKT1和miR-378c mimics共转染HC-OA细胞后,miR-378c组HC-OA细胞荧光素酶活性较再转染miR-NC组明显降低(P<0.05);而突变型AKT1基因荧光素酶表达载体MUT-AKT1和miR-378c mimics共转染HC-OA细胞后,miR-378c组HC-OA细胞荧光素酶活性较再转染miR-NC组差异不显著(P>0.05)。见表4。与miR-NC组比较,miR-378c组HC-OA细胞p-AKT1 mRNA 和p-AKT1蛋白的表达量显著减低;与anti-miR-NC组比较,anti-miR-378c组HC-OA细胞p-AKT1 mRNA和p-AKT1蛋白的表达量显著升高(P<0.05)。见图6、表5。

图5 AKT1的3′UTR含有miR-378c的互补序列

表4 双荧光素酶报告实验

1~4:miR-NC组、miR-378c组、anti-miR-NC组、anti-miR-378c组图6 各组p-AKT1蛋白的表达

表5 miR-378c调控AKT1的表达
2.5干扰AKT1的表达能逆转抑制miR-378c表达对HC-OA细胞增殖的促进作用 与anti-miR-NC组比较,anti-miR-378c组HC-OA细胞在24 h、48 h、72 h时的细胞活力显著升高,p-AKT1和CyclinD1蛋白的表达显著升高,P21蛋白的表达显著减低;与anti-miR-378c+si-NC组比较,anti-miR-378c+si-AKT1组HC-OA细胞在24 h、48 h、72 h时的细胞活力显著降低,p-AKT1和CyclinD1蛋白的表达显著降低,P21蛋白的表达显著升高(P<0.05)。见图7、表6。

1~4:anti-miR-NC组、anti-miR-378c组、anti-miR-378c+si-NC组、anti-miR-378c+si-AKT1组;下图同图7 p-AKT1及增殖蛋白的表达

表6 干扰AKT1的表达能逆转抑制miR-378c表达对HC-OA细胞增殖的作用
2.6干扰AKT1的表达能逆转抑制miR-378c表达对HC-OA细胞凋亡的抑制作用 与anti-miR-NC组比较,anti-miR-378c组HC-OA细胞的凋亡率显著降低,Bax蛋白的表达显著降低,Bcl-2蛋白的表达显著升高;与anti-miR-378c+si-NC组比较,anti-miR-378c+si-AKT1组HC-OA细胞的凋亡率显著升高,Bax蛋白的表达显著升高,Bcl-2蛋白的表达显著降低。见图8、表7。

图8 凋亡蛋白的表达

表7 干扰AKT1的表达能逆转抑制miR-378c表达对HC-OA细胞凋亡的抑制作用
3 讨 论
AKT激酶家族包括AKT1、AKT2和AKT3 3个成员,与磷脂酰肌醇3激酶(P13K)共同组成P13K/AKT信号通路。AKT1是P13K/AKT通路的重要组成部分,在3-磷酸肌醇依赖性蛋白激酶(PDK)1的辅助下,P13K通过使Akt蛋白上的磷酸化位点Thr308和Ser473磷酸化而使其激活,活化的AKT通过上调CyclinD1,磷酸化P21和P27等细胞周期蛋白,从而通过多种途径促进细胞增殖,抑制细胞凋亡〔7,8〕。有研究发现〔9〕,抑制P13K/AKT通路可促进OA大鼠模型中软骨细胞的凋亡和自噬。miRNA是一类长度约为22 nt的单链RNA,其通过抑制翻译或降解靶基因在细胞生长、分化、增殖和凋亡等多种调控通路中发挥作用。近年来,已发现多种miRNA参与OA软骨细胞的增殖和凋亡〔10~12〕。例如,miR-543在OA模型大鼠软骨组织中呈低表达,过表达miR-543体外可促进软骨细胞增殖〔10〕;miR-127-5p在OA软骨细胞中表达下调,过表达miR-127-5p可促进软骨细胞的增殖〔11〕。然而,miR-30a-5p在OA患者软骨细胞中表达上调,且miR-30a-5p可通过靶向下调AKT,引起软骨细胞周期阻滞,进而诱导OA患者软骨细胞的凋亡〔12〕。miR-378作为一种癌基因或抑癌基因,其在宫颈癌〔13〕、肝癌〔14〕和前列腺癌〔15〕等多种恶性肿瘤中的作用已被广泛报道。已有的研究〔6〕发现,miR-378c在骨关节软骨组织中表达上调,但miR-378c对OA软骨细胞的增殖和凋亡的影响及miR-378c能否介导AKT1表达调控OA软骨细胞的增殖和凋亡尚不清楚。
本研究首先对正常软骨组织和OA软骨组织中miR-378c和p-AKT1的表达情况进行检测,发现miR-378c在OA软骨组织中明显上调,p-AKT1表达显著下调,提示miR-378c和p-AKT1在软骨细胞中的正常表达对维持软骨细胞的正常功能具有重要的意义。随后通过构建抑制miR-378c表达HC-OA细胞株发现,HC-OA细胞活力显著增强,凋亡率显著降低,CyclinD1和Bcl-2蛋白表达显著增加,P21和Bax蛋白表达显著降低。CyclinD1通过与细胞周期蛋白激酶(CDKs)结合,形成CyclinD1/CDKs复合物,促使成视网膜细胞瘤蛋白(pRb)的形成,进而通过一系列核内过程促进细胞从G1期进入S期〔16〕。P21则抑制CyclinD1/CDKs复合物的形成发挥相反的作用〔17〕。当抗凋亡蛋白Bcl-2表达较高时,促凋亡蛋白Bax通过与Bcl-2结合形成异源二聚体Bax/Bcl-2抑制细胞凋亡〔18,19〕。抑制miR-378c表达可能通过抑制P21和Bax表达,促进CyclinD1和Bcl-2从而促进HC-OA细胞增殖,抑制细胞凋亡。双荧光素酶报告基因检测实验显示,AKT1是miR-378c的靶基因;Western印迹检测显示,miR-378c可负性调控AKT1的表达。为了进一步验证miR-378c是通过下调AKT1来调控HC-OA细胞的增殖和凋亡,随后把anti-miR-378c和si-AKT1共转染HC-OA细胞后发现,干扰AKT1的表达可逆转抑制miR-378c表达对HC-OA细胞增殖促进和凋亡抑制作用。提示,miR-378c可通过下调AKT1表达,抑制OA软骨细胞的增殖,促进细胞凋亡。
综上,miR-378c在人OA软骨组织中高表达,AKT1呈低表达,且miR-378c可能通过靶向下调AKT1抑制OA软骨细胞的增殖,促进细胞凋亡。这为研究OA的发病机制和临床治疗指明了新的发向。

