β-L-2′-脱氧胞苷的合成
常海洲,沈开源,江霜英
(1.上海理工大学 理学院,上海 200093;2.同济大学 环境科学与工程学院,上海 200092)
核苷是含氮碱基与糖组分缩合成的糖苷。核苷类似物在药学上被归类为竞争性抑制剂,由于结构与天然核苷相似,这类药物不仅可以“欺骗”病毒的酶,代替底物和酶结合,还能参与反应加入到新合成的核酸链上,阻止下一个核苷酸加入,比一般竞争性抑制剂具有更强的效果[1]。L-核苷是D-核苷的对映异构体,目前发现的天然核苷均属于D构型。1964年,Smejkal等[2]合成了第一个L-核苷:L-胸苷。许多L-核苷类似物被证明比其对映的D构型核苷具有更好的抗病毒活性和更低的细胞毒性。如Belleau[3]合成的拉米夫定(Lamivudine)比其D-对映体(±)-2′,3′-双脱氧-3′-硫代胞苷(BCH-189)拥有更优的抗HIV活性[4-5]。
核苷类化合物的合成方法主要有以下4种:(1)提取天然生物体的RNA和DNA[6],经过水解、脱磷酸和分离后,得到天然D-核苷;(2)通过对碱基改造、糖基改造或碱基和糖基双重改造来得到不同的核苷类化合物;(3)碱基和糖基在酶的催化下进行连接;(4)化学-酶合成法。
L-核苷的合成一般有两种思路。一是直接用L-糖基和碱基缩合合成。Grigorii[7]用以特戊酰基为保护基的L-戊糖为原料,将2位的羟基氟代,再与胸腺嘧啶进行反应,脱保护基得到1-(2-脱氧-2-氟-β-L-呋喃阿糖基)胸腺嘧啶。Zhang等[8]以L-木糖和5-氟胞嘧啶为原料,用氯乙酰基保护糖的羟基,糖与碱基缩合时加入了TMSOTf(三氟甲磺酸三甲基硅烷酯),经过十步反应合成β-L-Fd4C(Elvucitabine)。任行等[9]以3-位被叠氮基团取代的1,2-O-异亚丙基-α-L-呋喃木糖和6-氯腺嘌呤、尿嘧啶及5-氟尿嘧啶等进行缩合反应合成了多种3′-叠氮L-核苷。二是首先得到对应的α-D-核苷,再经过两次反转得到对应β-L-核苷。Watanabe等[10]以D-阿拉伯糖原料,与嘌呤的钠盐缩合得到α-D-型核苷,再经过两次结构翻转得到9-(2-脱氧-β-L-呋喃核糖基)-2-巯基-9H-嘌呤。
L-dC可以被病毒的核苷激酶、磷酸激酶当作底物识别,具有极好的抗HBV活性[11-12],是目前最有前景的抗HBV核苷类药物之一。在20世纪初,L-dC与L-dT(替比夫定)一同进行了临床1期和2期实验,其中替比夫定已经获批上市[13]。Moosa等[14]以经保护基保护的呋喃核糖和经保护基保护的胞嘧啶经过缩合得到了2′-脱氧-L-胞苷,产物中构型比例为α/β=1/5。
目前,针对L-dC这一重要中间体的合成路线研究较少。本文以2′-脱氧-L-核糖和胞嘧啶为原料,用对甲苯甲酰基保护糖的羟基,并在糖基和碱基的缩合反应中加入TMSOTf确保β构型产物的生成,经过多步合成得到目标产物(Scheme 1),其结构经1H NMR,13C NMR和MS确证。

Scheme 1
1 实验部分
1.1 仪器与试剂
Reichert-Thermovar型熔点仪;Bruker AVANCE III 400 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Waters ACQUITY UPLC H-CLASS-QDA型质谱仪。
2′-脱氧-L-核糖,纯度≥99.0%,芜湖华仁科技有限公司;胞嘧啶,纯度≥98.0%,上海迈瑞尔化学技术有限公司;氨的甲醇溶液,上海迈瑞尔化学技术有限公司;其余所用试剂均为分析纯或化学纯。
1.2 合成
(1) 1-氯-2-脱氧-3,5-二-O-对甲苯甲酰基-L-呋喃核糖(5)的合成
冰盐浴冷却,将2′-脱氧-L-核糖(2)13.41 g(0.1 mol)和无水甲醇200 mL加入反应瓶中,搅拌下持续通入干燥HCl气体,反应2 h得化合物3。减压蒸馏除尽甲醇,残余物加入吡啶250 mL、4-二甲氨基吡啶(DMAP)0.4 g(3.6 mmol)和三乙胺20.24 g(0.2 mol),于5 ℃滴加对甲基苯甲酰氯30.92 g(0.2mol),滴毕,升温至室温,反应过夜。析出白色固体4,过滤,滤液浓缩,残余物加入冰乙酸100 mL,持续通入干燥的HCl气体,过滤,滤饼用甲基叔丁醚打浆得白色固体527.2 g,收率70.0%,纯度98.1%,m.p.113~115 ℃(112~114 ℃[16]);1H NMRδ:7.82~7.88(m,4H),7.27~7.34(m,4H),5.81(t,J=7.0 Hz,1H),5.45~5.64(m,1H),4.25~4.59(m,2H),2.45(dt,J=13.6,6.8 Hz,1H),2.61(dt,J=13.6,6.8 Hz,1H),2.27(d,J=1.3 Hz,6H);13C NMRδ:166.0,165.8,143.6,143.5,129.9,129.9,129.5,129.5,129.5,129.4,129.2,129.1,126.5,126.3,89.2,84.5,75.4,63.9,40.2,21.3,21.3;MSm/z:411.1{[M+Na]+}。
(2) 3,5-二-O-对甲苯甲酰基-2′-脱氧-β-L-胞苷(6)
将胞嘧啶10.00 g(90 mmol),六甲基二硅氮烷(HDMS)500 mL和三甲基氯硅烷(TMSCl)180 mL加入反应瓶中,搅拌使其混合均匀;氮气保护下加热至130 ℃,回流反应5 h。减压蒸除去多余HDMS和TMSCl,加入二甲苯0.5 L,重蒸得米白色油状液体,不经处理直接投入下一步反应。
将米白色油状液体12.87 g(50 mmol)、化合物519.44 g(50 mmol)、三氟甲磺酸三甲基硅烷酯(TMSOTf)0.5 mL和二氯甲烷250 mL加入反应瓶中,搅拌使其混合均匀;氮气保护下,反应3 h。加入饱和KHCO3溶液,分液,水相用少量二氯甲烷萃取,合并有机相,依次用饱和食盐水洗涤,无水硫酸钠干燥,减压蒸除溶剂得米白色固体,加入100 mL混合溶液(乙醇/水=4/1,V/V),于83 ℃回流反应30 min。减压蒸除溶剂,经硅胶柱层析纯化得白色固体619.24 g,收率83.0%,纯度93.7%,m.p.192~196 ℃;1H NMRδ:7.66~7.99(m,5H),7.22~7.34(m,4H),7.02(s,2H),6.20(t,J=6.9 Hz,1H),5.68(d,J=10.8 Hz,1H),4.33(q,J=7.0 Hz,1H),4.10~4.22(q,J=7.0 Hz,1H),3.97(dd,J=12.4 Hz,7.0 Hz,1H),3.68(dd,J=12.5 Hz,6.9 Hz,1H),2.63(dt,J=13.6 Hz,7.0 Hz,1H),2.39(dt,J=13.6 Hz,7.0 Hz,1H),2.12(d,J=1.3 Hz,6H);13C NMRδ:165.8,165.6,165.5,156.5,145.6,141.3,141.2,129.9,129.9,129.5,129.5,129.4,129.4,129.2,129.1,128.0,127.2,95.9,92.3,85.2,75.3,63.4,37.7,21.4,21.3;MSm/z:464.1{[M+H]+}。
(3) 2′-脱氧-β-L-胞苷(1)的合成
将化合物616.22 g(35 mmol)和氨(7 eq.)的甲醇(250 mL)溶液加入反应瓶,氮气保护下,搅拌反应过夜。减压蒸除溶剂,用超干甲醇打浆,过滤,滤饼用二氯甲烷洗涤,减压蒸除溶剂得白色固体16.8 g,收率85.5%,纯度99.9%,m.p.208~210 ℃(214 ℃[16]),α=34.6°(c=0.6 mol/L,H2O);1H NMRδ:7.16(d,J=10.8 Hz,1H),7.11(s,2H),6.16(t,J=7.0 Hz,1H),5.72(d,J=10.8 Hz,1H),4.20(q,J=7.0 Hz,1H),4.10~4.16(m,1H),3.77(m,1H),3.55(m,1H),2.57(dt,J=13.6 Hz,7.0 Hz,1H),2.11(dt,J=13.6 Hz,7.0 Hz,1H),1.87(t,J=5.5 Hz,1H),1.74(d,J= 5.1 Hz,1H);13C NMRδ:165.5,156.5,142.3,95.7,92.1,88.7,70.1,62.0,40.5;MSm/z:228.3{[M+H]+}。
2 结果与讨论
2.1 5的合成
将2′-脱氧-L-核糖1-位甲苷化,得到脱氧L核糖甲苷。将3,5-位羟基用甲苯甲酰基保护起来得到化合物4。实验中,发现对甲苯甲酰氯和苯甲酰氯上保护基的效果都很好,且均易在氨水中水解去除。考虑到苯甲酰氯的危险性比对甲苯甲酰氯的危险性更高,所以选择了更符合绿色化学理念的对甲苯甲酰氯。最后,化合物4在冰醋酸中与HCl发生氯化反应,1-位甲苷转换成离去基团。通过甲基叔丁醚打浆得中间体5。
2.2 6的合成
卤化物在TMSOTf的催化下糖苷键合成过程中经历了两次SN2反应,第一次形成酰氧鎓离子,第二次形成核苷键,这样合成的核苷均为β构型,提高了产物β构型的获取率。
以中间产物4和5的反应为模板反应,研究了溶剂种类(No.1~5)、反应温度(No.1,6~8)和反应物比例(No.1,9~10)对收率的影响,结果见表1。由表1可见,以二氯甲烷和氯仿为溶剂,收率最高(83%)。考虑到氯仿的毒性更高、在碱性条件下不稳定等因素,选择二氯甲烷为最优溶剂。温度对反应的影响较大,在室温下,反应收率最高;低温下,反应收率均不足80%;在40 ℃时,由于中间体Ⅴ在高温下不稳定,收率也较低。
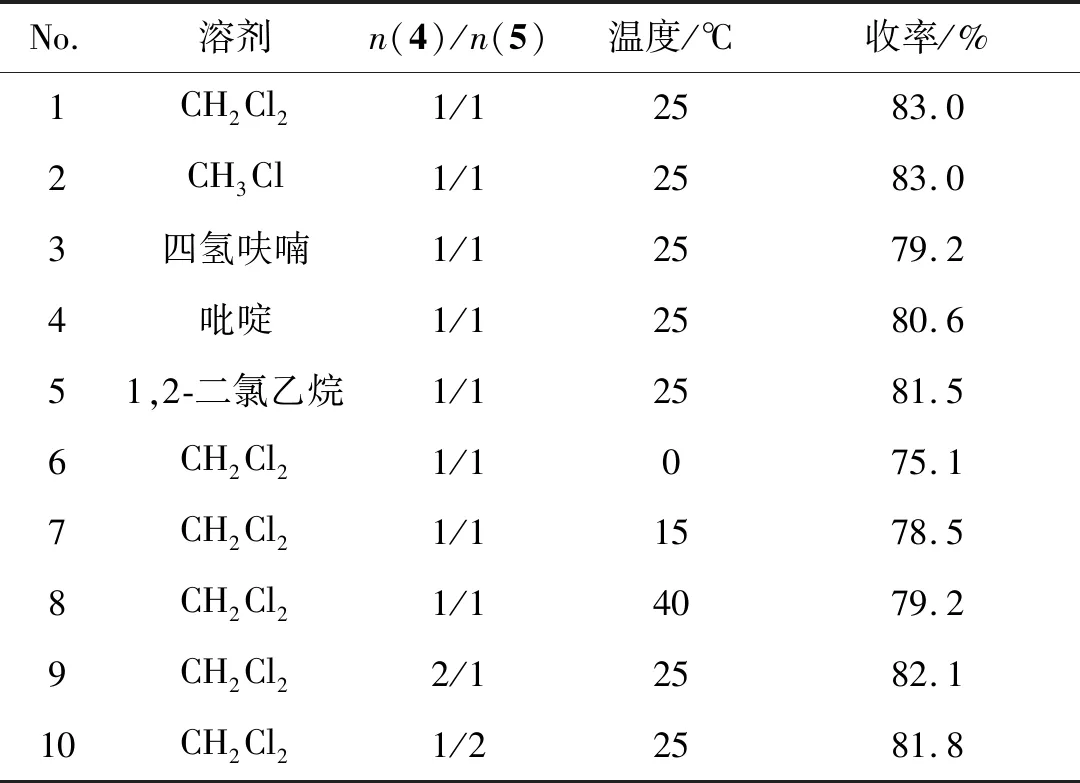
表1 溶剂、物料比及温度对收率的影响Table 1 Effects of solvent,ratio of starting materials and temperature on yield
综上,反应的最优条件为:二氯甲烷为溶剂,反应温度为室温,物料比为1/1。
以2′-脱氧-L-核糖和胞嘧啶为原材料,以49.7%的总收率合成了纯度达99.9%的目标产物2′-脱氧-β-L-胞苷。该方法具有原材料易得、反应溶剂毒性低、化学选择性和收率较高等优点,符合“绿色化学”理念。

