铜催化的苯并恶唑、五氟苯与O-苯甲酰羟胺的C—H键胺化反应
洪建权,杨宇鹏,霍连光,刘 洋,郑昌戈
(江南大学 化学与材料工程学院,江苏 无锡 214122)
芳香胺和杂芳香胺类化合物广泛存在于许多生物活性天然产物和药物分子中[1-3],特别是2-氨基唑类,被大量用于药物研发中。例如,2-氨基苯并恶唑是多种治疗剂的主要结构骨架,被用于治疗中枢神经系统疾病[4-6]、肺结核[7]和失眠症等[8]。
近年来C—N 键的构建反应取得了快速进展,涌现了大量的高效合成方法,包括目前已被广泛报道的过渡金属催化的交叉偶联。例如,亚胺的亲核加成[9],C—H键氮插入[10],胺的烷基化[11]和酶催化[12]等方法。其中,金属促进的C(sp2)—N键的偶联反应已成为最引人关注的方法之一[13]。在过去二十年以来,过渡金属催化的交叉偶联反应,尤其是Ullman-Goldberg和Buchwald-Hartwig型胺化/酰胺化反应已被大量地实验探索[14-17],并取得了出色的研究进展,成为构建有机含氮化合物的重要工具。
最近,金属促进的C—H/N—H直接氧化交叉偶联反应取得了一定的发展,这种策略是合成胺类化合物的有效方法,也是对合成胺方法的有效补充[18-19]。此外,涉及极性反转的亲电胺化反应也为C—N键的形成提供了实用且有效的方法[20],在这种策略中,采用了新型的R2N+试剂如卤化胺,O-苯甲酰羟胺,有机叠氮化物,肼类,恶吖丙啶和O-取代肟等[21]。其中,最引人注目的亲电胺化试剂是O-苯甲酰羟胺,这类R2N+试剂的制备方法简单,可通过过氧化苯甲酰与相关胺的反应得到,同时其在过渡金属催化的C—N键的形成中也表现出优秀的反应性[22-24]。以O-苯甲酰羟胺为R2N+源,利用钯催化的C—H键直接胺化反应,可高效地构建C—N键。在这研究领域中,余金权[22]、董广彬[23]和Ritter[24]等研究团队取得了突出的研究成果。此外,通过C(sp2)—H键的锌化,Wang等实现了铜催化的芳烃和杂芳烃的亲电胺化反应。最近,Miura和Yotphan报道了铜催化的缺电子芳烃和杂芳烃与O-苯甲酰羟胺的直接C—H键胺化反应[25-26],为芳香和杂芳香胺的合成提供了便捷的途径。2018年,Sen等报道了无溶剂及辅助配体条件下纳米铜催化的苯并噻唑及其衍生物与多种仲胺及其对应酰胺的胺化反应[27]。作为对这些方法的补充,我们报道了无辅助配体参与下铜催化的苯并恶唑C—H键直接胺化和N-杂环卡宾铜促进的五氟苯C—H键直接胺化。
本文的第一部分研究工作以CuI为催化剂,首先考察了苯并恶唑和O-苯甲酰-N,N-二异丙基羟胺在不同条件下的反应情况,确立最佳的反应条件。在最佳反应条件下,苯并恶唑与多种衍生于链状或环状仲胺的O-苯甲酰羟胺顺利发生反应,以中等到优秀收率得到系列2-氨基苯并恶唑衍生物(3a~3k,Scheme 1)。与文献报道的方法相比,本文最大的优点在于不需要往反应体系中添加任何辅助配体,这在铜催化的C—H键胺化反应中是未曾有报道的。此外,本研究体系反应条件较温和,官能团兼容性和底物普适性良好。本文的另外一部分工作主要研究了五氟苯与O-苯甲酰羟胺的亲电胺化反应。以CuI/IiPr·HCl为催化剂,在最优的反应条件下,五氟苯与各种具有链状以及环状单元的O-苯甲酰羟胺都能很好地发生反应,以20%~84%的收率得到多种五氟苯胺衍生物(5a~5b、5g~5h和5k~5r,Scheme 2)。这部分工作的最大特色是将氮杂环卡宾配体引入到C—H键胺化反应体系中,且该研究体系也具有较好的底物普适性。
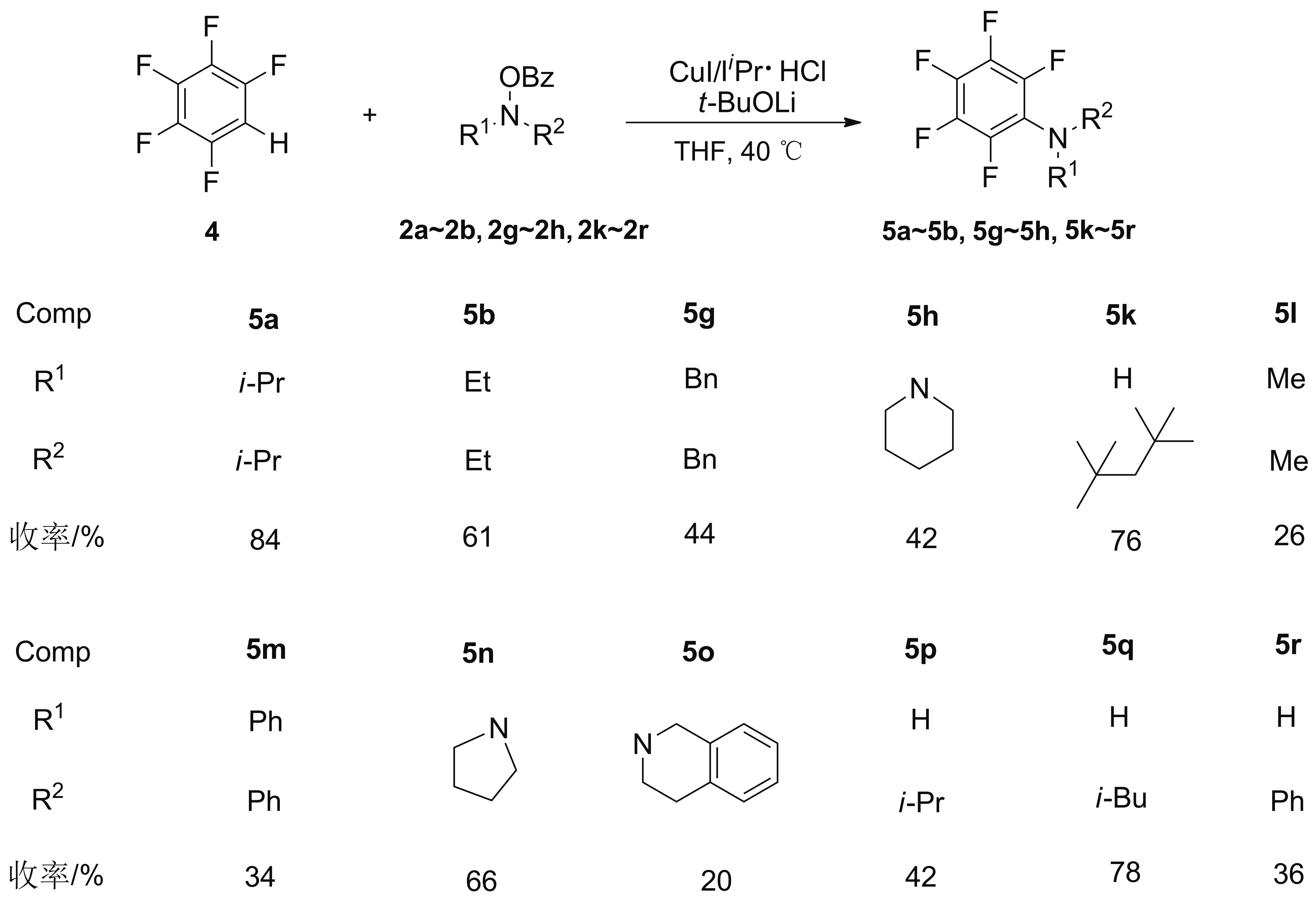
Scheme 2
1 实验部分
1.1 仪器与试剂
RY-2型显微熔点仪;Bruker AVANCE III 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标)。
O-苯甲酰羟胺(2)[28]、咪唑盐IPr·HCl[29]和IiPr·HCl[30]按文献方法合成;其余所用试剂均为分析纯或化学纯。
1.2 合成
(1) 碘化亚铜催化苯并恶唑的胺化反应
在氮气氛围中,将苯并恶唑(1)59.56 mg(0.5 mmol),CuI 19.05 mg(0.1 mmol),t-BuOLi 80.05 mg(1.0 mmol),20.75 mmol和THF 5 mL依次加入25 mL干燥的Schlenk反应管中,搅拌下于60 ℃反应6 h。冷却至室温,加入乙酸乙酯,用硅藻土过滤,滤液用二氯甲烷洗涤,收集洗液,浓缩,残余物经硅胶柱层析[洗脱剂:V(石油醚)/V(乙酸乙酯)=10/1~100/1]纯化得产物。
2-(N,N-二异丙基氨基)苯并恶唑(3a)[31]:无色油状液体100 mg,收率92%;1H NMR(CDCl3,400 MHz)δ:7.37(d,J=7.8 Hz,1H),7.27(d,J=8.4 Hz,1H),7.16(m,1H),7.03~6.95(m,1H),4.24(m,2H),1.39(d,J=6.8 Hz,12H);13C NMR(CDCl3,100 MHz)δ:162.3,148.5,143.0,123.7,119.8,115.6,108.4,47.4,20.9。
2-(N,N-二乙基氨基)苯并恶唑(3b)[31]:无色油状液体25 mg,收率42%;1H NMR(CDCl3,400 MHz)δ:7.37(dd,J=7.8 Hz,0.6 Hz,1H),7.26(dd,J=11.3 Hz,3.6 Hz,1H),7.16(td,J=7.7 Hz,1.1 Hz,1H),7.00(m,1H),3.60(q,J=7.2 Hz,4H),1.30(t,J=7.2 Hz,6H);13C NMR(CDCl3,100 MHz)δ:162.2,148.8,143.7,123.8,123.5,115.8,108.5,42.9,13.5。
2-(N,N-二丁基氨基)苯并恶唑(3c)[32]:无色油状液体86 mg,收率71%;1H NMR(CDCl3,400 MHz)δ:7.37(m,1H),7.24(m,1H),7.16(td,J=7.7 Hz,1.0 Hz,1H),6.99(td,J=7.8 Hz,1.0 Hz,1H),3.53(m,4H),1.69(dq,J=12.4 Hz,7.6 Hz,4H),1.41(dq,J=14.8 Hz,7.4 Hz,4H),0.98(t,J=7.4 Hz,6H);13C NMR(CDCl3,100 MHz)δ:152.4,150.0,140.0,125.5,124.5,120.6,110.9,49.8,32.3,20.5,14.0。
2-(N,N-二烯丙基氨基)苯并恶唑(3d)[32]:无色油状液体56 mg,收率52%;1H NMR(CDCl3,400 MHz)δ:7.39(dd,J=7.8 Hz,0.6 Hz,1H),7.27(d,J=8.1 Hz,1H),7.18(m,1H),7.03(td,J=7.8 Hz,1.1 Hz,1H),5.90(ddt,J=16.1 Hz,10.4 Hz,5.8 Hz,2H),5.32~5.22(m,4H),4.18(d,J=5.7 Hz,4H);13C NMR(CDCl3,100 MHz)δ:162.3,148.9,143.1,132.5,123.9,120.4,117.9,116.3,108.7,49.8。
2-(N-甲基-N-苄基氨基)苯并恶唑(3e)[26]:无色油状液体60 mg,收率50%;1H NMR(CDCl3,400 MHz)δ:7.36(m,7H),7.20(td,J=7.7 Hz,1.1 Hz,1H),7.05(td,J=7.8 Hz,1.2 Hz,1H),4.79(s,2H),3.16(s,3H);13C NMR(CDCl3,100 MHz)δ:163.0,149.0,143.5,136.4,128.8,127.7,124.0,120.4,116.2,108.7,53.9,35.2。
2-(N-乙基-N-苄基氨基)苯并恶唑(3f)[31]:无色油状液体78 mg,收率62%;1H NMR(CDCl3,400 MHz)δ:7.43(d,J=7.8 Hz,1H),7.37(m,4H),7.31(dd,J=8.0 Hz,5.1 Hz,2H),7.21(td,J=7.7 Hz,1.0 Hz,1H),7.05(td,J=7.8 Hz,1.1 Hz,1H),4.81(s,2H),3.60(q,J=7.1 Hz,2H),1.26(t,J=7.1 Hz,3H);13C NMR(CDCl3,100 MHz)δ:162.7,148.9,143.5,137.0,128.6,127.7,124.0,120.3,116.1,108.7,51.2,42.7,12.8。
2-(N,N-二苄基氨基)苯并恶唑(3g)[33]:白色固体97 mg,收率62%,m.p.80~82 ℃(81~82 ℃[33]);1H NMR(CDCl3,400 MHz)δ:7.44(dt,J=8.5 Hz,4.3 Hz,1H),7.37(m,5H),7.31(m,6H),7.23(m,1H),7.08(m,1H),4.75(s,4H);13C NMR(CDCl3,100 MHz)δ:163.2,148.9,143.5,136.3,128.8,128.0,127.8,124.1,120.6,116.3,108.9,50.4。
2-哌啶代苯并恶唑(3h)[32]:白色固体75 mg,收率74%,m.p.73~75 ℃(74~75 ℃[34]);1H NMR(CDCl3,400 MHz)δ:7.36(dd,J=7.8 Hz,0.6 Hz,1H),7.25(d,J=7.9 Hz,1H),7.16(m,1H),7.00(td,J=7.8 Hz,1.2 Hz,1H),3.67(m,4H),1.71(m,6H);13C NMR(CDCl3,100 MHz)δ:162.4,148.7,143.4,123.8,120.3,116.0,108.6,44.6,24.1,23.8。
2-吗啉代苯并恶唑(3i)[32]:白色固体73 mg,收率72%,m.p.90~92 ℃(91~94 ℃[34]);1H NMR(CDCl3,400 MHz)δ:7.39(d,J=7.1 Hz,1H),7.28(d,J=6.9 Hz,1H),7.17(dd,J=15.0 Hz,7.9 Hz,1H),7.12~7.00(m,1H),3.82(br s,4H),3.70(br s,4H);13C NMR(CDCl3,100 MHz)δ:162.0,148.7,142.9,124.1,121.0,116.3,108.8,66.2,45.8。
2-异丁氨基苯并恶唑(3j)[35]:无色油状液体46 mg,收率48%;1H NMR(CDCl3,400 MHz)δ:7.78(d,J=7.1 Hz,2H),7.44(m,2H),6.53(s,1H),3.27(t,J=6.4 Hz,2H),1.96~1.83(m,1H),0.97(d,J=6.6 Hz,6H);13C NMR(CDCl3,100 MHz)δ:152.4,149.9,140.0,125.5,124.5,120.5,110.8,50.1,31.4,19.9。
2-(1,1,3,3-四甲基丁氨基)苯并恶唑(3k)[36]:白色固体84 mg,收率68%,m.p.94~96 ℃(95~97 ℃[36]);1H NMR(CDCl3,400 MHz)δ:7.43(d,1H),7.32(d,J=13.6 Hz,1H),7.28(s,1H),7.19(t,J=7.1 Hz,1H),7.05(t,J=7.7 Hz,1H),6.02(br s,1H),1.88(s,J=6.1 Hz,2H),1.57(s,6H),1.04(s,9H);13C NMR(CDCl3,100 MHz)δ:141.9,130.8,128.8,123.9,120.4,115.9,108.6,56.1,52.0,31.5,29.4。
2-(N,N-二苄氨基)-5-氯苯并恶唑(3g′)[37]:白色固体113 mg,收率66%,m.p.85~87 ℃;1H NMR(CDCl3,400 MHz)δ:7.37~7.30(m,7H),7.27(m,4H),7.17(d,J=8.4 Hz,1H),7.0(m,1H),4.69(s,4H);13C NMR(CDCl3,100 MHz)δ:163.9,147.5,144.8,135.0,128.8,128.0,127.9,120.4,116.4,109.4,50.4。
2-哌啶-5-氯苯并恶唑(3h′)[26]:淡黄色固体92 mg,收率78%,m.p.87~79 ℃;1H NMR(CDCl3,400 MHz)δ:7.33~7.27(m,2H),6.93(m,1H),3.65(br s,4H),1.68(br s,6H);13C NMR(CDCl3,100 MHz)δ:163.1,147.3,144.8,129.1,120.0,116.0,109.0,46.6,25.2,24.0。
(2) 碘化亚铜催化五氟苯的胺化反应
在氮气氛围中,将484.03 mg(0.5 mmol),CuI 19.05 mg(0.1 mmol),t-BuOLi 80.05 mg(1.0 mmol),IiPr·HCl 0.1 mmol,20.75 mmol和THF 5 mL依次加入25 mL干燥的Schlenk反应管中,搅拌下于40 ℃反应6 h。冷却至室温,加入乙酸乙酯,用硅藻土过滤,滤液浓缩,残余物经硅胶柱层析(洗脱剂:石油醚)纯化得产物。
N,N-二异丙基-2,3,4,5,6-五氟苯胺(5a)[38]:无色油状液体112 mg,收率84%;1H NMR(CDCl3,400 MHz)δ:3.95(m,2H),1.71(d,J=6.6 Hz,12H);13C NMR(CDCl3,100 MHz)δ:147.3,144.9,143.1,140.5,138.7,136.3,100.6,42.7,25.9。
N,N-二乙基-2,3,4,5,6-五氟苯胺(5b):无色油状液体74 mg,收率62%;1H NMR(CDCl3,400 MHz)δ:3.44(qd,J=7.0 Hz,0.9 Hz,4H),1.17(td,J=7.0 Hz,1.0 Hz,6H);13C NMR(CDCl3,100 MHz)δ:147.4,144.9,143.1,140.5,138.8,136.3,100.7,43.8,15.1。
N,N-二苄基-2,3,4,5,6-五氟苯胺(5g)[25]:无色油状液体80 mg,收率44%;1H NMR(CDCl3,400 MHz)δ:7.42(m,10H),4.41(s,4H);13C NMR(CDCl3,100 MHz)δ:146.5,139.5,139.2,137.7,136.8,128.5,127.7,124.9,57.2。
1-全氟苯基哌啶(5h):无色油状液体53 mg,收率42%;1H NMR(CDCl3,400 MHz)δ:3.14(dd,J=7.3 Hz,3.4 Hz,4H),1.70(m,4H),1.60(m,2H);13C NMR(CDCl3,100 MHz)δ:147.3,144.8,138.7,136.4,100.6,47.3,27.1,25.0。
N-(1,1,3,3-四甲基丁基)-2,3,4,5,6-五氟苯胺(5k):无色油状液体112 mg,收率76%;1H NMR(CDCl3,400 MHz)δ:3.06(br s,1H),1.66(s,2H),1.26(s,6H),1.09(s,9H);13C NMR(CDCl3,100 MHz)δ:143.5,141.1,139.2,137.4,136.9,121.2,58.7,55.5,31.6,29.2。
N,N-二甲基-2,3,4,5,6-五氟苯胺(5l)[39]:无色油状液体27 mg,收率26%;1H NMR(CDCl3,400 MHz)δ:2.37(s,6H);13C NMR(CDCl3,100 MHz)δ:147.3,144.9,143.0,140.5,138.7,136.3,100.7,38.4。
N,N-二苯基-2,3,4,5,6-五氟苯胺(5m)[40]:白色固体57 mg,收率34%,m.p.70~72 ℃(71~73 ℃[39]);1H NMR(CDCl3,400 MHz)δ:7.56(dt,J=3.5 Hz,2.1 Hz,4H),7.35(m,2H),7.28(m,4H);13C NMR(CDCl3,100 MHz)δ:147.4,144.9,143.2,143.1,140.5,138.8,136.4,129.33,121.0,117.8,100.7。
1-全氟苯基吡咯烷(5n):无色油状液体78 mg,收率66%;1H NMR(CDCl3,400 MHz)δ:3.54(m,4H),1.68(m,4H);13C NMR(CDCl3,100 MHz)δ:147.4,144.9,143.0,140.5,138.8,136.2,100.6,46.9,25.4。
2-全氟苯基-1,2,3,4-四氢异喹啉(5o)[41]:无色油状液体30 mg,收率20%;1H NMR(CDCl3,400 MHz)δ:7.23(m,2H),7.18(m,1H),7.04(dd,J=4.7 Hz,3.7 Hz,1H),4.85(s,2H),4.05(dd,J=7.7 Hz,3.8 Hz,2H),2.93(t,J=5.7 Hz,2H);13C NMR(CDCl3,100 MHz)δ:147.4,144.9,143.1,140.6,138.8,136.3,134.9,133.2,128.9,126.3,126.0,124.4,100.8,68.0,65.4,28.3。
N-异丙基-2,3,4,5,6-五氟苯胺(5p):无色油状液体47 mg,收率42%;1H NMR(CDCl3,400 MHz)δ:3.89~3.78(m,1H),1.21(t,J=7.3 Hz,6H);13C NMR(CDCl3,100 MHz)δ:147.4,144.9,143.1,140.4,138.8,136.3,100.7,45.2,23.1。
N-仲丁基-2,3,4,5,6-五氟苯胺(5q)[42]:无色油状液体93 mg,收率78%;1H NMR(CDCl3,400 MHz)δ:3.62(m,1H),2.77(br s,1H),1.52(m,2H),1.19(d,J=7.9 Hz,3H),0.98(t,J=7.4 Hz,3H);13C NMR(CDCl3,100 MHz)δ:139.4,136.9,134.7,132.1,123.4,52.8,30.6,21.1,10.0。
N-苯基-2,3,4,5,6-五氟苯胺(5r)[43]:无色油状液体47 mg,收率36%;1H NMR(CDCl3,400 MHz)δ:8.11(m,2H),7.68(m,1H),7.58~7.51(m,2H);13C NMR(CDCl3,100 MHz)δ:147.4,144.9,143.2,143.1,140.6,138.7,136.4,129.3,121.1,117.8,100.7。
2 结果与讨论
2.1 苯并恶唑的胺化反应
(1) 反应条件优化
以苯并恶唑(1)和O-苯甲酰-N,N-二异丙基羟胺(2a)的反应为模板反应,研究了反应条件对产物收率的影响,结果见表1。由表1(Entries 1~7)可知,一价铜盐比二价铜盐具有更高的催化活性。在THF中,CuI/t-BuOLi体系可催化化合物1的胺化反应,以71%的收率得到产物3a(Entry 3)。Entries 8~10为碱对反应的影响。强碱如t-BuONa和t-BuOK或弱碱K2CO3均会使收率降低。随后,还考察了温度对反应的影响,结果发现当反应温度为60 ℃时,产物3a的收率可高达92%(Entry 11)。
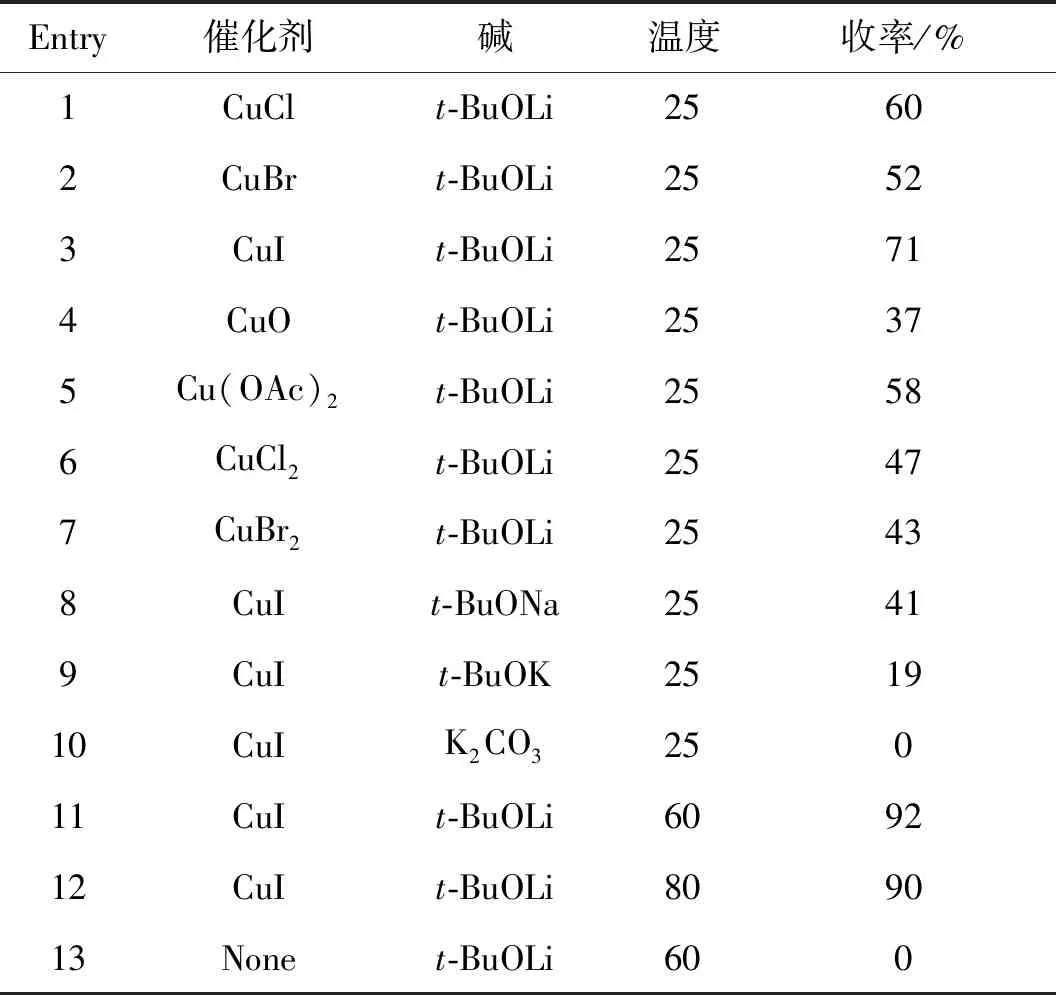
表1 化合物1和2a的反应条件筛选Table 1 Screening conditions for the reaction of 1 with 2a
(2) 反应底物的拓展
在最优反应条件下(表1,Entry 11),进行了底物拓展。由Scheme 1可知,1与衍生于链状或环状仲胺化合物的O-苯甲酰羟胺2的反应都可以给出中等到优秀收率的2-氨基苯并恶唑衍生物3。例如,链状羟胺底物中含有N,N-二异丙基、N,N-二乙基、N,N-二正丁基、N,N-二烯丙基、N,N-二苄基、N-乙基-N-苄基、N-苄基-N-甲基等单元的化合物(Scheme 1,化合物2a~2g)以及环状O-苯甲酰羟胺底物中具有哌啶和吗啉单元的化合物(Scheme 1,化合物2h~2i)都能很好的适应模板反应。值得注意的是,O-苯甲酰羟胺底物中含有额外氧原子的化合物2i也能很好地适应该反应条件且以72%的收率给出胺化产物3i。此外,衍生于伯胺的O-苯甲酰羟胺底物2j和2k都具有很好的反应兼容性,以中等到良好的收率生成相应的2-氨基苯并恶唑衍生物3j和3k。最重要的是,该反应无需额外的辅助配体就能顺利进行,而在类似的铜催化的亲电胺化反应报道中[44],辅助配体在整个反应中具有至关重要的作用。此外,还考察了5-甲基苯并恶唑、5-氯苯并恶唑与O-苯甲酰羟胺的反应性质,结果发现甲基取代的苯并恶唑反应活性很差,仅给出痕量的胺化产物,而氯原子取代的苯并恶唑反应活性较高,其与O-苯甲酰-N,N-二苄基羟胺和苯甲酸哌啶酯能顺利发生反应,分别以65%和78%的收率得到2-氨基苯并恶唑衍生物3g′和3h′,这些结果表明给苯环上的给电子基团使苯并恶唑的酸性减弱,反应活性降低。相反,吸电子的氯原子使苯并恶唑的酸性增强,反应活性提高。
2.2 五氟苯的胺化反应
(1) 反应条件优化
探索了碘化亚铜催化的O-苯甲酰羟胺与4的胺化反应。遗憾的是,在上述最优条件下,五氟苯4和O-苯甲酰-N,N-二甲基羟胺2a的反应只给出了痕量的胺化产物5a(表2,Entry 1)。为了提高铜的催化效率,尝试向反应体系中添加一些辅助配体。氮杂环卡宾(NHC)作为良好的σ-电子供体化合物,可与后过渡金属以及部分主族元素形成稳定的配合物,同时还赋予了这些配合物优秀的催化性能[45-46]。例如,氮杂环卡宾铜配合物在许多有机催化研究报道中都表现出优异的催化活性[47-48]。将咪唑盐IPr·HCl添加到模板反应中,确实可将产物5a的收率提高至14%(表2,Entry 2)。随后又测试了其它咪唑盐以及有机配体对该反应的影响,结果发现具有更小体积的咪唑盐IiPr·HCl能够显著地提高反应收率,以62%的收率获得目标胺化产物(表2,Entry 3)。经过进一步对反应温度进行优化,最终确立了反应的最佳条件为:40 ℃下,以CuI/IiPr·HCl为催化剂,底物在THF中反应6 h,得到84%的胺化产物(表2,Entry5)。
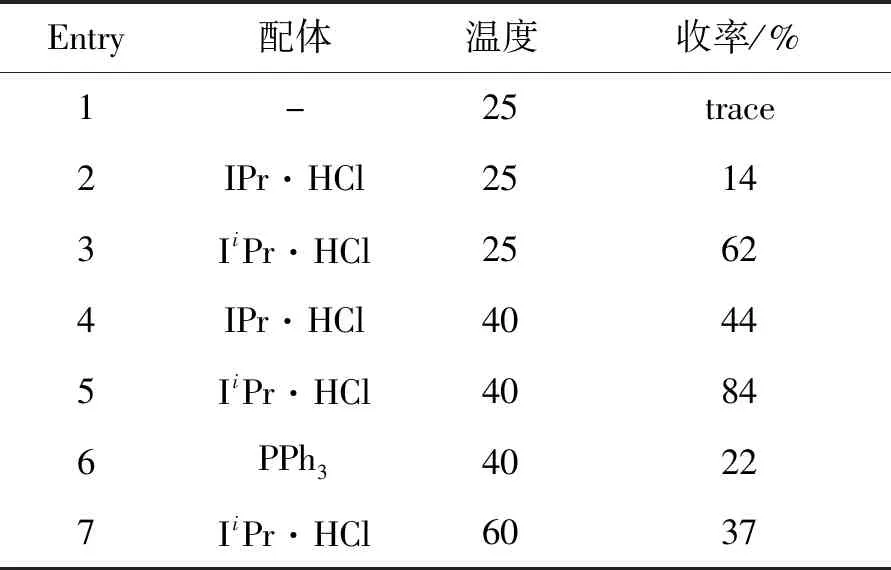
表2 化合物4和2a的反应条件优化Table 2 Optimization of reaction conditions of 4 and 2a
(2) 底物拓展
为了探究反应的官能团兼容性以及底物的适用范围,研究了5和2在最佳反应条件下的胺化反应。总的来说,除了少数底物如二甲胺和四氢喹啉衍生物的反应收率较低之外,链状以及具有环状单元的O-苯甲酰羟胺都能很好的适用于该反应体系,以中等到良好的收率生成相应的五氟苯胺(Scheme 2,化合物5a~5b,5g~5h和5l~5o)。对于伯胺衍生化的O-苯甲酰羟胺,胺化反应产物也取得了中等到良好的收率(Scheme 2,化合物5k和5p~5r),且体积较大的伯胺衍生物比体积小的伯胺衍生物具有更高的反应转化率。许多五氟苯胺化合物收率偏低主要由三方面的原因所致:(1)底物自身的反应活性偏低,需要较长的反应时间才能完成;(2)五氟苯的沸点较低,挥发性强,在加热条件下容易气化,导致反应效率降低。(3)部分产物容易挥发,在分离提纯的过程中也会存在部分损失。
通过实验验证了碘化亚铜催化的苯并恶唑以及五氟苯与O-苯甲酰羟胺的直接亲电子胺化反应。此类反应可在温和的条件下顺利进行,且具有良好的官能团兼容性和底物适用范围。该方法为芳香胺和杂芳香胺的构建提供了一种便捷有效的合成路线。

