新型寡聚噻吩的设计、合成及其光物理和电化学性质
徐同乐,曹 皓,商务云,段泰男*
(1.中国科学院 重庆绿色智能技术研究院 有机半导体中心,重庆 400714;2.中国科学院大学,北京 100049;3.西南大学 化学化工学院,重庆 400715)
本体异质结有机太阳能电池由于其轻质、柔性及可溶液化大面积制备等优点,已受到越来越多科研工作者的关注。随着光伏材料的发展和器件技术的提高,有机太阳能的能量转化效率已经从不足1%增长至约15%。
目前,高效太阳能电池主要以聚合物为给体,相对于聚合物批次差异和不易纯化等缺点,小分子给体的优势更加明显,如确定的化学结构,可调控的能级以及效率可重复性高,因此小分子给体逐渐成为研究热点。高效小分子主要以苯并[1,2-b:4,5-b′]二噻吩(BDT)及其衍生物为主。陈永胜等通过在BDT的正交方向上引入新的共轭基团,构筑了二维BDT,促进了体系中π电子的离域,形成了良好的分子间堆积,增强了分子间电荷传输,提高了能量转化效率[18]。
噻吩是有机太阳能材料最常用的结构单元之一,具有稳定性更高、电荷传输功能更强以及合成简单等优点。如选择合适的碳链骨架和封端基团,简单的寡聚噻吩也能取得很高的能量转化效率[19]。陈永胜小组曾报道了最高效率的基于寡聚噻吩为小分子给体,但该小组并没有开展其他延续性改进工作。
基于此,本文通过改变侧链的排布,设计并合成了两种新型寡聚噻吩材料(DC5T和DC7T,Scheme 1)。以3,4-二溴噻吩为底物,通过Kumada交叉偶联反应得到3,4-二辛基噻吩,然后分别通过N-溴代酰亚胺(NBS)上溴、Still偶联、Knoevenagel 缩合反应等反应得到目标产物,其结构经1H NMR,13C NMR,UV-Vis,MS和CV表征。并以目标产物为给体,组装成全小分子太阳能电池,对其光伏性能进行了研究。
1 实验部分
1.1 仪器与试剂
Perkin Elmer Lambda 750型分光光度计;Bruker AV 400/600 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标) ;CHI600E型电化学工作站。
1,安耐吉;中间体2、8、9按文献[3]方法合成;其余所用试剂均为分析纯。
1.2 合成
(1) 中间体3和6的合成(以3为例)
向50 mL干燥的反应瓶中加入中间体22.23 g(7.23 mmol)和20 mL THF,避光,于0 ℃分批加入NBS 1.35 g(7.60 mmol),加毕,搅拌下于室温反应2 h。加入20 mL水猝灭反应,用EA(2×50 mL)萃取,合并有机相,依次用饱和NaCl溶液(2×70 mL)洗涤,无水硫酸钠干燥,旋除有机溶剂,粗产物经硅胶柱层析(洗脱剂:PE)纯化得淡黄色油状液体32.30 g,收率82.38%;1H NMRδ:6.83(s,1H),2.60~2.40(m,4H),1.60~1.45(m,4H),1.40~1.25(m,20H),0.91~0.86(m,6H);13C NMRδ:136.84,135.87,114.76,104.00,26.73,24.51,24.46,24.35,24.31,24.21,24.17,24.09,22.95,17.51,8.93。
用类似的方法合成黄色油状液体6,收率95.03%;1H NMRδ:9.88(s,1H),9.88(s,1H),7.68(d,J=3.6 Hz,1H),7.15(d,J=3.6 Hz,1H),2.75~2.71(t,J=7.8 Hz,2H),2.56~2.52(t,J=8.4 Hz ,2H),1.52(m,4H),1.29(m,20H),0.88(m,6H);13C NMRδ:182.52,145.70,143.39,142.58,141.10,136.58,130.06,126.33,111.17,31.88,31.87,31.84,30.46,29.75,29.69,29.57,29.35,29.32,29.24,29.23,29.19,29.14,28.68,22.67,14.08。
(2) 中间体4和10的合成(以4为例)
在干燥的50 mL反应瓶中加入中间体31.78 g(4.61 mmol)和THF 20 mL,搅拌下冷却至-78 ℃,缓慢滴加正丁基锂(5.07 mmol)的THF(2.11 mL)溶液,滴毕,搅拌反应1 h;迅速向体系中加入三丁基氯化锡溶液1.80 g(5.53 mmol),搅拌下于室温反应过夜。用KF溶液猝灭反应,EA(2×50 mL)萃取,合并有机相,依次用饱和NaCl溶液(2×70 mL)洗涤,无水硫酸钠干燥,旋除有机溶剂得油状液体42.80 g,无需纯化,直接投入下一步反应。
用类似方法合成无色油状液体10,无需纯化,直接投入下一步反应。
(3) 中间体5,7,11的合成
氮气保护下,将中间体4(4.61 mmol),5-溴-2-噻吩甲醛0.73 g(3.84 mmol),四三苯基膦钯0.44 mg(0.38 mmol)和干燥甲苯依次加至反应瓶中,于130 ℃回流反应48 h。冰水猝灭反应,EA(2×50 mL)萃取,合并有机相,依次用饱和NaCl溶液(2×70 mL)洗涤,无水硫酸钠干燥,旋除有机溶剂,残余物经硅胶柱层析(洗脱剂:PE/EA=100/1,V/V)纯化得黄色油状液体51.29 g,收率80.10%;1H NMRδ:9.87(s,1H),7.69(d,J=4.2 Hz,1H),7.20(d,J=4.2 Hz,1H),6.96(s,1H),2.77~2.70(t,J=8.4 Hz,2H),2.55~2.48(t,J=7.8 Hz ,2H),1.70~1.60(m,2H),1.56~1.50(m,2H),1.43~1.38(m,4H),1.35~1.25(m,16H),0.96~0.81(m,6H);13C NMRδ:182.72,147.64,144.54,142.18,140.78,136.56,130.01,126.24,121.27,31.89,31.87,30.19,29.83,29.74,29.59,29.48,29.31,29.27,29.23,29.23,29.15,29.15,27.92,22.68,14.09。
用类似的方法合成橙红色固体7,收率88.21%;1H NMRδ:9.98(s,2H),7.71(d,J=3.6 Hz ,2H),7.24(d,J=3.6 Hz,2H),7.14(s,2H),2.82~2.71(m,8H),1.59~1.54(m,10H),1.45~1.43(m,10H),1.34~1.28(m,28H),0.88(m,1H);13C NMRδ:182.46,146.30,142.69,142.31,140.90,136.63,136.00,131.88,129.02,126.60,126.16,31.89,31.86,31.86,30.68,30.44,29.91,29.90,29.29,29.27,29.27,29.22,29.22,28.42,28.23,22.67,14.06。
用类似的方法合成红色固体11,收率90.13%;1H NMRδ:9.89(s,2H),7.71(d,J=3.9 Hz,2H),7.24(d,J=3.9 Hz,2H),7.13(d,J=3.6 Hz,2H),7.11(d,J=3.6 Hz,2H),2.79~2.72(m,12H),1.63~1.54(m,18H),1.47~1.43(m,12H),1.35~1.27(m,42H),0.89~0.85(m,19H);13C NMRδ:182.53,146.42,142.71,142.18,140.73,140.51,136.77,136.64,135.31,132.14,129.82,128.81,126.54,126.07,31.93,31.92,31.89,30.74,30.71,30.44,29.98,29.95,29.93,29.32,29.30,29.25,28.44,28.32,28.24,22.71,22.69,14.12。
(4) DC5T和DC7T的合成(以DC5T为例)
向50 mL反应瓶中加入氯仿8 mL,醋酸20 mL,中间体70.64 g(0.70 mmol),罗丹明0.81 g(4.20 mmol)和适量醋酸铵,于100 ℃回流反应过夜。加入冰水猝灭反应,用DCM(2×50 mL)萃取,合并有机相,依次用饱和NaCl溶液(2×70 mL)洗涤,无水硫酸钠干燥,旋除有机溶剂,残余物经硅胶柱层析(洗脱剂:CF/PE=4/1,V/V)纯化得黑色固体产物DC5T 0.83 g,收率92.12%;1H NMRδ:8.05(s,2H),7.44(d,J=4.0 Hz,2H),7.26(d,J=4.0 Hz,2H),7.16(s,2H),4.34~4.30(m,4H),2.81~2.74(m,8H),1.62~1.54(m,10H),1.46~1.40(m,10H),1.32~1.26(m,34H),0.92~0.86(m,12H);13C NMRδ:165.85,165.30,145.63,142.87,141.05,136.01,135.83,135.65,132.22,128.77,128.49,126.90,126.73,113.54(s),113.01,112.24,55.87,40.65,31.89,30.66,30.41,30.33,29.93,29.87,29.68,29.32,29.30,29.15,28.62,28.26,22.67,14.17,14.09,14.07;MSm/z:Calcd for C70H86N6O2S7[M+]1267.9180,found 1267.4940。
用类似的方法合成红色固体DC7T,收率94.41%;1H NMRδ:8.03(s,2H),7.44~7.40(d,J=4.1 Hz,2H),7.26~7.29(d,J=2.1 Hz,2H),7.15~7.14(d,J=3.8 Hz,2H),7.10~7.09(d,J=3.8 Hz,2H),4.35~4.27(m,4H),2.81~4.72(m,12H),1.66~1.55(m,16H),1.51~1.42(m,14H),1.37~1.24(m,48H),0.93~ 0.85(m,18H);13C NMRδ:165.85,165.84,165.33,145.76,142.89,140.79,140.55,136.76,135.72,135.67,135.17,132.54,129.85,128.52,126.77,126.64,126.07,113.34,113.06,112.29,55.75,40.63,31.93,30.71,30.68,30.38,30.00,29.96,29.90,29.34,29.30,29.20,28.66,28.34,28.28,22.71,14.19,14.13;MSm/zCalcd for C94H122N6O2S9[M+]1655.7149,found 1655.7134。
2 结果与讨论
2.1 表征
(1) UV-Vis
图1为两种寡聚噻吩的UV-Vis谱图。由图3可知,DC5T和DC7T在300~750 nm均有较强吸收,能量较高的吸收谱带源于π-π*跃迁,590~600 nm处能量较低的吸收峰是由分子内给电子单元和吸电子单元之间的分子内电荷转移作用产生的。DC5T吸收峰边界位于732 nm左右,光学带隙大约为1.68 eV,属于窄带隙材料。DC7T由于有更多的给电子单元,具有更好的平面性和更强的供电性,使得DC7T的谱线有所红移,其吸收边界大约为740 nm,光学带隙大约为1.67 eV,也属于窄带隙材料。450 nm附近出现肩峰与分子结构的复杂性有关,说明分子内存在多种跃迁机制。
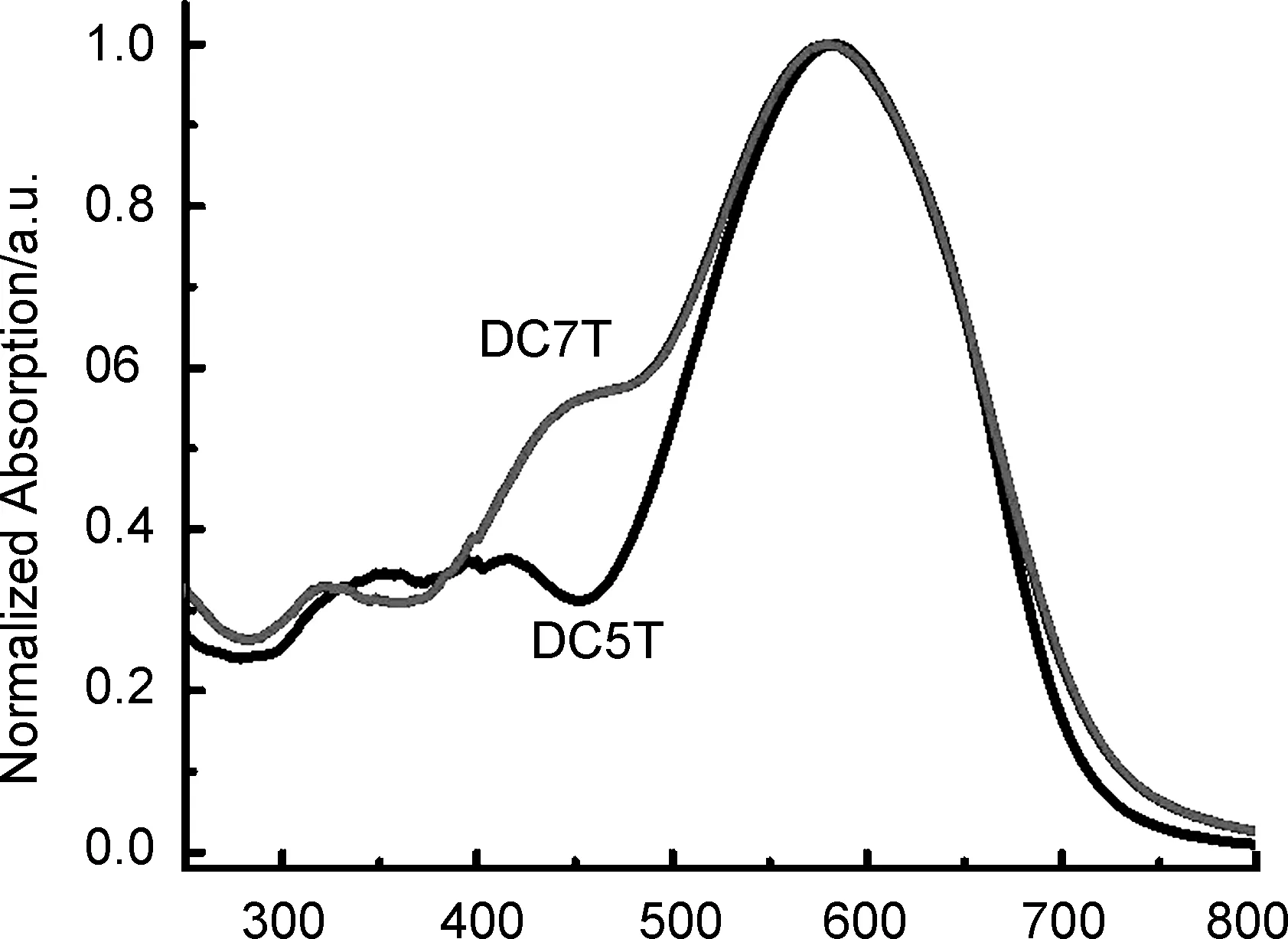
λ/nm图1 薄膜状态下DC5T和DC7T的UV-Vis 谱图Figure 1 UV-Vis spectra of DC5T and DC7T in film
(2) CV
图2为DC5T和DC7T的CV曲线(正扫)。由图2可知,小分子DC5T的Eox为0.865 eV,计算得DC5T的HOMO能级为-5.11 eV。小分子DC7T的Eox为0.74 eV,这是因为DC7T有更多的噻吩共轭链,相对于DC5T更富电子,故呈现更低的氧化峰位。经计算,DC7T的HOMO能级为-4.98 eV。由两个给体材料的能级可知,DC5T相对于DC7T具有更深的HOMO能级,对于以它们为给体的有机太阳能电池,DC5T可能会获得更高的开路电压。
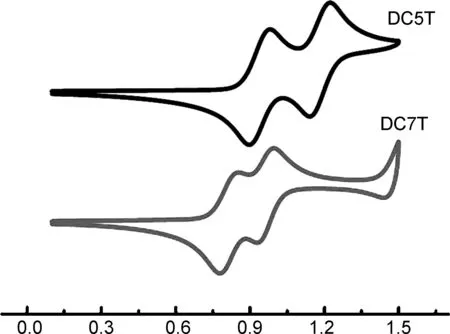
Potential/v图2 DC5T和DC7T的CV曲线Figure 2 CV curves of DC5T and DC7T
2.2 光伏性能
分别以DC5T和DC7T作为给体材料,氯仿为溶剂,用旋涂法制备了相应的太阳能器件,其光伏性能见表1。由表1可知,相对于DC5T,DC7T器件的效率略有提高,器件的开路电压为0.91 V,短路电流密度为6.03 mA·cm-2,填充因子为37.91%,相应的光电转化效率为2.08%。虽然新合成的两种新型寡聚噻吩光电转化效率并不高,但经过进一步的受体筛选和器件工艺优化,这类太阳能电池的光伏性能或可有提高。

表1 基于DC5T和DC7T的器件的光伏性能Table 1 The photovoltaic properties of the devices based DC5T and DC7T
以3,4-二辛基噻吩为底物,二氰基罗丹明为封端基团设计合成了两种新型寡聚噻吩(DC5T和DC7T)。DC5T和DC7T均在400~750 nm有较强吸收,吸收边界分别位于732 nm和740 nm。此外,两种新型寡聚噻吩均具有较深的最高占据分子轨道(HOMO)能级和最低未占分子轨道(LUMO)能级。基于新型寡聚噻吩组装的小分子太阳能电池器件的最高光电转换效率可达2.08%。

