常春藤皂苷元的糖化学修饰与体外抗COLO205细胞增殖活性
杨诗雯,李 军,洪开文,王 欢,张勇民,董登祥*
(1.贵州中医药大学 药学院,贵州 贵阳 550025;2.安顺职业技术学院 应用医药系,贵州 安顺 561000;3.贵州威门药业股份有限公司 研发部,贵州 贵阳 550018;4.巴黎第六大学 法国国家科研中心,法国 巴黎 75005)
常春藤皂苷元(He),化学名为(3β,4α)-3,23-二羟基-12-烯-28-酸(Chart 1),是一种五环三萜类化合物,通常可从威灵仙、金银花、中华常春藤等植物中提取。本研究所用He分离提取于贵州道地药材山银花(LoniceraeFlos)黄褐毛忍冬(Lonicerafulv)[1]。

Chart 1
常春藤皂苷元拥有着较佳的生物学活性,具有抗炎、保护肝脏、抗凝血、抗抑郁、抗肿瘤、抗菌、抗AS等药理作用,具有优越的未来开发应用价值[2]。近年来值得注意的是体外药理研究中常春藤皂苷元对于多种恶性肿瘤细胞株有着较好的抑制活性,如前列腺癌细胞DU145[3]、胃癌细胞MGC-8[4]、肝癌细胞HepG2[5]和肠癌细胞LoVo、SW480[6-7]等。常春藤皂苷元可以抑制癌细胞的增殖、黏附、迁移能力,通过线粒体途径促进癌细胞的凋亡自噬,并阻碍癌细胞的细胞周期,以此实现其抗肿瘤活性[4]。因此在恶性肿瘤治疗领域,He具有潜在应用价值。但在常见药用溶剂中溶解度较差的性质,决定了其生物利用度不高的重大缺陷,局限了其在进行基础药理研究,限制了其未来临床研究中的实际运用。
本文拟对He进行结构改进修饰,以增加糖片段的方式,改善其溶解度、生物利用度差的特性。作为构成生命的基本物质之一,多羟基的特性决定了糖具有良好的水溶性,同时糖类本身也具有抑制肿瘤表达的生物功能[8]。
常春藤皂苷元可通过常春藤皂苷水解后得到,对其的结构修饰通常发生在C-23、C-28和C-3位置。在C-28位上有杂环酯的常春藤皂苷元衍生物表现出明显优于He的抗肿瘤活性[9]。使用1,3-偶极环加成在He的C-28位引入芳基-1H-1,2,3-三唑-4-甲酯,也可以表现出更高水平的抗肿瘤活性[10]。此外,在He的C-23位引入2,6-二甲基吡嗪结构,也能提高该化合物的体外抗肿瘤效果[11]。而在He的C-3位衍生化方面,多种3,4,5-甲氧基苯甲酰基常春藤皂苷元衍生物表现出良好的抑制肿瘤细胞增殖的效果[12]。
与苷元构成的糖苷中的糖,一般采用的包括有葡萄糖、氨基葡萄糖、岩藻糖、半乳糖、葡萄糖醛酸、阿拉伯糖、鼠李糖等,与常春藤皂苷元的C3位的羟基连接成糖苷[5]。本文采用糖化学改性方法,以He为起始原料,酯化羧基进行保护,得到化合物2;乙酰化保护C23位羟基得到化合物3;乙酰化、苯甲酰化、甲基化等方法保护糖片段的羟基部位,以及通过糖片段5-C上羟基的苄基化保护,将单糖连接合成二糖、四糖,得到化合物W、X、Y、Z;然后在He的C-3位的羟基位置连接糖片段,得到一系列常春藤皂苷元糖基化衍生物a~d,最后用对酸稳定的NaOMe脱去保护基团,得到终产物常春藤皂苷元衍生物(4~7,Scheme 1),其结构经1H NMR 和13C NMR表征。采用MTT法检测了化合物对人结肠癌细胞COLO205的抑制活性。
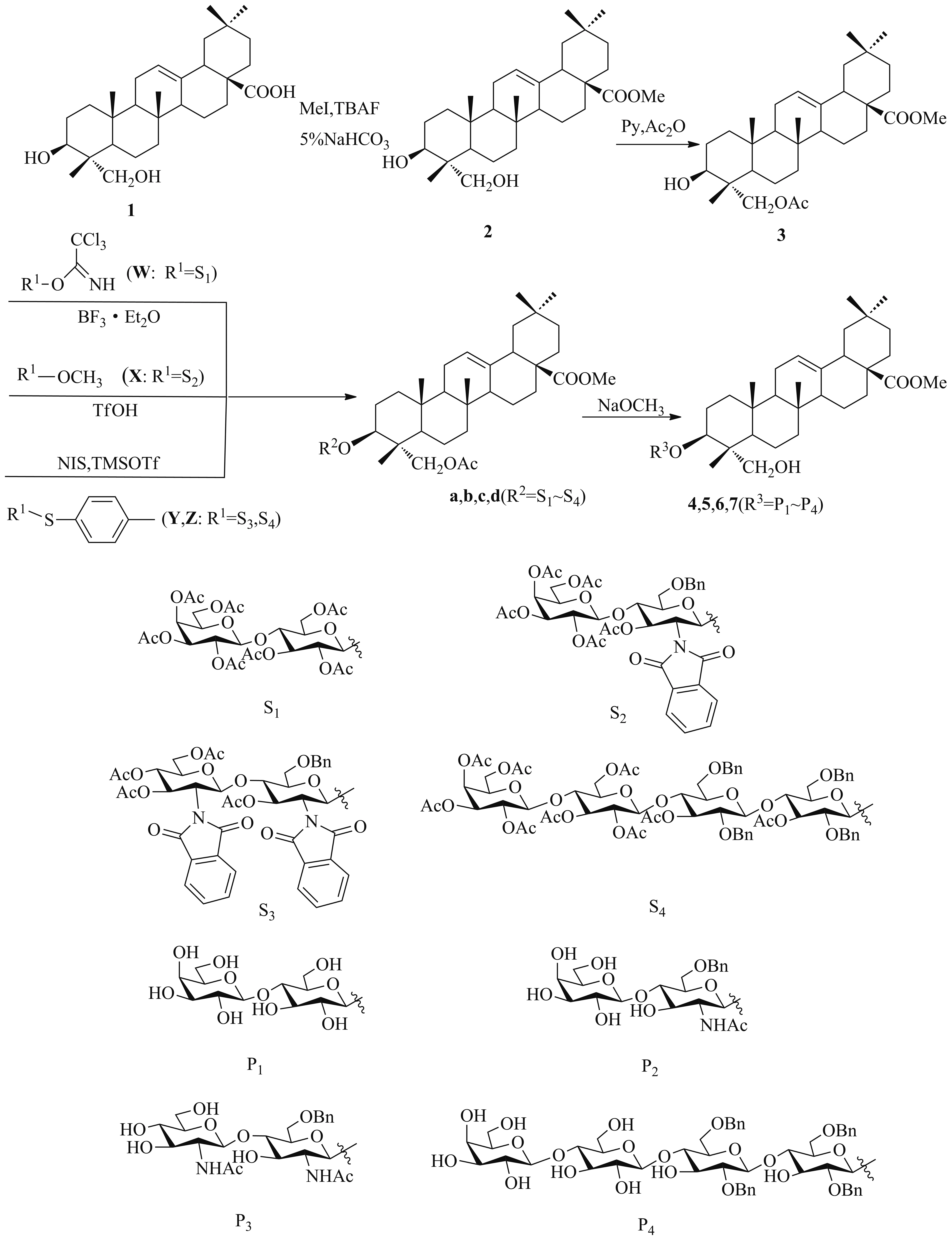
Scheme 1
1 实验部分
1.1 仪器与试剂
Heidolph-4000型旋转蒸发仪;INOVA-400/500 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);FINNIGANLACQ-DECA型质谱仪。
He,贵州中医药大学贾宪生课题组提供;1-甲氧基-(2,3,4,6-四-O-乙酰基-β-D-吡喃半乳糖基)-(1→4)-6-O-苄基-2-去氧-2-邻苯二甲酰亚胺基-β-D-吡喃葡萄糖苷即化合物(X),甲基-苯基-S-(3,4,6-三-O-乙酰基-2-去氧-2-邻苯二甲酰亚胺基-β-D-吡喃葡萄糖基)-(1→4)-6-O-苄基-3-O-乙酰基-2-去氧-2-邻苯二甲酰亚胺基-β-D-吡喃葡萄糖苷(Y),对甲基-苯基-S-(2,6-二-O-苄基-β-D-吡喃半乳糖基)-(1→4)-2,3,6-三-O-苄基-D-吡喃葡萄糖苷(W),实验室自制;其余所用试剂均为分析纯。
1.2 合成
(1) 常春藤皂苷-28-羧甲酯(2)的合成
称取化合物1100 mg(0.21mmol)置于100 mL圆底烧瓶中,于瓶中加入四丁基氟化铵(TBAF)33.4 mg(0.128 mmol),CH3I 0.8 mL(1.28 mmol),5%NaHCO38 mL和DCM 4 mL,氮气保护,搅拌下反应24 h[TLC检测,展开剂:V(环己烷)/V(乙酸乙酯)=1/1,Rf=0.52]。 DCM萃取,有机相真空干燥,过滤,滤液浓缩,残余物经硅胶柱层析[洗脱剂:A=V(环己烷)/V(乙酸乙酯)=2/1]纯化得白色固体粉末297 mg,收率94.8%,m.p.144~145 ℃;1H NMRδ:5.28(m,1H,12-H),3.73(d,J=10.4 Hz,2H,23-H),3.64(m,1H,3-H),3.62(s,3H,OCH3),3.42(dd,J=13.2 Hz,3.6 Hz,1H,18-H),1.97(brs,1H,OH),1.96(brs,1H,OH),1.90(m,2H,11-H),1.87(m,2H,2-H),1,68(m,2H,11-H),1.53(m,2H,16-H),1.42(m,2H,5,9-H),1.39(m,6H,1,6,7-H),1.34(m,4H,19-H,21-H),1.25(m,2H,15-H),1.12(s,3H,27-H),0.97(s,3H,26-H),0.95(s,3H,30-H),0.89(s,3H,24-H),0.85(s,3H,29-H),0.72(s,3H,25-H);MS(ESI)m/z:509.2{[M+Na]+}。
(2)常春藤皂苷元-3-O-乙酰基-28-羧甲酯(3)的合成
在反应瓶中加入化合物2200 mg(0.42 mmol),Py 4 mL(0.04 mol)和Ac2O 2 mL(21.02 mmol),搅拌下反应2 h(TLC检测)。用稀盐酸调至pH中性,DCM萃取,有机相真空干燥,浓缩,残余物经硅胶柱层析(洗脱剂:A=5/1)纯化得白色粉末369.7 mg,收率32.1%,m.p.153~155 ℃;1H NMRδ:5.28(m,1H,12-H),4.13(d,J=11.2 Hz,2H,23-H),3.62(s,3H,OCH3),3.10(m,1H,3-H),2.88(dd,J=14.0 Hz,4.4 Hz,1H,18-H),2.10(s,3H,COCH3),2.08(m,2H,11-H),1.89(m,2H,2-H),1.65(m,2H,22-H),1.61(m,2H,16-H),1.43(m,2H,5-H,9-H),1.36(m,6H,1-H,6-H,7-H),1.33(m,4H,19-H,21-H),1.24(m,2H,15-H),1.16(s,3H,27-H),0.97(s,3H,26-H),0.94(s,3H,30-H),0.88(s,3H,24-H),0.78(s,3H,29-H),0.72(s,3H,25-H);MS(ESI)m/z:552.3{[M+Na]+}
(3) 常春藤皂苷元-3-O-(β-D-吡喃半乳糖基)-(1→4)-β-D-吡喃葡萄糖苷酯(4)的合成
称取D-乳糖5 g(14.6 mmol)加入250 mL反应瓶中,加入搅拌子,真空除水0.5 h。加入Py 50 mL(0.62 mol)和Ac2O 25 mL(0.27 mol),搅拌下反应至终点(TLC监测,展开剂:环己烷/乙酸乙酯=1/1)。旋蒸除去Py,加入饱和NaHCO3溶液,分液,有机相用无水硫酸镁除水,浓缩,残余物经硅胶柱层析(洗脱剂:A=2/1)纯化,真空干燥得化合物9.19 g。
取所得产物5 g(7.37 mol)置于150 mL圆底烧瓶,加入DCM 50 mL溶解化合物,在0 ℃下加入苄胺 2.4 mL(33.68 mmol),反应至终点(TLC检测,展开剂:环己烷/乙酸乙酯=2/1,V/V)。加酸中和反应,分液,有机相浓缩后经硅胶柱层析(洗脱剂:A=3/1)纯化得淡黄色固体4.15 g。
将所得产物淡黄固体5 g(7.86 mmol)、无水K2CO31.95 g(19mmol)和分子筛200 mg加入250 mL圆底烧瓶,抽真空,氮气保护,加入DCM溶解50 mL,0 ℃平衡10 min,加三氯乙腈3.25 mL,反应至终点[TLC检测,展开剂:V(环己烷)/V(乙酸乙酯)=1/1]。分液,有机相浓缩,残余物经硅胶柱层析(洗脱剂:A=3/1)纯化,真空干燥得黄色油状液体W4.65 g,收率76%。
在50 mL圆底烧瓶加入化合物W200 mg(0.26 mmol)、化合物3180 mg(0.36 mmol)和分子筛150 mg,抽真空20 min,氮气保护,加DCM溶解20 mL,于0 ℃平衡10 min,加入BF3·Et2O 15 μL(0.12 mmol),反应至终点[TLC检测,展开剂V(环己烷)/V(乙酸乙酯)=1/1],加入适量DCM,分液,有机相浓缩,残余物经硅胶柱层析(洗脱剂:A=2/1)纯化得白色粉末a196 mg,收率40%。
在50 mL圆底烧瓶中加入a50 mg(0.05 mmol),甲醇溶解5 mL,用新制NaOMe调至pH 11~13,反应30 min(TLC检测)。用阳离子交换树脂调至pH中性。过滤,滤液浓缩,残余物经硅胶柱层析[洗脱剂:V(甲醇)/V(二氯甲烷)=1/8]纯化得白色粉末435mg,收率94.1%,m.p.243~247 ℃;1H NMRδ:5.23(brt,J=3.4 Hz,1H,12-H),5.25(d,J=7.6 Hz,1H,1″-H Lac),5.23(d,J=7.9 Hz,1H,1′-H Lac),3.81(s,1H,2′-H),3.76(s,1H,2″-H),3.70(s,3H,3′-H,5′-H,5″-H),3.69(s,1H,28-H),3.61(d,4H,6′-H,6″-H),3.53(s,1H,3″-H),3.48(s,2H,23-H),3.40(s,1H,4″-H),3.30(s,1H,4′-H),3.00(s,1H,3-H),2.90(dd,J=13.7 Hz,4.3 Hz,1H,18-H),2.10(s,2H,11-H),1.96(s,2H,22-H),1.61(s,2H,16-H),1.60(s,2H,2-H),1.58(s,2H,9-H),1.46(s,2H,6-H),1.28(s,2H,5-H),1.14(s,8H,21-H,19-H,1-H,7-H),0.95(s,3H,27-H),0.93(s,2H,15-H),0.72(s,9H,26-H,25-H,24-H),0.69(s,6H,29-H,30-H);13C NMRδ:180.00(C28),145.06(C13),123.79(C12),105.13(C1′Lac),104.55(C1″Lac),80.99(C3),76.66(C6″Lac),76.43(C6′Lac),74.80(C4″Lac),74.02(C2″Lac),72.74(C3″Lac),72.54(C2′Lac),70.29(C23),62.91(C5′Lac),62.50(C5″Lac),62.43(C3′Lac),62.18(C4′Lac),52.20(OMe),49.51(C9),48.49(C5),48.07(C17),47.07(C19),43.40(C4),42.81(C14),42.71(C18),40.48(C8),39.44(C1),37.94(C10),34.75(C21),33.60(C29),33.52(C22),33.44(C7),31.57(C20),28.78(C15),27.17(C27),26.58(C2),24.49(C11),24.05(C30),23.96(C16),18.93(C6),17.57(C26),16.38(C25),12.92(C24);MS(ESI)m/z:833.3{[M+Na]+}。
(4)常春藤皂苷元-3-O-(β-D-吡喃半乳糖基)-(1→4)-6-O-苄基-2-去氧-2-N-乙酰基-β-D-吡喃葡萄糖苷酯(5)的合成
取X45 mg(0.09 mmol),化合物360 mg(0.07 mmol),N-碘代丁二酰亚胺20 mg(0.16 mmol),活化分子筛30 mg加入25 mL烧瓶中,DCM为溶剂,于0 ℃平衡10 min,加入TfOH 5 μL,反应至终点(TLC检测)。经硅胶柱层析纯化得化合物b,用NaOMe去保护基团后得白色粉末524.0 mg,收率36.9%,m.p.271~274 ℃;1H NMRδ:7.24~7.35(m,5H,Ar-H),5.44(d,J=8.0 Hz,1H,1′-H Glu-N),5.23(brt,J=2.8 Hz,1H,12-H),4.67(m,2H,Bn-CH2),4.59(s,1H,1″-H),4.29(s,1H,2′-H),4.28(s,1H,3′-H),3.87(s,1H,2″-H),3.85(s,1H,5″-H),3.78(s,3H,28-H),3.62(s,2H,6″-H),3.48~3.57(m,6H,3″-H,23-H,4″-H,4′-H,5′-H),2.83(d,J=14 Hz,4.8 Hz,1H,18-H),2.81(s,1H,3-H),2.01(s,3H,NHCOCH3),1.97(s,7H,OH),1.90(s,2H,11-H),1.85(s,2H,22-H),1.71(s,2H,16-H),1.67(s,2H,2-H),1.64(s,1H,9-H),1.59(s,2H,6-H),1.57(s,1H,5-H),1.52(s,8H,1-H,7-H,19-H,21-H),1.33(s,3H,27-H),0.86~0.95(s,9H,24-H,25-H,26-H),0.71~0.73(s,6H,29-H,30-H);13C NMRδ:180.19(C28),173.65(NHCOCH3),145.23(C13),128.75~129.57(5C,Ar),123.95(C12),105.62(C1′Glu-N),104.62(C1″Gal),83.00(C3),77.25(C2″),75.67(C3″),74.43(C2′),72.72(Bn-CH2),70.45(C3′),62.05~62.71(5C,C4′,C5′,C6″,C5″,C4″)52.43(C23),49.63(OMe),49.10(C9),48.78(C5),48.26(C17),47.67(C19),44.00(C4),43.86(C14),43.04(C18),42.92(C8),40.68(C1),39.57(C10),37.74(C21),34.96(C29),33.4(C22),31.9(C7),31.78(C20),30.97(C15),28.95(C27),26.75(C2),24.74(C11),24.23(NHCOCH3),24.18(C30),23.82(C16),20.62(C6),17.84(C26),16.65(C25),13.80(C24);MS(ESI)m/z:964.5{[M+Na]+}。
(5)6和7的合成(以6为例)
取化合物Y136 mg(0.14 mmol)、化合物386 mg(0.18 mmol)、N-碘代丁二酰亚胺30 mg(0.12mmol)以及活化分子筛30 mg于50 mL烧瓶中,DCM溶解,冰水浴平衡20 min,加入TfOH 5 μL,反应至终点(TLC检测)。用饱和硫代硫酸钠调至pH中性,分液,有机相浓缩,残余物经硅胶柱层析纯化得化合物c28 mg,收率32%。
称取化合物c104 mg(0.08 mmol)加入25 mL烧瓶中,加入85% NH2-NH2溶液4 mL和无水乙醇5 mL,于80 ℃反应6 h(TLC检测)。分液,有机相浓缩,残余物用HL-20纯化得产物31 mg;取80 mg该产物再与4 mL甲醇、4 mL乙酸酐反应24 h得白色固体常春藤皂苷元-3-O-(2-去氧-2-N-乙酰基-β-D-吡喃葡萄糖基)-(1→4)-6-O-苄基-2-去氧-2-N-乙酰基-β-D-吡喃葡萄糖苷酯636 mg,收率85%,m.p.290~293 ℃;1H NMRδ:7.22-7.29(m,5H,Ar-H),7.21(s,2H,NH′ Glu-N,NH″ Glu-N′),5.12(brt,J=2.8 Hz,1H,12-H),5.10(d,J=8.0 Hz,2H,1′-H,1″-H),4.68(s,2H,Bn-CH2),4.62~4.66(s,3H,2′-H,2″-H,3′-H),4.59(s,1H,5″-H),4.57(s,1H,5′-H),4.51(s,1H,3″-H),4.47(s,1H,28-H),4.44(s,1H,4″-H),4.41(s,2H,6′-H),3.83(s,2H,6″-H),3.75(d,J=9.5 Hz,2H,23-H),3.60(s,1H,4′-H),3.51(s,1H,3-H),3.36(s,1H,18-H),3.22(s,3H,OCH3″),3.19(s,3H,OCH3′),1.91~2.07(s,5H,OH),1.88(s,2H,11-H),1.78(s,2H,22-H),1.62(s,2H,2-H),1.56(s,2H,16-H),1.54(s,2H,6-H),1.42~1.51(s,9H,7-H,5-H,19-H,21-H,1-H),1.39(s,3H,27-H),1.32(s,2H,15-H),1.24~1.28(s,6H,24-H,25-H),0.93(s,3H,30-H),0.70(s,3H,29-H);13C-NMRδ:180.66(C28),172.74(2C,NHCOCH3),145.74(C13),140.26(C1Ar),129.4~130.18(5C,C2-6Ar),124.26(C12),103.77(C1′Glu-N),100.76(C1″Glu-N′),80.91(Bn-CH2),79.35(C3),78.28(C2″),77.30(C3″),76.52(C2′),75.76(C4′),74.38(C4″),73.73(C3′),73.10(C6′),72.42(C6″),72.13(C23),70.48(2C,C5″,C5′),63.59(C9),62.61(OMe),58.02(C17),52.82(C14),50.1(C5),48.72(C19),48.66(C4),48.54(C21),43.31(C18),41.10(C8),34.19(C10),32.52(C22),32.18(C1),31.62(C7),29.04(C15),28.73(C27),27.01(C2),25.1(C11),24.57(C20),23.80(C2),21.27(2C,NHCOCH3),18.19(C22),17.11(C16),17.05(C30),15.21(C6),13.42~13.54(4C,C29,C24,C25,C26);MS(ESI)m/z:1005.5{[M+Na]+}。
用类似的方法合成白色粉末常春藤皂苷元-3-O-[β-D-吡喃半乳糖基-(1→4)-β-D-吡喃葡萄糖基-(1→4)-2,6-二-O-苄基-β-D-吡喃半乳糖基]-(1→4)-2,3,6-三-O-苄基-β-D-吡喃葡萄糖苷酯(7) 42 mg,收率92%,m.p.310~312 ℃;1H NMRδ:7.20~7.41(m,20H,Ar-H),5.26(brt,J=2.8 Hz,1H,12-H),5.08(d,J=8.0 Hz,2H,1′-H,1″-H),5.04(d,J=7.8 Hz,2H,1″″-H,1″′-H),4.85(s,8H,Bn-CH2),4.73(s,1H,2″-H),4.71(s,1H,2′-H),4.66(s,1H,2″′-H),4.65(s,1H,3″-H),4.64(s,1H,3′-H),4.53(s,1H,2″″-H),4.50(s,1H,5″′-H),4.48(s,1H,5″″-H),4.45(s,3H,OCH3),4.39(s,1H,3″′-H),4.32(s,2H,6″′-H),4.31(s,2H,6″″-H),4.29(s,2H,6″-H,6′-H),4.04(s,1H,23-H),3.89(s,1H,3″″-H),3.85(s,1H,4″″-H),3.79(s,1H,5′-H),3.73(s,1H,5″-H),3.61(s,1H,4″′-H),3.60(s,1H,4″-H),3.58(s,1H,4′-H),3.49(s,1H,3-H),3.31(d,J=14Hz,4.8 Hz,1H,18-H),1.89~1.94(s,9H,OH),1.70(s,2H,11-H),1.64(s,2H,22-H),1.62(s,2H,16-H),1.52(s,2H,2-H),1.49(s,2H,6-H),1.45(s,1H,9-H),1.32(s,1H,5-H),1.29(s,2H,19-H),1.27(s,2H,21-H),1.25(s,2H,1-H),1.24(s,2H,7-H),1.18(s,3H,27-H),1.17(s,2H,15-H),0.98(s,3H,26-H),0.97((s,3H,25-H),0.96(s,3H,24-H),0.73(s,3H,30-H),0.70(s,3H,29-H);13C NMRδ:179.85(C28),144.97(C13),128.65~129.65(24C,Ar),105.78(C12),105.10(C1′),104.95(C1″),104.14(C1″′),95.60(C1″″),80.12(C3),77.00(C5′),76.30(C5″),76.16(C5″′),74.68(C5″″),74.40~74.50(4C,C2″″,C2″′,C2″,C2′),74.00~74.10(4C,Bn-CH2),72.10~72.45(4C,C3″″,C3″′,C3″,C3′),70.20~70.59(4C,C4″″,C4″′,C4″,C4′),62.40 ~62.45(2C,C6″′,C6″″),61.53(C23),52.20(OMe),49.58(C9),49.16(C5),48.95(C17),48.31(C19),47.98(C4),47.75(C14),43.81(C18),43.70(C8),42.80(C1),42.65(C10),40.44(C21),40.41(C29),37.71(C22),37.47(C7),34.70(C20),33.54(C15),31.52(C27),26.57(C2),23.97(C11),23.40(C30),17.63(C16),17.59(C6),16.36(C26),13.92(C25),13.87(C24);MS(ESI)m/z:1607.7{[M+Na]+}。
1.3 抗肿瘤活性测试
以人结肠癌细胞COLO205为实验细胞,He为阳性对照,用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐比色法评价化合物的肿瘤细胞抑制率。取对数生长期的人结肠癌细胞COLO205,以细胞浓度3000个/孔接种于96孔板中,设定阳性药组(He)、空白对照组、实验组。24 h后分别更换为含药培养基(浓度为1.00×10-4、1.00×10-5、1.00×10-6mmol·L-1)。给药后24 h,在各孔中加入MTT 溶液(5 mg·mL-1)20 μL,置于37 ℃,5% CO2环境中培育4 h。孵育完毕的96孔板放入酶标仪中,在波长490 nm处测定各孔OD值。肿瘤活性实验委托贵州省中国科学院天然药物化学重点实验室药理与活性筛选中心完成。
2 结果与讨论
2.1 He衍生物合成
共合成4个常春藤皂苷元衍生物(4~7),其中6和7为新化合物。在两个二糖片段连接形成四糖的β-1,4位连接中,因为受体分子带有空间位阻大的苄基,糖化反应因而发生在位阻较小的4-位。当受体分子一号位连接有对甲基苯硫酚的大基团时,对4-位的区域选择性会更好。而供体分子异头碳中离去基团选择三氯乙酰亚胺酯,能够提高两片段成功连接的收率。供体采用三氯乙酰亚胺酯作离去基团,收率提高约15%[13]。
合成He与糖片段时,在25 ℃、30 ℃、0 ℃、-40 ℃条件下进行反应。25 ℃和30 ℃时反应失败,无法获得产物。而在-40 ℃中反应进行过慢,乙酰亚胺酯基团的活性碳正离子的易于变性破坏。同时低温时乙酰亚胺酯形成碳正离子速度减慢,与He的羟基结合机会会明显增加。因此选择在冰水浴条件下进行反应,只需0.5~1 h就可得到所需产物[14-15]。
2.2 抗肿瘤活性
表1为不同浓度化合物对人结肠癌细胞COLO205的抑制活性。由表1可知,4和5浓度为1.00×10-4mmol·L-1、1.00×10-5mmol·L-1和1.00×10-6mmol·L-1时,对COLO205细胞均存在抑制作用,与浓度呈正相关;6在高浓度(1.00×10-4mmol·L-1)对COLO205有较好的抑制活性;7只在中等浓度(1.00×10-5mmol·L-1)对COLO205有微弱抑制作用。

表1 目标化合物对COLO205细胞的抑制活性Table 1 Inhibitory activities of the target compounds against COLO205
皂苷类化合物的苷元相同,但糖片段的不同就能造成其生物活性的巨大差异[16]。本课题组前期工作将He与单糖片段合成的衍生物进行抗肿瘤活性试验,证明常春藤皂苷元糖苷化衍生物的确具有一定肿瘤抑制活性,如王欢[17]合成的常春藤皂苷元-3-O-β-D-吡喃半乳糖苷酯对人膀胱癌细胞T-24在1.00×10-4mmol·L-1浓度时抑制率可达到92.36±10.65%,显示出优于He的抑制作用;以及常春藤皂苷元-3-O-β-D-吡喃葡萄糖苷酯对人胃癌细胞BGC-823在高浓度1.00×10-4mmol·L-1时抑制率可达98.03±2.16%[18]。除抗癌作用以外,常春藤皂苷元糖苷化衍生物还表现出抑制小鼠TG升高的作用[19]。糖苷化可以提高水溶性,有研究表明在He的C-28位的-COOH进行酰化、甲基化等修饰后,可以提高He脂溶性[20],这也对提高He的生物利用度提供了另一条思路,有待进一步进行研究。
合成了4个常春藤皂苷元衍生物(4~7,其中6和7为新化合物),并用MTT法检测了化合物对人结肠癌细胞COLO205的抑制活性。结果表明:4和5对COLO205细胞有部分抑制作用,与浓度正相关;6对COLO205只在高浓度(1.00×10-4mmol/L)有较好抑制作用(98.36±0.43%);7只在中等浓度(1.00×10-5mmol/L)对COLO205有微弱抑制作用(2.75±1.22%)。本研究针对水溶性结构的修饰,对未来抗肿瘤药物的开发有一定借鉴作用。

