尿毒症患者睡眠呼吸暂停低通气综合征的发病情况研究
郑洪飞 李娜 庞桂芬
睡眠呼吸暂停低通气综合征(sleep apnea-hypopnea syndrome,SAHS)是一种全身疾病,主要表现为睡眠时打鼾伴有呼吸暂停和(或)呼吸浅表、夜间反复发生低氧血症、高碳酸血症和睡眠结构紊乱,进而导致白天嗜睡及多脏器损害,具有较高的潜在致死性,严重影响患者的生活质量及生存期。慢性肾脏病患者常伴有睡眠呼吸暂停和夜间低氧血症,合并SAHS不仅会加速患者肾功能损害,而且还会增加其并发症的发生,进而影响患者的长期生存[1]。随着慢性肾病的进展,患者肾功能逐渐丧失,肾脏清除代谢废物及毒素、调节酸碱平衡以及维持内环境稳定的功能越来越差,SAHS的发生率也随之升高。国外研究发现,尿毒症患者的SAHS患病率高于健康成年人群[1,2]。SAHS的存在致使尿毒症患者的生活质量下降[3],同时增加了其并发症及死亡率,故尿毒症合并SAHS越来越引起学者的重视。本研究拟调查我院尿毒症患者的SAHS发病情况,探讨日间常规血液透析(conventional hemodilysis,CHD)治疗对SAHS病情的影响。
1 资料与方法
1.1 一般资料 选取我院2013年7月至2014年5月确诊的尿毒症患者65例为研究对象,平均年龄(53.0±14.92)岁;平均体重指数(BMI)(25.87±4.1)kg/m2;平均肾脏病病史(78.88±93.58)月;其中紫癜性肾病1例,多囊肾1例,肾病综合征1例,狼疮肾1例,慢性间质性肾病1例,双肾萎缩2例,马兜铃酸肾病3例,糖尿病肾病10例,高血压肾病17例,慢性肾炎28例,单纯药物治疗者28例,应用CHD 3次/周的日间血液透析方式治疗者32例,肾移植者5例。所有调查对象符合国际肾脏病学会在美国肾脏病基金会制定的CKD临床实践指南(K/DOQI)基础上提出的CKD的诊断标准[4]。
1.2 研究方法 (1)现场问卷调查:对所有调查对象进行床旁睡眠问卷调查,调查者由经过正规培训(统一培训)的医生统一负责,调查内容包括个人基本情况、CVD情况(包括高血压、心功能不全、心律失常、肺动脉高压、动脉粥样硬化(脑梗死、脑出血、冠心病、动脉血栓形成)、肾脏病类型及透析相关资料。(2)多导睡眠监测(polysomnography,PSG):对所有调查对象进行整夜PSG监测,17例CKD合并SAHS并进行CHD治疗者分别在透析日前夜及透析日当晚进行PSG监测[17例患者平均透析龄为(22.8±23.57)月]。(3)SAHS诊断标准参照中华医学会呼吸病学分会睡眠学组“阻塞性睡眠呼吸暂停低通气综合征诊治指南”[5]。

2 结果
2.1 尿毒症患者的PSG情况 尿毒症患者SAHS的患病率为89.23%(58/65);其中CSAHS占51.72%,OSAHS占44.83%,混合型占3.45%。见表1。
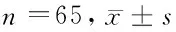
表1 尿毒症患者PSG参数
2.2 CHD治疗前后患者的SAHS病情变化情况 透析前后患者的 AHI、阻塞性呼吸暂停指数、阻塞性呼吸暂停最长时间、中枢性呼吸暂停指数、中枢性呼吸暂停最长时间、LSaO2及SaO2低于90%总时间差异无统计学意义(P>0.05);但透析后最长氧降时间低于透析前,差异有统计学意义(P<0.05)。见表2。
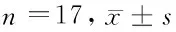
表2 透析前后夜睡眠参数比较
2.3 尿毒症患者患CVD的情况 高血压者63例,冠心病者16例,心律失常者12例,脑血管疾病者7例,慢阻肺1例,糖尿病者16例。Logistic回归分析显示合并SAHS是尿毒症患者并发心血管疾病(cardiovascular disease,CVD)的预测危险因子(OR=9.41,95%CI:2.16~41.03,P<0.01)。见表3。
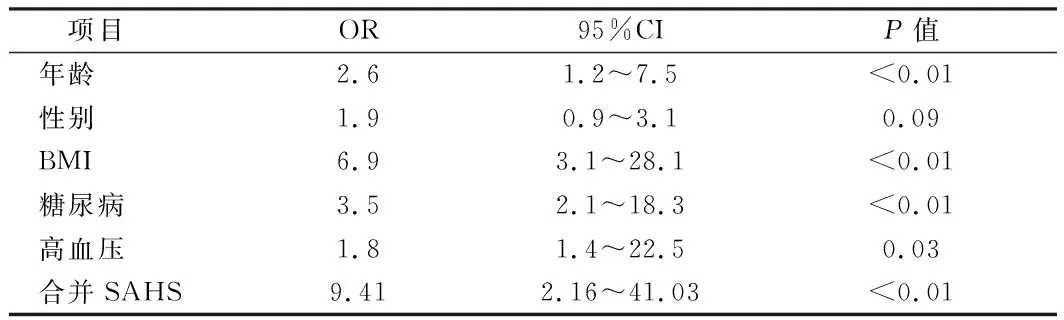
表3 尿毒症患者并发CVD Logistic 回归分析
3 讨论
本研究显示,SAHS在尿毒症患者中患病率高达89.23%,远高于健康成年人群,这一结论与既往文献报道[1]一致。关于尿毒症患者中SAHS发病率较高的机制目前尚无定论,一般认为与尿毒症毒素蓄积、中分子物质、炎性因子滞留以及体液潴留等因素有关。另有文献报道,尿毒症神经病变造成的咽部肌肉功能失调、尿毒症肌病所致的咽部肌肉缺乏张力、容量负荷过多引起的咽喉部水肿致使咽腔狭窄,均可造成呼吸暂停[6-8]。
Fleischmann等[9]部分研究者发现,尿毒症合并SAHS以CSAHS为主,本研究的结论与此一致。发生CSAHS的机制并不明确,部分学者认为与睡眠过程中PCO2下降导致呼吸控制系统不稳定以及PCO2反复低于某一阈值有关,该阈值每个人不同,亦称为“呼吸暂停阈值”[10],而CKD患者出现血PCO2下降与其频繁出现传入神经兴奋性增强[11]有关,传入神经兴奋冲动增多可引起调控呼吸的感受器敏感性增强,出现过度通气,进一步出现慢性低碳酸血症。本研究对接受CHD患者进行了前后PSG结果对照研究,结果透析前后AHI、LSaO2及SaO2<90%总时间的差异均无统计学意义(P>0.05),但最长氧降时间在透析后缩短了(P<0.05),反映了睡眠过程中患者对睡眠呼吸事件导致的血氧下降的敏感性增强。以上结果说明,CHD清除了患者体内多余体液及毒素后可轻度改善尿毒症患者的低氧情况,但并不能充分改善其呼吸暂停情况。近期,Kennedy等[12,13]研究发现接受夜间维持性血液透析的患者在彻底地清除体内毒素、中分子物质及一些炎性因子纠正神经肌肉功能障碍后,睡眠呼吸暂停症状可得以改善。Jaime等[14]发现夜间维持性血液透析后,患者的咽部横截面积较透析前或CHD治疗后增大,提出夜间连续性血液透析较常规透析更能改善患者SAHS病情。这些研究结果为尿毒症合并SAHS的患者治疗提供了新的研究方向。
目前,尿毒症患者死亡率逐年上升,而CVD是尿毒症患者死亡的首位原因, Zoccali等[15]提出尿毒症患者因SAHS引起的夜间低氧致使其心血管疾病危险性增加,例如难治性高血压、左心室肥大等;亦有研究表明,尿毒症患者合并SAHS与患高血压、冠心病之间存在相关性[16]。本研究采用Logistic回归分析结果显示SAHS是尿毒症者患CVD的预测危险因子(OR=9.41,95%CI:2.16~41.03),与以上结果保持一致,从而进一步证实了合并SAHS可能增加尿毒症患者的死亡率。持续正压通气(continuous positive airway pressure,CPAP)治疗是SAHS最主要的治疗手段,研究发现,长期应用CPAP治疗可改善尿毒症患者夜间低氧,纠正高碳酸血症,减少血浆肾素血管紧张素Ⅱ、脑钠肽的释放,降低血压,改善肾小球超滤状态,减少尿蛋白及夜尿量,逆转肾功能损害,同时可以改善患者日间嗜睡、夜间呼吸驱动系统不稳定等情况[17]。但本组患者中仅有2例患者坚持应用CPAP治疗,效果有待进一步观察。
综上所述,SAHS作为一个危险因子普遍存在于尿毒症患者中,单纯CHD不能充分改善SAHS的病情,应倡导对该类患者实施夜间维持性血液透析与CPAP同步治疗从而改善其病情。

