原发性胆汁性肝硬化合并自身免疫性疾病患者免疫球蛋白、T 淋巴细胞亚群及补体水平变化研究
陈绿梅
(金溪县人民医院,江西 抚州344800)
临床肝脏疾病中, 原发性胆汁性肝硬化(Primary biliary cirrhosis,PBC)较为常见,是一种慢性胆汁淤积性肝脏病,好发于中年女性群体中,具有起病隐匿、进展缓慢的特点,临床表现以肝内小胆管非化脓性炎症和梗阻为主,但大约10%的患者可无症状[1]。 PBC 常与其他免疫性疾病并存,主要有类风湿性关节类、干燥综合征、慢性淋巴细胞性甲状腺炎等,因临床症状不典型,多数患者就诊时病情往往较为严重[2]。PBC 合并免疫性疾病出现时,机体的免疫学指标及补体水平会发生相应的变化,但其变化的特点和规律并不明确,既往有学者研究发现,PBC 合并自身免疫性疾病患者,其CD4+、CD8+和CD4+/CD8+等T 细胞亚群水平会随着病情的变化不断变化,最终导致免疫功能下降,若不及时干预健康状况会不断恶化[3]。从现阶段学界对PBC 合并自身免疫性疾病的研究来看,对于免疫学指标及补体变化的研究并不少见,但是对于免疫学指标及补体同谷丙转氨酶(Alanine aminotransferase,ALT)、白蛋白(Albumin,ALB)、总胆红素(Total bilirubin,TBIL)、凝血酶原活动度(Prothrombin time activity,PTA)等相关肝功能指标的关系则并不多见[4]。随着PBC 发病率的不断上升,合并自身免疫性疾病的现象也越来越常见,加强对疾病防治至关重要。因此,有必要针对PBC 合并自身免疫性疾病患者的免疫学指标及补体水平的变化进行定期检测和分析,为临床防治提供一定的参考。 本研究纳入我院收治的90 例PBC 患者,分析了合并自身免疫性疾病患者免疫学指标及补体水平的变化,及其与肝脏功能的相关性。 报告如下。
1 资料与方法
1.1 一般资料 以2016 年1 月-2019 年6 月为病例收集时间段, 纳入期间在我院接受治疗的PBC患者90 例进行研究。 所有患者中,男性患者9 例,占比10.00%;女性患者81 例,占比90.00%。 年龄22~69 岁,平均年龄51.12±6.57 岁。纳入标准:⑴符合中华医学会肝病学分会2015 年制定的《原发性胆汁性肝硬化诊断和治疗共识》[5]关于PBC 的诊断标准;⑵经腹部B 超、CT 等手段检查确诊;⑶年龄18~70 岁,成年患者;⑷精神和认知正常,可完成正常的交流与沟通;⑸签署知情同意书,患者能够积极配合各项检测;⑹经医院伦理委员会批准。 排除标准:⑴合并病毒性肝炎、酒精性肝病、自身免疫性肝炎等其它类型肝脏疾病; ⑵年龄<18 岁和>70岁患者;⑶合并严重心、肾、肺等器官功能障碍或疾病;⑷合并血液系统疾病者;⑸妊娠期或哺乳期患者;⑹临床资料不完整者。
根据是否合并自身免疫性疾病,分为合并组和单纯组,其中单纯组患者47 例(52.22%),合并组患者43 例(47.78%)。 合并组:男4 例,女39 例;年龄22~69 岁,平均年龄51.24±6.61 岁;合并免疫性疾病方面, 类风湿性关节类10 例, 干燥综合征7例,甲状腺炎21 例,系统性红斑狼疮5 例。单纯组:男4 例,女43 例;年龄22~69 岁,平均年龄51.08±6.52 岁。 另纳入同期收治的45 例体检健康者视为参照组,其中男7 例,女38 例;年龄21~67 岁,平均年龄50.89±6.42 岁。 各组性别分布、平均年龄等临床资料相比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 标本采集 于清晨空腹状态下, 由经验丰富的医师采集患者和受检者肘静脉血5ml,并通过低分子肝素(广西两面针亿康药业股份有限公司,国药准字H45020137)进行抗凝处理。 采用广州吉迪仪器有限公司生产制造的JIDI-6D 台式低速大容量离心机对血液标本3000r/min 离心10min, 静置15min 后,分离血清标本,用采血管保存于-30℃的冰箱中待检。
1.2.2 T 细胞亚群检测 检测的指标包括CD4+细胞和CD8+细胞, 检测时使用到的仪器设备为FC500 MCL 型流式细胞仪,生产厂家为美国贝克曼库尔特公司,配套试剂也由其提供。 计算CD4+和CD8+的比值,获取CD4+/CD8+。 检测时严格按照试剂盒说明检测,保证检测质量符合要求。
1.2.3 免疫球蛋白及补体水平检测 免疫球蛋白指标包括IgA、IgG 和IgM,补体水平包括C3 和C4。检测使用到的仪器设备为美国贝克曼库尔特公司生产的IM-MAGE800 型特定蛋白仪, 采用免疫比浊法进行检测,试剂一并由其提供。 检测时严格按照试剂盒说明检测,做好质控工作。
1.2.4 肝功能指标检测 肝功能指标包括谷丙转氨酶(ALT)、白蛋白(ALB)、总胆红素(TBIL)、凝血酶原活动度(PTA)。 采用美国贝克曼库尔特公司的Uni Cel DxC800 型生化分析仪及北京利德曼公司检测试剂,对ALT、ALB 和TBIL 进行检测。 PTA 的检测和计算: 采用含枸橼酸钠抗凝剂的采血管另外采集3ml 空腹静脉血,离心处理后取上层血清,采用美国ACL 公司TOP700 型全自动凝血分析仪及日本希森美康公司凝固法检测试剂进行凝血酶原时间(PT),并对PTA 数值进行计算。
1.3 观察指标 检测获取各组免疫学指标(IgA、IgG、IgM 和CD4+、CD8+、CD4+/CD8+),补体(C3、C4)水平,进行组间比较,分析不同情况患者或受检者免疫学指标及补体水平的情况。 分析各组免疫学指标(IgA、IgG、IgM 和CD4+、CD8+、CD4+/CD8+),补体(C3、C4)水平同ALT、ALB、TBIL、PTA 等肝功能指标的相关性。
1.4 统计学处理 数据分析使用SPSS21.0 统计软件包,IgA、IgG、IgM 和CD4+、CD8+、CD4+/CD8+,C3、C4,以及年龄等计量资料采用x±s 表示,组间比较采用t 检验,性别分布占比等计数资料采用百分比表示,组间比较采用χ2检验。相关性分析采用直线相关分析法分析,P<0.05 为差异有统计学意义。
2 结果
2.1 各组免疫球蛋白水平的比较 合并组IgA、IgG和IgM 水平高于单纯组和参照组,差异有统计学意义(P<0.05);单纯组IgA、IgG 和IgM 水平高于参照组,差异有统计学意义(P<0.05)。 见表1。

表1 各组免疫球蛋白水平的比较(x±s)
2.2 各组T 细胞亚群水平的对比 参照组CD4+和CD4+/CD8+低于合并组与单纯组,CD8+高于合并组与单纯组,差异有统计学意义(P<0.05);合并组CD4+高于单纯组。 CD8+和CD4+/CD8+低于单纯组,但差异均无统计学意义(P>0.05)。 见表2。
2.3 各组补体水平情况比较分析 参照组C3、C4补体水平高于合并组和单纯组,差异有统计学意义(P<0.05);单纯组C3、C4 补体水平高于合并组,差异有统计学意义(P<0.05)。 见表3。
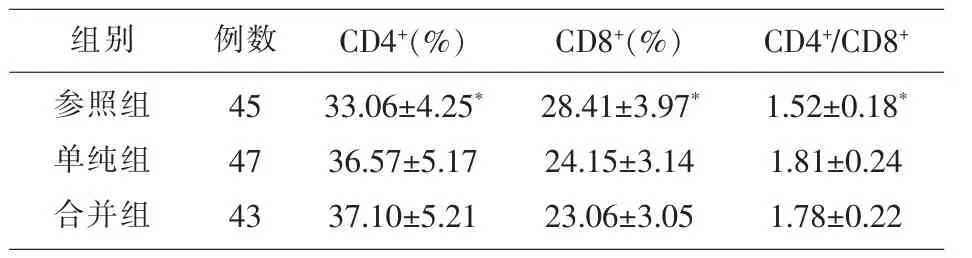
表2 各组T 细胞亚群水平的对比(x±s)

表3 各组补体水平情况比较分析(x±s)
2.4 合并组免疫学指标及补体水平与肝功能的相关性 IgA、IgG、IgM,CD4+、CD8+、CD4+/CD8+等免疫学指标和C3、C4 补体水平, 同ALT、ALB、TBIL 和PTA 等肝功能指标相关性分析,见表4。
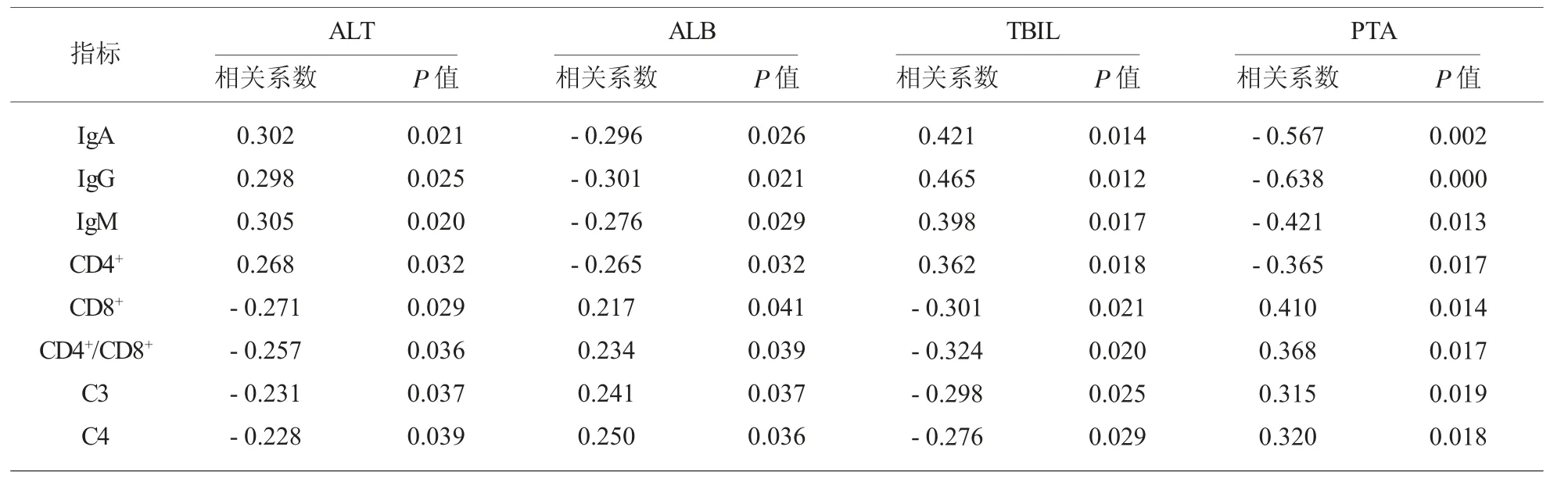
表4 合并组免疫学指标及补体水平与肝功能的相关性
3 讨论
PBC 是临床较为常见的肝脏疾病,女性发病率高于男性,男女比例约为1:9,其中年龄段在40~60岁的女性群体占据了其中的70%以上[6]。 PBC 早期发病后,患者并无特异性症状,部分患者经检测后肝功能会出现异常,表现出右上腹不适、乏力等症状。 目前,部分PBC 的发病原因并不完全明确,但绝大部的研究认为是由胆道阻塞,胆汁淤积而引起[7]。 一般认为,PBC 是一种自身免疫性疾病,临床上病情缓解与恶化交替出现,常伴有甲状腺炎、干燥综合征、系统性红斑狼疮、类风湿性关节炎等自身免疫性疾病,体液免疫显著异常,抗线粒抗体阳性率达90%~100%,80%患者其滴度大于1:80[8]。本研究纳入的PBC 患者中, 合并自身免疫性疾病患者43 例,其中甲状腺炎为最高21 例,类风湿性关节类、干燥综合征、系统性红斑狼疮位居其后,分别有10 例、7 例和5 例。
PBC 尽管自身也被认为是一种免疫性疾病,与其它自身免疫性疾病有着类似的免疫学病变机制,但是同样会受到遗传因素和环境因素的联合作用而触发。 机体免疫系统的构成中,免疫球蛋白是不可缺少的一项内容,常见的IgA、IgG 和IgM 等因子,构成了机体的免疫系统,是其重要的构成部分[9]。 受到遗传易感性和环境触发的因素作用,机体细胞免疫及体液免疫机制会发生紊乱,免疫功能因此出现异常,B 淋巴细胞活性化并产生大量的抗体,导致体液免疫亢进,抗原抗体复合物的形又会继发补体系统,进而造成C3、C4 水平的下降[10]。 因此,对于PBC 患者而言,机体普遍存在免疫球蛋白因子水平升高(或正常范围但偏高),补体水平下降到现象,而这一现象在合并自身免疫性疾病后,表现得尤为明显, 这也直接解释了PBC 合并自身免疫性疾病患者免疫功能的紊乱, 由此引发的影响[11]。 本研究结果发现,合并组、单纯组和参照组之间,IgA、IgG 和IgM 水平依次呈现出不断下降的趋势,即合并组最高,单纯组其次,参照组最低,相互比较差异有统计学意义(P<0.05);在C3、C4 补体水平方面,合并组<单纯组<参照组,相互比较后差异有统计学意义(P<0.05),这一结果符合临床对P BC 合并自身免疫性疾病患者免疫球蛋白和补体水平变化的研究。
国外关于PBC 的发病机制研究比较多, 有研究发现免疫反应异常和调节失衡是重要的发病机制之一[12]。T 细胞亚群水平的变化,与免疫反应密切相关,其调节的失衡是造成胆管和肝细胞破坏的重要因素之一[13]。T 细胞亚群因子中,CD4+细胞和CD 8+细胞是两个比较活跃的细胞因子,扮演着非常重要的角色。 有研究认为,在PBC 患者中,CD4+细胞的异常表达(活化和增殖),可能与患者免疫功能异常有直接的联系,是造成免疫功能下降的主要原因[14]。 CD8+细胞介导的免疫反应,会参与PBC 患者胆管上皮细胞和肝细胞的破坏, 增殖后的CD8+细胞选择性集中在肝组织病灶,而患者机体独特的炎性反应, 会促进NK 细胞从外周血中向病灶转移,随后逐渐发生调往,水平因此而下降[15]。 本研究结果显示,参照组CD4+和CD4+/CD8+低于合并组与单纯组,CD8+高于合并组与单纯组(P<0.05),而合并组和单纯组CD4+、CD8+和CD4+/CD8+差异无统计学意义(P>0.05),表明了PBC 患者与正常人群的T 细胞亚群水平存在差异, 但是单纯性PBC 患者与合并自身免疫性疾病PBC 患者之间,T 细胞调节失衡和免疫反应异常并无太大的区别。
PBC 作为一种肝脏疾病,对其的评价指标中,肝功能指标是极为重要的指标内容之一。 ALT、ALB、TBIL 和PTA 等肝功能指标均比较常见,ALT和ALB 是急性肝细胞损害的敏感标志,TBIL 反映了胆管缺失的严重程度,PTA 能够判断干细胞坏死严重程度及预后[16]。 本研究针对PBC 合并自身免疫性疾病患者的免疫学指标及补体水平,与ALT、ALB、TBIL 和PTA 等肝功能指表的相关性进行了分析,结果显示IgA、IgG、IgM 和CD4+与ALT、TBIL 呈正相关 (P<0.05),CD8+、C3 和C4 与ALT、TBIL 呈负相关 (P<0.05);CD8+、C3 和C4 与ALB、PTA 呈正相关 (P<0.05),IgA、IgG、IgM 和CD4+与ALB、PTA 呈负相关(P<0.05)。 由此不难看出,加强对各项常见肝脏功能指标的检测和评价,对疾病严重程度的判断和预后意义重大。
综上所述,PBC 合并自身免疫性疾病患者免疫学指标及补体水平的变化发展,与疾病的严重程度和预后密切相关, 加强对免疫学指标和补体水平,以及肝功能指标的检测,对病情评估和预后判断具有重要的临床意义。

