常压室温等离子诱变与微生物微滴培养选育几丁质脱乙酰基酶高产菌株
马钦元,申雁冰,丁盼盼,屠琳娜,毕心宇,王 敏*
(1.天津科技大学 生物工程学院 工业发酵微生物教育部重点实验室,天津300457;2.洛阳华清天木生物科技有限公司,河南 洛阳471023)
几丁质是自然界中仅次于纤维素的第二大生物聚合物,主要存在于无脊椎动物,如虾、蟹、昆虫、海藻以及真菌及酵母细胞壁中[1-2]。尽管几丁质含量丰富,但由于其不溶解特性导致商业应用价值较低。壳聚糖是几丁质脱掉乙酰基的产物,因其可溶于稀酸,商业应用价值较几丁质有大幅度提升,被广泛应用于生物医药、食品生产、农业、水处理等领域[3-4]。目前壳聚糖主要采用传统化学法生产,存在环境污染严重、工艺难控制、产品质量特别是脱乙酰度不稳定等问题[5-7]。采用几丁质脱乙酰基酶(chitin deacetylase,CDA)酶法脱乙酰制备壳聚糖,因其反应过程易于控制、产品脱乙酰度稳定、环境污染小等优点,成为壳聚糖生产的替代选择,并越来越受到人们的重视。然而,由于CDA产率低、底物不溶解等问题[8],目前该工艺还无法实现产业化应用[9],所以高产CDA的菌株筛选仍然是解决CDA应用的主要途径之一。
常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变技术是一种高效的微生物育种技术[10-11]。微生物微滴培养(microbial microdroplet-culture,MMC)技术是基于液滴微流控技术最新研发而成的一款微生物培养系统,是一种基于微流控技术的微型化、自动化、智能化的高通量微生物培养,具有高通量、自动传代、化学因子梯度添加、在线检测液滴光谱、微生物分选等功能[12]。ARTP目前已经高效应用于多种细菌、真菌以及植物种子等的诱变选育[13-19],但鲜有将ARTP应用于CDA发酵菌株的诱变选育,同时MMC也是首次被应用于CDA高产菌株的高通量筛选。
为了获得高效获得CDA的高产菌株,该研究以可分泌作用大分子底物CDA的马红球菌(Rhodococcus equiCGMCC14861)为出发菌株[20],首先进行室温等离子(ARTP)诱变,并通过微滴培养(MMC)技术进行了诱变高产菌株的高通量液滴筛选,随后将筛选到的液滴进行了进一步的稀释平板筛选和24深孔板复筛,并通过对比分析单位菌体产CDA的能力确定最佳诱变高产菌株。该研究提供了一种新的CDA高通量筛选方法,为CDA高产菌株的诱变选育以及其他可通过显色反应进行菌株筛选的工作提供了借鉴。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
马红球菌(Rhodococcus equi):天津科技大学生物工程学院分离、鉴定,保藏于中国普通微生物菌种保藏管理中心(China general microbiological culture collection center,CGMCC)(保藏号:CGMCC14861)。
1.1.2 试剂
蛋白胨、酵母膏(均为生化试剂):北京奥博星生物技术有限责任公司;氯化钠(分析纯):天津时北方天医化学试剂厂;4-硝基乙酰苯胺(分析纯):上海广锐生物科技有限公司;琼脂粉(生化试剂):北京化学试剂公司。
1.1.3 培养基
LB液体培养基:蛋白胨10 g/L,酵母浸粉5 g/L,氯化钠10 g/L,pH6.0~7.0。
LB固体培养基:在LB液体培养基中加入琼脂粉20 g/L。
筛选培养基:在LB培养基中加入50 mg/L的4-硝基乙酰苯胺。
上述培养基均121 ℃高压蒸汽灭菌30 min。
1.2 仪器与设备
ⅡS型ARTP诱变育种仪:江苏无锡源清天木生物科技有限公司;MMC-1全自动高通量微生物微滴培养仪:洛阳华清天木生物科技有限公司;ELX808全自动酶标仪:美国Biotek公司;ZHWY-211F 往复式大容量恒温摇床:上海智诚分析仪器制造有限公司;UVmini-1240紫外可见分光光度计:日本岛津公司;ZXSD-B1160电热恒温培养箱:上海智城分析仪器制造有限公司;GI54D立式压力蒸汽灭菌锅:美国Zealway公司。
1.3 方法
1.3.1 菌株种子液及发酵液的制备
种子及发酵培养液的制备:将分离纯化得到的马红球菌(Rhodococcus equi)CGMCC14861转接至装液量为50 mL/250 mL的LB液体培养基中,于37 ℃、200 r/min条件下培养24 h,得到种子液。按照接种量为10%将种子液接种于装液量为50 mL/250 mL的LB液体培养基中,于37 ℃、200 r/min条件下发酵培养48 h,得到发酵液。
1.3.2 CDA原始菌株的ARTP诱变[18-19]
取1 mL培养24 h的马红球菌(R.equi)CGMCC14861菌液于6 000 r/min离心3 min,弃上清液,生理盐水洗涤2次,再将菌体重悬于1 mL生理盐水制成菌悬液。调节均悬液OD600nm值在0.6~0.8,然后吸取10 μL涂在诱变锌片(锌片先用酒精灯烧热,在超净台冷却后用移液器涂片),然后进行ARTP诱变,为确定最佳处理时间,分别设置菌悬液的诱变时间为10 s、20 s、30 s、40 s、50 s、60 s、70 s、80 s,诱变完成后将锌片放入装有1 mL无菌水的EP管,稀释10 000倍后进行平板涂布,平板37 ℃培养24 h进行致死率曲线的绘制。选取致死率70%~80%的诱变时间进行4轮诱变。
1.3.3 诱变高产CDA菌株的筛选
设计了包括ARTP诱变、微滴培养(MMC)、LB平板初筛和24深孔板发酵复筛四部分内容的高产几丁质脱乙酰基酶菌株的诱变选育方法,见图1。以R.equiCGMCC14861为出发菌株首先进行ARTP诱变,诱变后,将诱变后的菌悬液加入含有4-硝基乙酰苯胺(50 mg/L)的LB液体培养基中进行微滴培养(MMC)。单个微流控芯片包含0~200个液滴单元,其中每个液滴的体积约为2 μL,液体可以进行350~800 nm的波长扫描,选择400 nm作为筛选波长。筛选到吸光度值较对照组明显升高的液滴,然后将液滴进行稀释后涂布于加入含有4-硝基乙酰苯胺(50 mg/L)的LB固体培养基中进行初筛,固体培养基中的4-硝基乙酰苯胺可以被菌体产生的几丁质脱乙酰基酶脱乙酰生成黄色的4-硝基苯胺而产生黄色圈,黄色圈越大说明菌体的产酶能力越强,所以选择黄色圈较大的菌落进行24深孔板37 ℃发酵培养4 h进行复筛验证。
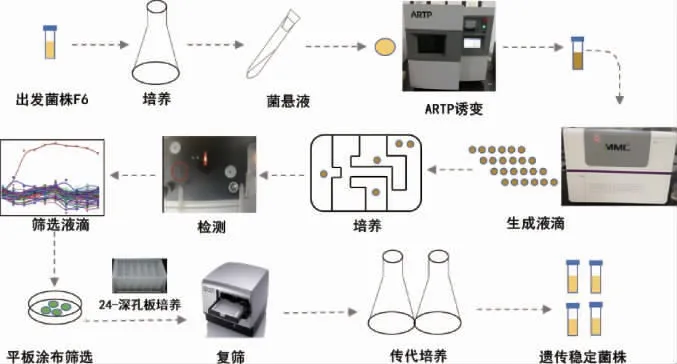
图1 常压室温等离子+微流控对高产ReCDA菌株的诱变选育流程Fig. 1 Process of mutagenesis and breeding of high-yield ReCDA strain by atmospheric and room temperature plasma and microbial microdroplet-culture
1.3.4 CDA酶活力检测[20]
采用4-硝基乙酰苯胺脱乙酰生成对硝基苯胺产物的颜色变化在波长400 nm下发生明显的吸光度值变化来表征酶活力。
(1)对硝基苯胺标准曲线的制作
准确称取0.005 g对硝基苯胺,加少量水溶解并在50 mL容量瓶中定容。然后用去离子水进行10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9梯度稀释,以去离子水为参照,测定波长400 nm处的吸光度值。以对硝基苯胺质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制对硝基苯胺标准曲线。
(2)反应体系
称取10 mg 4-硝基乙酰苯胺,用50 mL容量瓶定容,质量浓度为200 mg/L。加200 mg/L的4-硝基乙酰苯胺0.3 mL,再加酶液0.3 mL(直接吸取发酵液),37 ℃预保温的磷酸盐缓冲液(0.05 mol/L,pH=7)0.9 mL,在37 ℃水浴中反应1 h,沸水浴终止酶活反应。
(3)酶活检测
终止反应后的溶液经10 000 r/min离心分离5 min,测定上清液波长400 nm处吸光度值,设置3个平行。空白对照:加4-硝基乙酰苯胺溶液0.3 mL,加缓冲液0.9 mL,0.3 mL灭活酶液(沸水浴灭活)。
(4)CDA酶活力定义及酶活力计算
CDA酶活力定义:在上述反应条件下,每小时产生1微克对硝基苯胺所需要的酶量定义为一个酶活力单位(U/mL)。
CDA酶活力计算公式如下:

式中:A400nm为酶解液样品的吸光度值;A0为空白的吸光度值;D为稀释倍数;T为酶促反应时间,h;K为线性系数。
2 结果与分析
2.1 ARTP诱变致死率曲线
ARTP不同处理时间对R.equiCGMCC14861的生长及致死率影响,结果见图2。由图2a可知,ARTP照射处理10 s、20 s、30 s、40 s、50 s、60 s、70 s、80 s后,R.equiCGMCC14861的生长明显受到抑制。由图2b可知,ARTP照射处理10 s、20 s、30 s、40 s、50 s、60 s、70 s、80 s后,致死率分别为25.5%、62.8%、80.40%、96.87%、98.10%、99.14%、99.39%、99.88%。根据研究报道,选取致死率为70%~80%时,诱变效果最佳[20]。根据实验结果,诱变时间20s时致死率为62.8%、30 s时达到了80.40%,诱变时间25s的致死率可在70%~80%这个范围,因此,本研究采用ARTP诱变时间为25 s。

图2 常压室温等离子不同诱变时间对马红球菌CGMCC14861生长(a)及致死率(b)的影响Fig. 2 Effect of different atmospheric and room temperature plasma treatment times on the growth (a) and mortality rates (b) of Rhodococcus equi CGMCC14861
2.3 诱变高产菌株的MMC筛选
ARTP诱变后的菌液加入MMC培养系统进行高产CDA液滴的筛选,结果见图3。
由图3可知,经过ARTP诱变后有多个液滴的OD400nm值数据随着发酵时间的延长增加显著。其中,有五个液滴的OD400nm值数据增幅最大,分别是液滴73、74、75、76和105,表明这5个液滴中CDA的活性较高。所以,推测这五个液滴中均存在高产CDA的诱变菌株。五个液滴中73、74、75、76四个液滴相邻且均出现OD400nm值数据增幅较大的结果,说明在这个范围的液滴中可能存在相同的高产CDA诱变菌株。
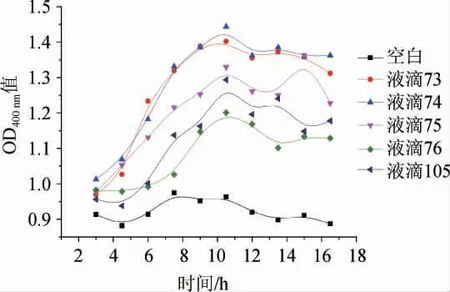
图3 马红球菌CGMCC14861的微生物微滴培养结果Fig. 3 Results of microbial microdroplet-culture of Rhodococcus equi CGMCC14861
2.4 诱变高产菌株的复筛
对获得的五个OD400nm值数据增幅最大的液滴分别稀释后进行LB平板初筛及24深孔板复筛,平板初筛主要是通过固体培养基中的4-硝基乙酰苯胺可以被菌体产生的几丁质脱乙酰基酶脱乙酰生成黄色的4-硝基苯胺而产生黄色圈,黄色圈越大说明菌体的产酶能力越强,选择黄色圈较大的菌落进行24深孔板37 ℃发酵培养4 h进行复筛验证,复筛的原理主要是模拟微量液体发酵,发酵4h后取样检测酶活确定高产CDA的菌株,结果见图4。由图4a可知,原始菌株R.equiCGMCC14861在24深孔板发酵4 h的OD400nm值为0.207,红线以上为产酶增加的菌株,其中OD400nm值>0.630的有17株(A41、B4、B5、B7、B14、B24、B39、C7、C26、C35、C41、C53、C59、C63)。即经过多轮筛选最终从700多个平板单菌落中筛选出17株与原始菌株相比发酵产酶提高300%以上的诱变高产CDA菌株。由图4b可知,表征诱变菌株CDA产量的OD400nm值与表征菌体生长的OD600nm值并不成正比,说明诱变菌株的CDA产量提升并不完全是由菌体量的增加导致。

图4 几丁质脱乙酰基酶高产菌株平板初筛(a)及24深孔板复筛(b)结果Fig. 4 Results of plate preliminary screening (a) and 24-deep-hole plate rescreening(b)of strains with high chitin deacetylase yield
筛选到的17株高产CDA菌株,其产酶及菌体生长变化结果见表1。由表1可知,OD600nm值最高的3个菌株分别是A41、C22和C39,产酶OD400nm值最高的三个菌株分别是B4、C7和C63,由此可见,诱变后菌株的CDA产量变化跟菌体生长并不成正比。为了更加准确的表征诱变菌株的产CDA能力,对比分析了菌株OD400nm值/OD600nm值(OD400nm值/OD600nm值表示单位菌体的CDA产量),由表1可以看出,OD400nm值/OD600nm值数值最高的3个菌株分别是B4、C26和C41,即该3株菌株单位菌体产CDA最高(因为OD400nm值是表征菌体产酶水平的,OD600nm值是表征菌体量的,两个数据的比值可以表征单位菌体的产酶量),其中菌株B4 OD400nm值/OD600nm值最高,为出发菌株的3.15倍。

表1 几丁质脱乙酰基酶菌株的产酶及菌体生长对比Table 1 Comparison of chitin deacetylase production and growth of strains
选取菌株B4进行摇瓶培养发酵实验,发酵产酶曲线见图5。由图5可知,发酵36 h诱变菌株B4达到最大产酶419.11 U/mL,是空白对照107.58 U/mL的3.90倍。经过进一步的稳定性实验,确定最佳几丁质脱乙酰基酶高产菌株为B4。
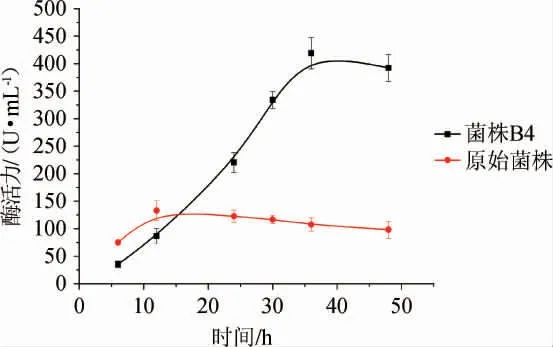
图5 菌株B4摇瓶培养产几丁质脱乙酰基酶曲线Fig. 5 Chitin deacetylase production curve of strain B4 with shake flask culture method
3 结论
本研究构建了基于常压室温等离子体(ARTP)诱变技术与微液滴流控筛选(MMC)技术的几丁质脱乙酰基酶(CDA)高产菌株的诱变选育方法,诱变照射时间为25 s时致死率达到70%~80%,经过多轮的诱变选育,最后获得了17株产酶提高300%以上的CDA诱变高产菌株,通过对比分析17株高产菌株单位菌体产CDA的能力及发酵验证,获得了1株单位菌体产酶提升3.15倍的CDA高产菌株B4,发酵产酶总量达到419.11 U/mL,为原始菌种的3.90倍。本研究为CDA高产菌株的诱变选育及高通量筛选提供了一种新的方法和借鉴。
采用的诱变选育和构建的快速筛选方法对于筛选CDA高产菌株是有效和可行的。但该方法能够得到有效应用的前提是找到了CDA脱乙酰后发生颜色反应的底物4-硝基乙酰苯胺,且该底物对于菌株的生长和发酵未发生明显的抑制作用。该方法目前还不适用于无法直接通过发酵液的吸光值变化来表征菌株变化的情况。

