尤文肉瘤及尤文样肉瘤临床病理学研究进展
魏雪静 程鸣 综述 李锋 审校
尤文肉瘤(Ewing's sarcoma,ES)是第一个被发现具有特征性染色体易位的肉瘤,分子学检测大部分存在EWSR1 与ETS 家族基因的融合,少部分存在FUS与ETS家族基因的融合。此外,另发现一类小圆细胞肉瘤在形态上与经典ES相似,免疫表型与ES有部分重叠,但缺乏ES的典型分子特征,即EWSR1-ETS融合,因此将此类肿瘤命名为尤文样肉瘤。目前为止,尤文样肉瘤包括4种主要病理分型:CIC重排肉瘤、BCOR重排肉瘤、EWSR1 与非ETS 家族基因重排的肉瘤和未分化小圆细胞肉瘤。尽管尤文样肉瘤形态近似,但多数具有其各自独特的免疫表型及分子遗传学标记,随着分子检测技术的应用,更多以融合基因命名的具有独特分子特征的尤文样肉瘤及小圆细胞肿瘤被重新归类。本文将就ES及尤文样肉瘤的主要病理分型的最新研究进展进行综述。
1 ES
ES在所有软组织肉瘤中所占比例不足1%,主要累及长骨干骺端。也可发生于成人椎旁区的深部软组织,下肢和上肢近端,肾脏[1]、胰腺[2]和脑膜[3]以及皮肤等部位[4]。
ES 在镜下呈现为典型的圆形细胞肉瘤,由单一小圆细胞组成,细胞质稀少,CD99阳性,S-100、CD56、NSE、CgA和结蛋白不同程度表达。有报道PAX7 可作为尤文肉瘤的特异性抗体[5]。NKX2.2 也被报道为ES的免疫组织化学标志物,尽管NKX2.2敏感度较高,但特异性中等,其在嗅神经母细胞瘤、滑膜肉瘤、恶性黑色素瘤均有表达[6],在小细胞癌(80%)和分化良好的神经内分泌肿瘤(45%)中亦观察到阳性表达[7],建议与CD99、PAX7应用。ES的典型分子遗传特征为位于22号染色体的EWSR1基因与ETS转录因子家族成员之间的融合,最常见的是11号染色体上的FLI1[8],其余包括ERG(10%)、ETV1(<1%)和ETV4(<1%,图1,表1)[9-10]。另一个较为少见的基因融合是16号染色体上的FUS与ERG基因或FEV基因发生融合。一项报道的15例病例中,与FUS基因发生融合的有ERG(11例)、FEV(3例)和NFATC2基因(1例)[11-12]。EWSR1和FUS 是RNA结合蛋白TET家族成员,在人体组织中广泛表达并参与多水平的基因调控。基因序列分析显示FUS和EWSR1基因之间存在广泛的同源序列,提示两者具有同源性,FUS或为ES的替代易位伙伴[13]。
目前,ES患者的5年总生存率约75%,而在转移性ES患者中,5年总生存率降至30%,尤其是骨外ES的预后仍不理想。然而,多模式治疗(手术切除、放疗和化疗)的应用,使长期生存率已从不足10%提高至30%~40%[14]。近年来,随着精准医疗的发展,分子靶向治疗成为抗肿瘤治疗的新途径。ES由于存在特定基因易位t(11;22)(q24;q12)而形成EWS-FLI1融合基因,组蛋白赖氨酸特异性脱甲基酶1(lysine specific demethylase 1,LSD1)抑制剂针对此融合基因,从表观遗传层面“关闭”基因功能,相关临床研究已取得突破性进展[15]。
2 尤文样肉瘤
2.1 EWSR1与非ETS家族基因重排的肉瘤
带有EWSR1或FUS基因重排的非ETS家族基因融合的圆形细胞肉瘤代表了一种罕见亚群,占ES 总体的1%(图1,表2)。目前文献报道的融合伴侣基因包括锌指家族成员PATZ1(1p36)和SP3(2p31)、染色质重塑基因SMARCA5(4q31)、与胚胎干细胞相关的转录因子POU5F1(6p21)以及T细胞介导的转录因子NFATC2(20q13)。
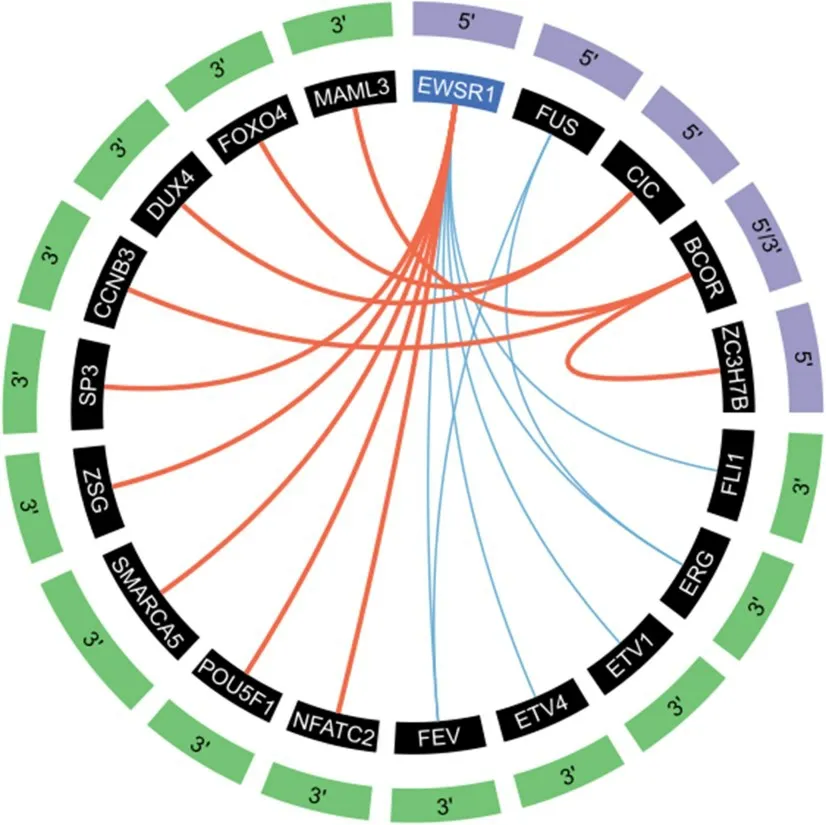
图1 经典ES和尤文样肿瘤融合概况[10]
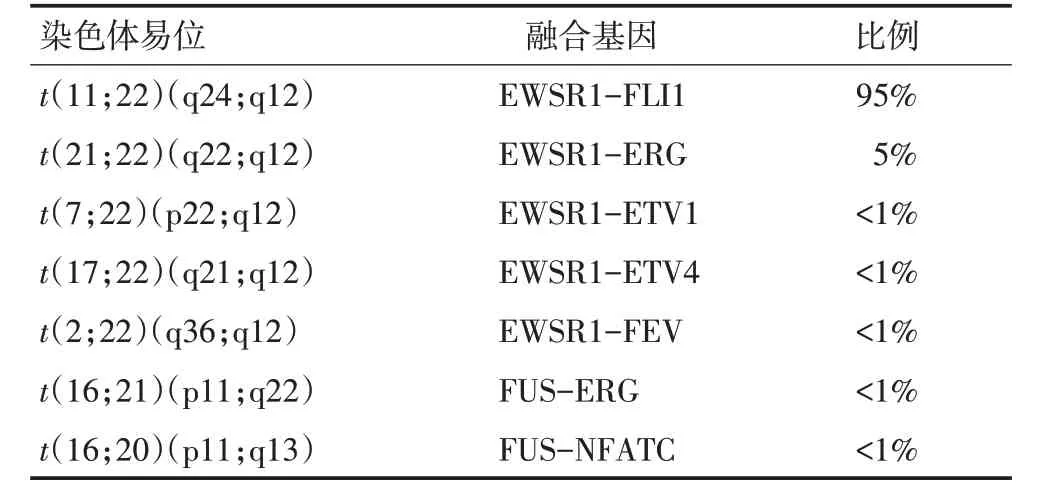
表1 经典ES融合

表2 尤文样肉瘤融合
Mastrangelo等[16]描述了1例EWSR1-PATZ1融合肉瘤,与经典ES 相比,患者发病年龄较大,且具有非典型的组织学特征。肿瘤见于胸壁和腹部深部软组织,镜下肿瘤细胞呈圆形或梭形,位于胶原基质中,有丝分裂活性较低,较少观察到坏死。免疫组织化学显示CD99、S100、肌源性标记和突触素阳性。Yamaguchi 等[17]描述了1例39岁女性的伴有染色体t(6;22)(p21;q12)易位的右侧耻骨起源侵袭性肿瘤,形态学表现为短梭形肿瘤细胞弥漫分布,免疫组织化学检查显示Vimentin、S-100和NSE阳性,分子检测发现EWSR1与POU5F1融合。Wang等[18]观察1例发生于额部的EWSR1-SP3 融合肉瘤,增长迅速并伴有广泛转移。组织学表现为小圆细胞肿瘤,免疫组织化学检查显示Bcl-2 呈阳性,CD99和NSE 弱阳性。分子学检查显示t(2;22)(q31;q12)易位,但有关此类肿瘤的报道极少。Szuhai 等[19]报道了4例EWSR1-NFATC2融合肉瘤患者的肿瘤特征。所有患者年龄均>18岁,形态学与不典型ES肿瘤细胞相似,细胞核具有多形性,染色质粗糙,核仁清晰可辨,核分裂及坏死易见。免疫组织化学检查显示CD99 染色呈强阳性,Bcl-2阳性,结蛋白阴性,FLI1 呈弱阳性。DNA 甲基化数据的非监督聚类和t分布随机近邻嵌入分析显示,EWSR1-NFATc2 融合肉瘤存在同源甲基化簇,与ES 及其他亚型区别明显,强调EWSR1-NFATc2 融合肉瘤与ES 分属不同的肉瘤[20]。近期此种类型融合肉瘤的文献报道较多,进一步总结病例特点[20-21]发现,多为骨或软组织肿瘤,并且倾向发生于成年男性的长骨。与ES、肌上皮肿瘤和骨外黏液样软骨肉瘤免疫形态学近似。多数肿瘤表现为上皮样细胞形态,具有胶原基质。肿瘤均为CD99 膜阳性和NKX2.2 核阳性,部分病例也可表达PAX7[22]。最近报道,NKX3.1 是EWSR1-NFATC2肉瘤有效的免疫组织化学标志物[23]。此类肿瘤具有局部复发和远处转移的潜力,并且对ES 化疗方案的疗效不佳,目前鲜见报道有效的治疗方案。Sumegi等[24]报道1例5岁女性患者腰骶部椎管的巨大肿块,分子检测证实为EWSR1-SMARCA5 相关尤文样肉瘤,组织学特征为小圆细胞,细胞核深染,胞质空泡状。免疫组织化学检查显示CD99、Vimentin、Syn和NSE阳性。分子学检查显示存在t(4;22)(q31;q12)易位。尤文样肉瘤形态学、免疫组织化学及分子学有关报道见表2,3。
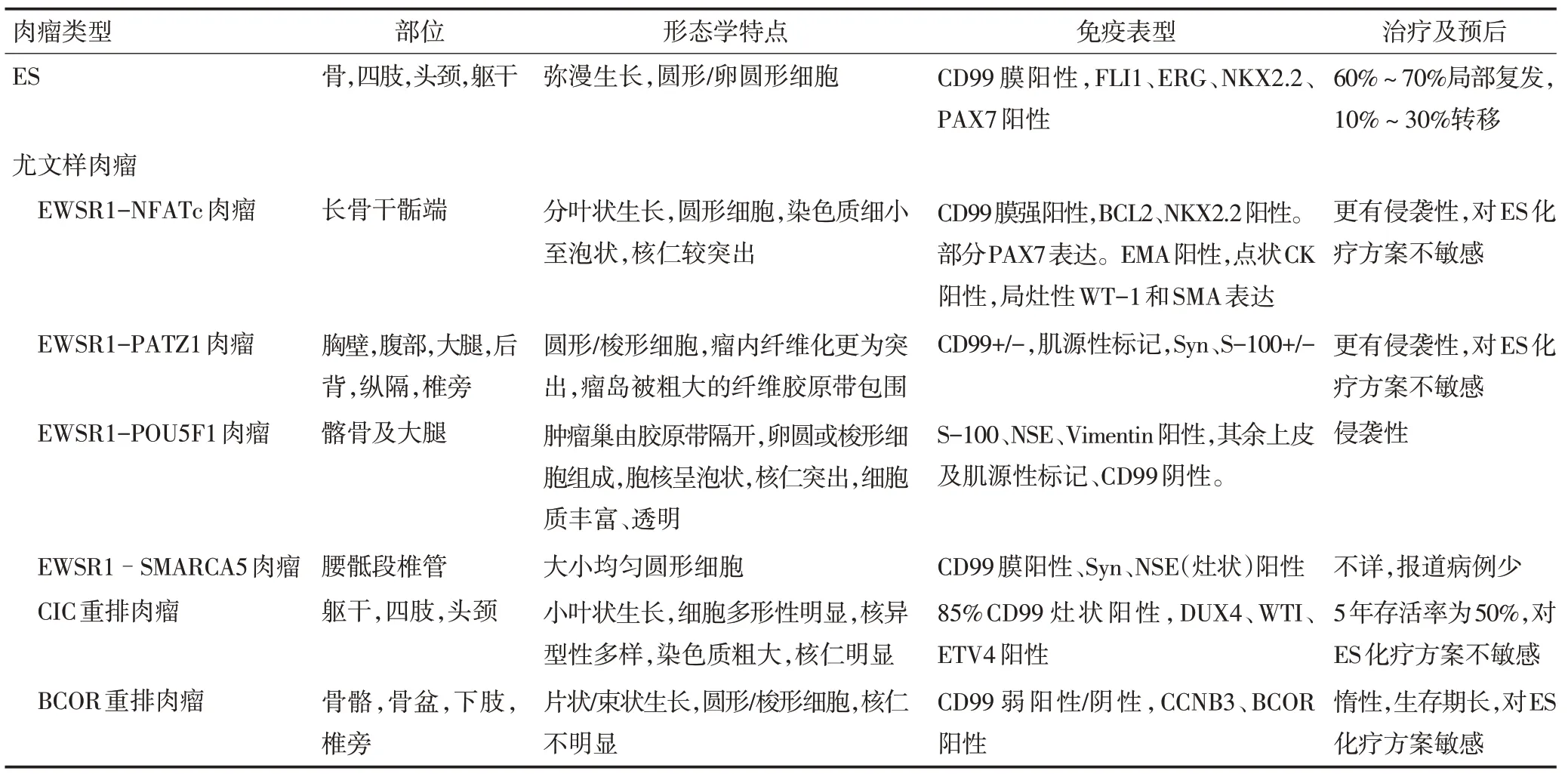
表3 ES与尤文样肉瘤的形态学、免疫表型及预后等异同汇总
在治疗方面,即便非ETS融合圆形细胞尤文样肉瘤在完全手术后可以获得较好的控制,但有报道1/3的患者会复发和转移扩散[25]。并且此类肿瘤对ES化疗方案的反应较差,治疗需结合分子学检查寻找特定靶向药物,使用区别于ES的治疗方案。鉴于其罕见性,对此类肿瘤开展分子学研究使靶向治疗成为可能,特别是通过非侵入性手段,包括循环肿瘤DNA和外泌体。越来越多的证据表明细胞外膜囊泡在多种癌症亚型的肿瘤发生中发挥了重要作用,应鼓励开发针对具有独特驱动基因肿瘤的靶向药物[26]。
2.2 CIC重排肉瘤
尤文样肿瘤家族中最常见和最具特征性的亚型是CIC重排肉瘤。首例CIC重排圆细胞肉瘤于1996年被报道,该患者为12岁男性,表现为脚踝肿块合并肺转移,具有t(4;19)(q35;q13.1)易位[27]。基于大型全基因组测序的筛查表明,在EWSR1基因重排阴性的尤文样肿瘤中,约66%存在CIC-DUX4融合[28-29]。
CIC重排肉瘤主要发生在儿童和青少年,发病年龄3~80岁及以上。多数肿瘤发生于躯干、四肢或头颈部的深层软组织,有时伴有继发性骨侵犯。近期报道的1例CIC-NUTM1融合病例对中枢神经系统表现出明显的趋向性[30]。CIC重排肉瘤在显微镜下表现为小、中体积肿瘤细胞,呈弥漫或结节状分布,肿瘤细胞之间为纤维性间隔;细胞核呈圆形或卵圆形,核深染或染色质空泡状,核仁可见,核分裂象多见。免疫组织化学检查显示,约85%病例CD99 染色为灶状阳性,缺乏在ES中观察到的强烈弥漫性阳性,95%病例WT1核阳性[31]。DUX4[32]和ETV4[33]是近期报道的敏感性和特异性较高的免疫组织化学标志物。
与经典ES 相比,CIC重排肉瘤更具侵袭性[31,34],预后更差,最常见的首发症状为肺转移,5年总体生存率约50%。目前大多数CIC-DUX4 融合肉瘤均按照ES 治疗方案进行治疗,约70%患者对治疗方案反应不佳,即使有效,疗效维持时间通常较短,很快产生耐药,且随后疾病进展迅速[31]。Haidar等[28]回顾分析44例CIC-DUX4融合肉瘤病例。尽管多数患者使用了综合治疗方法(手术、化疗、放疗),中位生存期仍不足2年。综上所述,化疗在CIC重排肉瘤局部和全身控制中的作用尚需探索,与经典ES患者相比,化疗对于此类尤文样肉瘤并非如ES治疗一样重要。
2.3 BCOR重排肉瘤
BCOR重排肉瘤是尤文样肉瘤的第二大亚型。最早是由Pierron等[35]通过对594例骨源性肉瘤病例进行RNA测序分析发现,4%(24/594)尤文样肉瘤病例中鉴定出BCOR-CCNB3融合,并且在这些肿瘤中未检测到EWSR1基因断裂。BCOR-CCNB3融合病例约占所有BCOR重排肉瘤的60%[36],除此之外,也可见BCORMAML3和ZC3H7B-BCOR融合的报道[37]。
BCOR-CCNB3融合肉瘤主要发生于儿童和青少年,以男性多见,常累及骨盆、下肢和椎旁,内脏位置可见报道,但极为罕见[38]。显微镜下肿瘤细胞呈圆形、短梭形,实性片状排列,局部可呈漩涡状排列。免疫组织化学检查显示CD99 胞膜、胞质或核旁阳性,但其强度弱于经典ES,病例多呈强而弥漫的CCNB3 核阳性[35],也可以观察到BCOR表达,但其也可以在滑膜肉瘤中表达,特异性不如CCNB3[39-40]。由于CCNB3和BCOR 免疫组织化学检查缺乏足够的敏感性和特异性,因此分子检测对于BCOR重排肉瘤诊断至关重要。与其他尤文样肉瘤不同,BCOR重排肉瘤对经典的ES 化疗方案敏感性较高,并且患者生存率与ES患者相似。Puls 等[41]报道6例BCOR重排肉瘤患者接受治疗后,4例达到病理学完全缓解,另2例患者仅有散在残留的肿瘤细胞。Ludwig 等[42]报道3例BCOR重排肉瘤患者接受治疗后有丝分裂细胞计数均减少。总之,与ES患者近似的化疗效果会使临床医生继续使用ES化疗方案对BCOR重排肉瘤患者进行治疗。
尽管BCOR重排肉瘤在病理形态学和临床治疗上与ES 有相似之处,但基因图谱和单核苷酸多态性(single nucleotide polymorphism,SNP)分析表明,这一新的肿瘤亚型在生物学上与ES和CIC重排肉瘤均存在差异。因此,BCOR-CCNB3 融合肉瘤目前被认为是独立的肉瘤类型[35]。重要的是,与ES 相比,BCOR重排肉瘤的生物学行为更为惰性[38]。
2.4 未分化小圆细胞肉瘤
2013年第4版《WHO骨与软组织肿瘤分类》引入了未分化小圆细胞肉瘤的类别。此类肿瘤多为高级别肿瘤,预后较差。随着更为精准的分子技术的使用,特别是基于下一代测序技术的普及,未分化小圆细胞肉瘤数量正持续减少[36]。尽管如此,一部分未分化的小圆细胞肉瘤(包括部分尤文样肉瘤)仍尚未分类。在根据基因融合类型对小圆形细胞肉瘤进行细分的趋势下,应首选基于基因测序的检测方法进行诊断。
3 结语
分子遗传学对骨和软组织肉瘤的形态学分类有较大贡献。尤文样肉瘤在形态学、免疫组织化学和临床上与经典ES 有不同程度的相似之处,但又缺乏ES的特征性分子特征。随着现代免疫组织化学和分子技术的进步,研究者对ES和尤文样肿瘤的认识有了较大的提高,但也提出了新的问题和挑战。目前尤文样肉瘤的融合基因及纳入标准值得进一步研究,准确分类仍然是目前亟待解决的问题。同时,细胞遗传学已经证实少数尤文样肉瘤的独立性,但大部分尤文样肉瘤的发病机制仍在研究中。重要的是,除了形态学和分子遗传学的多样性外,尤文样肉瘤与ES相比还表现出显著的临床差异。CIC重排肉瘤较ES相比更具侵袭性,对ES化疗方案的反应率较低。而BCOR重排肉瘤更为惰性,但应用ES 化疗方案效果较好。基于下一代测序技术的应用,使得在这组无特征化的尤文样肉瘤中识别出不同的亚群,但是否扩大尤文肉瘤的范围,或将其作为独立肉瘤亚型尚存争议。但对于这一类具有侵袭性的肉瘤,寻找最佳治疗方案仍是首要问题。

