调控AQP-4蛋白治疗大鼠脑积水的效果
?? 吴剑 李秋平 王占祥 胡凡 齐飚 张菲

【摘要】 目的:研究通過调控AQP-4蛋白治疗大鼠脑积水。方法:选取雄性成年(周龄8周)SD大鼠80只,体重(250±20)g,随机分成四组,分别为手术组、假手术组、阴性干预组、阳性干预组,各20只。手术组、阳性干预组、阴性干预组都以向大鼠脑室内注射3%灭菌高岭土生理盐水混悬液成功建立脑积水模型,假手术组的大鼠则为向脑室内注射生理盐水。造模第8天,对手术组和假手术组不行任何处理,对阴性干预组予以腹腔注射黄体酮,对阳性干预组予以腹腔注射睾酮(两种药物用法用量均为1次/d,用量为:8 mg/kg给药持续2周)。第22天时给所有大鼠行MRI检查,然后处死大鼠收集脑组织,行RT-PCR、Western-blot检测。结果:(1)MRI结果显示阳性干预组大鼠脑室扩大积水现象较阴性干预组小,差异有统计学意义(P<0.05)。(2)RT-PCR结果显示阳性干预组AQP-4 mRNA较阴性干预组高,差异有统计学意义(P<0.05)。(3)Western-blot检测显示阳性组大鼠的AQP-4蛋白表达较阴性组高,差异有统计学意义(P<0.05)。结论:AQP-4蛋白的表达水平可影响脑积水进展,通过上调AQP-4蛋白的表达可能对脑积水的进展起到抑制作用。
【关键词】 脑积水 AQP-4蛋白 睾酮 黄体酮
doi:10.14033/j.cnki.cfmr.2020.16.004 文献标识码 A 文章编号 1674-6805(2020)16-000-04
Effect of Regulating AQP-4 Protein on Hydrocephalus in Rats/WU Jian, LI Qiuping, WANG Zhanxiang, HU Fan, QI Biao, ZHANG Fei. //Chinese and Foreign Medical Research, 2020, 18(16): -12
[Abstract] Objective: To study the treatment of hydrocephalus in rats by regulating AQP-4 protein. Method: A total of 80 male adult (8 weeks old) Sprague-Dawley (SD) rats with body weight of (250±20) g were randomly divided into four groups, including operation group, sham operation group, negative intervention group and positive intervention group. The operation group, the positive intervention group and the negative intervention group all successfully established hydrocephalus model by injecting 3% sterile kaolin normal saline suspension into the rat brain chamber, while the rats in the sham operation group were injected normal saline into the brain chamber. On the 8th day of modeling, the operation group and the sham operation group were not given any treatment. The negative intervention group was given Progesterone by intraperitoneal injection, and the positive intervention group was given Testosterone by intraperitoneal injection (the dosage of both drugs was once a day, and the dosage was 8 mg/kg for 2 weeks). On the 22nd day, all rats were examined by MRI, and then killed to collect brain tissue for RT-PCR and Western-blot. Result: (1) MRI results showed that the hydrocephalus in the positive intervention group was smaller than that in the negative intervention group, and the difference was statistically significant (P<0.05). (2) The results of RT-PCR showed that AQP-4 mRNA in the positive intervention group was higher than that in the negative intervention group, and the difference was statistically significant (P<0.05). (3) Western-blot showed that AQP-4 protein expression in the positive group was higher than that in the negative group, and the difference was statistically significant (P<0.05). Conclusion: the expression level of AQP-4 protein can affect the progression of hydrocephalus, and up regulating the expression of AQP-4 protein may inhibit the progression of hydrocephalus.
[Key words] Hydrocephalus AQP-4 protein Testosterone Progesterone
First-authors address: Xiamen Branch, Zhongshan Hospital, Fudan University, Xiamen 361015, China
脑积水是由于中枢神经系统疾病(如颅脑肿瘤、脑室出血、颅内感染等)影响脑脊液循环通路,导致了脑脊液过多蓄积于脑室内所引起的疾病[1]。通过动物脑积水实验模型研究发现:脑室周围的脉络丛、室管膜、胶质细胞上,都发现AQP-4蛋白的表达出现明显升高,且随着AQP-4蛋白表达的提高,脑积水的相应临床症状有所改善[2-3]。这些研究提示AQP-4蛋白的表达与脑积水的病程进展有关。AQP-4蛋白是一种调节水分的选择通透性的蛋白广泛分布于中枢神经系统中,AQP-4蛋白主要起到了调节脑组织水分代谢的作用[4],AQP-4蛋白主要有两种亚型:M1型和M23型,其可增强细胞膜对水的通透性,在脑细胞水肿时有利于水分清除[5]。调控AQP-4蛋白在脑出血后脑细胞水肿、颅脑损伤的研究开展较多,并有一些观点认为降低AQP-4表达能降低脑出血后脑细胞水肿[6],本实验通过检测AQP-4和GFAP的基因、蛋白表达,从分子学水平探索脑积水发生发展过程中AQP-4对脑脊液生成及清除所产生的作用,并通过加以药物睾酮、黄体酮进行干预对照,探究上调AQP-4蛋白表达治疗脑积水的可能性,为调控AQP-4蛋白的表达来治疗干预脑积水的进展提供新的思路。
1 材料与方法
1.1 一般材料
实验动物分组:取健康雄性SD大鼠80只,体重为(250±20)g,鼠龄为8周,由厦门大学实验动物中心提供。动物生产许可证号:SCXK(沪)2007-0005(上海斯莱克实验动物有限责任公司),使用许可证号:SYXK(闽)2008-0003(厦门大学实验动物中心)。采用随机分组法分为四组,分别为手术组、假手术组、阴性对照组、阳性对照组,各组体重比较差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 各组实验动物模型建立和给药干预方法 (1)麻醉固定消毒:取雄性SD大鼠,根据各鼠体重计算麻药(10%水合氯醛)使用量(300 mg/kg),腹腔注射麻醉,严格消毒铺巾备皮,将大鼠头部固定于大鼠脑立体定位仪。(2)体位与暴露:取大鼠前至眉弓中点,后近対耳线,头顶正中切口,沿着正中线切开头皮约1 cm,钝性分离皮下组织,暴露前囟。穿刺点定位于:前囟后0.8 mm,中线旁开1.6 mm,以牙科钻钻孔直到硬脑膜。(3)入路与注射:手术组、阳性干预组、阴性干预组三组的大鼠均在脑室内注射3%高岭土混悬液,具体方法为:持微量进样器吸取3%灭菌高岭土生理盐水混悬液30 μl,固定于立体定位仪上,连接微量注射泵控制端,垂直进针刺破硬膜后继续进入4.0 mm,调节微量注射泵以10 μl/min的速率缓缓注入,注射完之后骨蜡封闭骨孔,缝合头皮。假手术组则在大鼠脑室内则注射生理盐水。(4)阳性干预组于手术后第8天开始腹腔注射睾酮,阴性干预组于手术后第8天开始腹腔注射黄体酮,用法:睾酮:1次/d,用量为8 mg/kg,给药持续2周。黄体酮:1次/d,用量为8 mg/kg,给药持续2周。其余两组不做任何处理。所有大鼠术后第22天进行MRI检测,之后处死取脑组织标本。
1.2.2 MRI检查 实验第22天,以10%水合氯醛腹腔注射麻醉大鼠后,行MRI检测,1 mm为层间距进行扫描,分别照射T1和T2加权成像。侧脑室指数通过T2加权成像计算。MRI-T2参数如下:TR=5 000 ms,TE=50 ms,视野(FOV)=5.0 cm×5.0 cm,矩阵:256×256,厚度:1 mm。
1.2.3 腦组织取材及测量脑组织含水量 大鼠行MRI检查后,以10%水合氯醛按300 mg/kg腹腔注射深度麻醉,取头皮针插入左心室进行生理盐水及4%多聚甲醛灌注。完后将大鼠断头,咬骨钳咬除颅骨冰上迅速解剖剥取脑组织。沿中线切开鼠脑,一侧大脑用为Western-blot检测,另一侧以视交叉为界切开,前半脑做RT-PCR检测[7]。
1.3 统计学处理
本研究数据采用SPSS 17.0统计学软件进行分析和处理,计量资料以(x±s)表示,采用t检验,计数资料以率(%)表示,采用字2检验,P<0.05为差异有统计学意义。
2 结果
2.1 模型一般观察
MRI显示,手术组、阳性干预组及阴性干预组在造模3周后均出现不同程度脑室扩大,假手术组则未出现明显脑室扩大,阳性干预组相对于阴性干预组,脑室扩大程度较轻,相对于手术组,脑室扩大程度也较轻。
2.2 假手术组与手术组比较
根据观察侧脑室体积发现,假手术组未形成脑积水,脑室系统几乎辨认不出,手术组均形成脑积水,MRI上可见其脑室扩大变形,皮层受压变薄,脑室周围组织水肿,第三脑室、第四脑室、蛛网膜下腔也不同程度扩大。室周白质明显变薄(图1);假手术组侧脑室体积为(16.8±3.1)mm,手术组侧脑室体积为(38.7±3.3)mm,比较差异有统计学意义(P<0.05)。
2.3 阳性干预组与阴性干预组比较
MRI显示,阳性干预组大鼠脑室增大程度相对较轻,脑组织受压不明显;阴性干预组侧脑室扩大明显,皮层受压变薄,脑室周围组织水肿也明显。第三脑室、第四脑室、蛛网膜下腔也不同程度扩大(图2);阳性干预组侧脑室体积为(9.8±2.4)mm,阴性干预组侧脑室体积为(44.2±3.1)mm,比较差异有统计学意义(P<0.05)。
2.4 RT-PCR检测
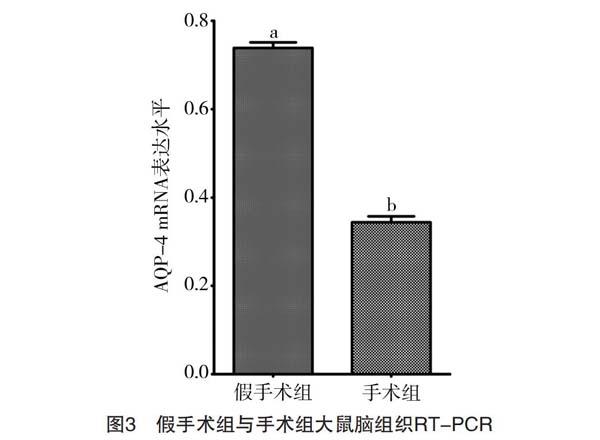
2.4.1 手术组与假手术组比较 RT-PCR结果显示假手术组AQP-4mRNA表達水平为0.76±0.03,手术组AQP-4 mRNA表达水平为0.37±0.03,手术组较假手术组低,差异有统计学意义(t=42.647,P<0.05),见图3。
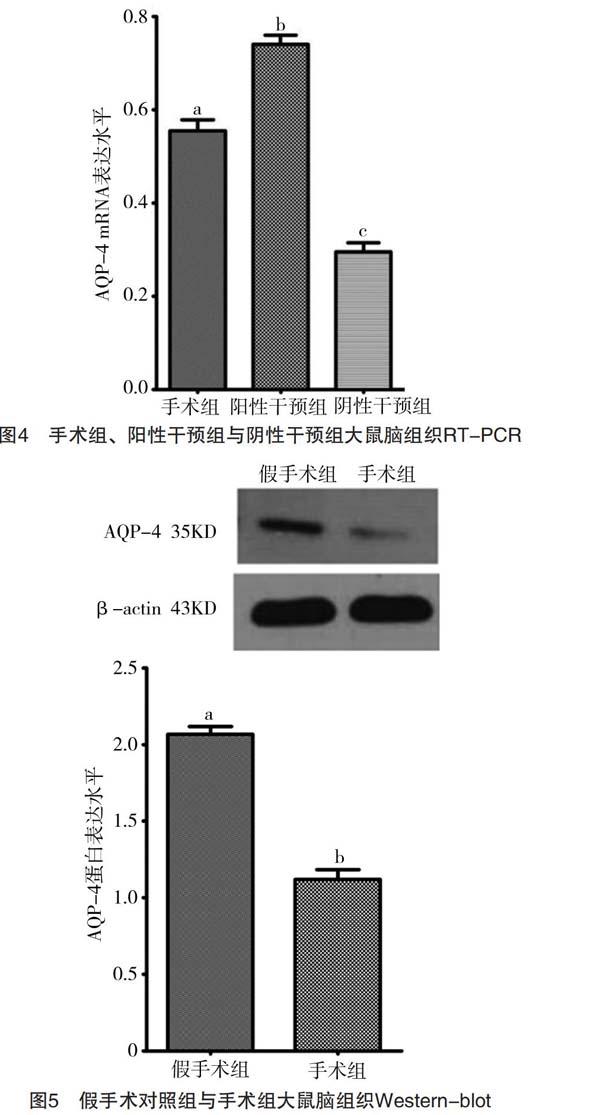
2.4.2 阳性干预组与阴性干预组比较 RT-PCR结果显示阳性干预组AQP-4 mRNA表达水平为0.76±0.03,阴性干预组AQP-4 mRNA表达水平为0.31±0.03,阳性组较阴性组高,差异有统计学意义(t=33.714,P<0.05),见图4。
2.5 Western-blot检测
2.5.1 手术组与假手术对组比较 Western-blot条带灰度值分析结果显示,手术组大鼠的AQP-4蛋白表达水平为1.12±0.02,假手术组表达水平2.08±0.02,手术组较假手术组低,差异有统计学意义(t=30.544,P<0.05),见图5。
2.5.2 阳性干预组与阴性干预组比较 Western-blot条带灰度值分析结果显示,阳性组干预的AQP-4蛋白表达水平为2.18±0.02,阴性干预组的AQP-4蛋白表达水平为1.12±0.02,阳性干预组中AQP-4表达高,差异有统计学意义(t=29.322,P<0.05),见图6。
3 讨论
脑积水常见的病因主要是脑脊液分泌过多、脑脊液循环通路受阻、脑脊液吸收障碍。这些因素导致脑脊液在脑室系统内过分积聚[8],影响脑脊液循环的主要因素有:颅内静脉压、血脑屏障间的胶体渗透压、脑脊液压力差及脑室周围室管膜细胞的吸收[9]。脑积水患者的脑组织因为水分清除障碍,导致细胞内积水蓄积,形成细胞性脑水肿,进而导致血管壁细胞内皮紧密结构破坏,形成血管源性脑水肿,进而破坏血脑屏障,加重脑组织水肿[10]。
脑积水的治疗手段目前仍然以脑室-腹腔分流术、第三脑室造瘘术等外科手术治疗为主[11-13],这些相关治疗手段尚不能从根本上改变脑积水发生发展的过程。
AQP-4是目前被研究最多的一种水通道蛋白,也是脑组织中含量最丰富的水通道蛋白。其能高效地介导水分子的跨膜转运,是控制中枢神经系统组织内含水量的重要蛋白,很多研究证明AQP-4蛋白可以影响脑水肿的消除,直接影响到脑脊液循环[2,4,14]。AQP-4蛋白在大脑内的表达主要位于室管膜上皮细胞、星型胶质细胞、脉络丛细胞等处,这些部分的细胞主要位于蛛网膜附近,与脑脊液接触密切,对脑脊液的生成与吸收产生了重要的调节作用[15-16]。有研究发现,在脑积水合并颅内压升高的大鼠模型中,AQP-4在皮层胶质细胞及脑脊液中的表达出现明显升高[17]。Mao等[18]在研究高岭土诱导脑积水小鼠时发现,AQP-4 mRNA在大脑顶叶和海马区有明显增加,这可能是由于血管外周的AQP-4表达在大脑顶叶更容易被激活,且大脑顶叶和海马区含水量较别的区域减少。Guo等[19]发现,通过AQP-4 siRNA沉默AQP-4表达后,大鼠脑积水症状明显加重,表明AQP-4可以延缓大鼠脑积水的病程进展。Schmidt等[20]在研究犬脑积水模型时还发现,当AQP-4蛋白升高时,实验犬的脑积水症状出现缓解,甚至可以降低后期行脑室分流术的概率,表明AQP-4蛋白对降低脑室内多余水分蓄积起到积极的作用。Leandro等[21]在人类脑积水病例研究时发现AQP-4蛋白在脑脊液中的含量出现明显增高,可能是脑积水病理进展中室管膜细胞上的AQP-4蛋白表达增多,并有部分剥离到脑脊液中引起的。有研究通过对患者脑脊液中的AQP-4蛋白进行的ELISA定量分析,还发现相比于对照组,患有交通性脑积水的患者脑脊液中AQP-4蛋白含量的增高程度甚至大于阻塞性脑积水中AQP-4蛋白的增高程度。有胶质细胞体外培养的实验发现,使用NO诱导提高了AQP-4的表达,并改变胶质细胞的渗透压,减轻了脑细胞水肿,这或许是缓解脑积水的有利作用机制[22]。Eide等[23]研究正常颅内压脑积水发现,其胶质细胞足突上AOP-4表达水平下降,且其下降程度与脑积水症状严重程度呈正比。
Gu等[24]在使用胶质细胞进行体外培养时发现,加入睾酮后,使胶质细胞的AQP-4蛋白表达增加。在研究脑外伤引起脑水肿时候,发现性激素类药物(睾酮、黄体酮)腹腔注射给药后能很好地透过血脑屏障,在脑组织内发挥药效[25]。
本实验结果表明,睾酮上调了大鼠脑积水模型脑组织AQP-4蛋白表达,RT-PCR检测和Western-blot检测在基因和蛋白水平均验证了其作用。并且睾酮通过上调AQP-4蛋白的表达,减轻了大鼠模型脑积水的严重程度,这说明上调AQP-4蛋白表达,可以对减轻大鼠脑积水产生影响,在脑积水的情况下,上调AQP-4蛋白表达,可能通过增大脑组织对水分的清除率,减轻了脑积水的作用。MRI检查结果提示,睾酮不能完全阻止动物模型脑积水的进展,但能在脑积水进展过程中起到缓解作用,这也验证了睾酮通过上调AQP-4蛋白的表达,可以产生缓解和阻止脑积水发生发展的重要作用。相对应的,笔者实验表明,黄体酮下调了AQP-4蛋白的表达,没有能起到缓解大鼠脑积水进展的作用。经过睾酮干预后,大鼠脑积水症状比经过黄体酮干预的大鼠脑积水症状较轻,证明睾酮对脑积水的进展起到了缓解作用。AQP-4蛋白表达增高后,对应的大鼠脑积水的水平相对较轻,大鼠脑组织含水量相对降低,脑室体积相对变小。睾酮通过干预AQP-4蛋白,上调其在脑组织中的表达,延缓了脑积水的生成与发展,对脑积水有一定治疗作用,黄体酮则相反。
本实验研究说明上调AQP-4蛋白的表达,能一定程度上改善了脑积水的进展,上调AQP-4蛋白表达对大鼠脑积水有治疗作用。
参考文献
[1]詹潮鸿,张向阳,肖格磊,等.脑积水发病机制的研究进展[J].中南大学学报:医学版,2019,44(10):1188-1195.
[2] Desai B,Hsu Y,Schneller B,et al.Hydrocephalus: the role of cerebral aquaporin-4 channels and computational modeling considerations of cerebrospinal flid[J].Neurosurg Focus,2016,41(8):1-17.
[3] Hsu Y,Tran M,Linninger A A.Dynamic regulation of aquaporin-4 water channels in neurological disorders[J].Croatian Medical Journal,2015,56(5):401-421.
[4] Chu H,Huang C,Ding H,et al.Aquaporin-4 and cerebrovascular diseases[J].Int J Mol Sci,2016,17:1249-1258.
[5] Nagelhus E A,Ottersen O P.Physiological roles of aquaporin-4 in brain[J].Physiological Reviews,2013,93(4):1543-1562.
[6] Xu M,Su W,Xu Q P,et al.Aquaporin-4 and traumatic brain edema[J].Chin J Traumatol,2010,13:103-108.
[7] Liao C W,Fan C K,Kao T C,et al.Brain injury-associated biomarkers of TGF-beta1,S100B,GFAP,NF-L,tTG,AbetaPP,and tau were concomitantly enhanced and the UPS was impaired during acute brain injury caused by Toxocara canis in mice[J].BMC Infectious Diseases,2008,8(1):84-98.
[8]周良輔.现代神经外科学(第二版)[M].上海:复旦大学出版社,2015:1151-1161.
[9] Tradtrantip L,Tajima M,Li L,et al.Aquaporin water channels in transepithelial fluid transport[J].The Journal of Medical Investigation:JMI,2009,56(Suppl):179-187.
[10] Francesca B,Rezzani R.Aquaporin and blood brain barrier[J].Current Neuropharmacology,2010,8(2):92-96.
[11]丁创,龙江.脑室-腹腔分流术失败原因及其预防的研究进展[J].中国临床神经外科杂志,2018,23(10):698-700.
[12]韩国祥,梁旭光.重度颅脑损伤颅骨减压术后脑积水的研究进展[J/OL].中华神经创伤外科电子杂志,2019,5(6):377-379.
[13]百涛,王任直,魏俊吉,等.特发性正常压力脑积水的外科治疗进展[J].基础医学与临床,2016,36(8):1164-1167.
[14] Robert A.Differential water permeability and regulation of three aquaporin-4 isoforms[J].Cell Mol Life Sci,2010,67:829-840.
[15] Bigio M R D,Curzio D L D.Nonsurgical therapy for hydrocephalus: a comprehensive and critical review[J].Fluids & Barriers of the Cns,2015,13(1):1-20.
[16] Hiroko I K.Neuroimmunological Implications of AQP4 in Astrocytes[J].International Journal of Molecular Sciences,2016,17(8):1306-1322.
[17] Eide P K,Eidsvaag V A,Nagelhus E A,et al.Cortical astrogliosis and increased perivascular aquaporin-4 in idiopathic intracranial hypertension[J].Brain Res,2016,1644:161-175.
[18] Mao X,Enno T L,Bigio M R D,et al.Aquaporin 4 changes in rat brain with severe hydrocephalus[J].European Journal of Neuroscience,2006,23(11):2929-2936.
[19] Guo J,Mi X,Zhan R,et al.Aquaporin 4 Silencing Aggravates Hydrocephalus Induced by Injection of Autologous Blood in Rats[J].Medical Science Monitor International Medical Journal of Experimental & Clinical Research,2018,24:4204-4212.
[20] Schmidt M J,Rummel C,Hauer J,et al.Increased CSF aquaporin-4,and interleukin-6 levels in dogs with idiopathic communicating internal hydrocephalus and a decrease after ventriculo-peritoneal shunting[J].Fluids Barriers CNS,2016,13(12):1-11.
[21] Leandro Casta?eyra-Ruiz,Ibrahim González-Marrero,Juan M González-Toledo,et al.Aquaporin-4 expression in the cerebrospinal fluid in congenital human hydrocephalus[J].Fluids and Barriers of the CNS,2013,10(18):1-5.
[22] Oku H,Morishita S,Horie T,et al.Nitric Oxide Increases the Expression of Aquaporin-4 Protein in Rat Optic Nerve Astrocytes through the Cyclic Guanosine Monophosphate/Protein Kinase G Pathway[J].Ophthalmic Research,2015,54(4):212-221.
[23] Eide P K,Hansson H A.Astrogliosis and impaired aquaporin-4 and dystrophin systems in idiopathic normal pressure hydrocephalus[J].Neuropathology & Applied Neurobiology,2018,44:474-490.
[24] Gu F,Hata R,Toku K,et al.Testosterone up-regulates aquaporin-4 expression in cultured astrocytes[J].Journal of Neuroscience Research,2003,72(6):709-715.
[25] Ishrat T,Sayeed I,Atif F,et al.Effects of progesterone administration on infarct volume and functional deficits following permanent focal cerebral ischemia in rats[J].Brain Research,2009,1257:94-101.
(收稿日期:2020-04-08) (本文編辑:郎序莹)

