GC-MS法测定山茶油中脂肪酸组成
郑娟梅,王 警,陈宁周,莫紫梅,王海波
(广西-东盟食品药品安全检验检测中心,广西 南宁 530021)
山茶油又名野山茶油、茶籽油等,为山茶科山茶属油茶树的种子压榨而得的植物油。茶籽的含油率约为干重的25%~35%。山茶油中油酸和亚油酸含量高达80%,其脂肪酸的组成和比例与橄榄油相近,有“东方橄榄油”之美称[1]。我国是世界上最大的山茶油生产基地,其主要分布在广西、江西、湖南。
气相色谱法(GC)、拉曼光谱法、高效液相-质谱法(HPLC-MS)、超高效液相色谱-蒸发光散射检测法(UPLC-ELSD)等是脂肪酸类成分定性、定量检测常用的分析方法,但这些方法存在一定局限性,对于成分复杂、存在多种同分异构体、含量较低的脂肪酸,其分析效能不能令人满意。本研究建立54种脂肪酸的GC-MS定性定量分析方法,以期能对一些脂肪酸的同分异构体进行识别,并考察山茶油中脂肪酸的成分及含量,为山茶油的加工企业提供参考。
1 材料与方法
1.1 试剂与材料
54种脂肪酸甲酯标准品,纯度≥99.0%,购自BePure公司;甲醇、正庚烷,色谱纯,默克股份有限公司;异辛烷、正己烷、乙醚、无水硫酸钠、硫酸氢钠、氢氧化钾,AR,国药集团化学试剂公司;所有试剂除标注外,均为分析纯。
山茶油:购于广西巴马长寿之都健康食品有限公司。
1.2 仪器与设备
GCMS-TQ8040气相色谱三重四级杆质谱联用仪,日本岛津公司;S300H型超声清洗仪,德国Elmasonic公司;电子分析天平,德国赛多利斯公司;高速离心机,德国Sartorius公司;Milli-Q超纯水机,美国Milli-pore公司。
1.3 方法
1.3.1溶液的配制
分别精密称取54个标准品50.00 mg置10 ml容量瓶中,用正庚烷定容至刻度,其浓度为5.00 mg/ml,作为标准储备液,密封后置于-10℃以下冰箱,有效期3个月。
1.3.2样品前处理
精密称取样品100 mg 于25 ml 比色管中,加入5 ml正己烷溶解试样,振摇2 min,试样溶解后加入0.5 mol/L KOH-甲醇溶液0.5 ml,摇匀,40℃超声波处理20 min;加5 ml纯水于比色管中,反复摇匀;转移至离心管中,在25℃下10 000 r/min 离心3 min;吸取上层脂肪酸甲脂,加入2.0 g无水硫酸钠干燥,振摇混匀静置,取上清液过0.22 μm有机相滤膜,置于进样小瓶中进行GC-MS分析[2]。
1.3.3分析条件
色谱条件:色谱柱,TR-FAME(100 m×0.25 mm×0.2 μm);载气,氦气(99.999%);流速,1.0 ml/min;进样量,1.0 μl,分流比,10∶1;进样口温度,250℃;程序升温,80℃保持2 min,以30℃/min速率升温至140℃,保持1 min,以2℃/min速率升温至240℃,保持5 min。
质谱条件:EI电离方式;采集方式,Q3 Scan;质量扫描范围m/z为40~450;离子源温度:220℃;接口温度:250℃;溶剂延迟:5.5 min。获得的质谱数据通过 NIST 14 质谱图库进行检索,根据保留时间来确定各组分种类,并采用面积归一化法计算各组分含量。
2 结果与讨论
2.1 样品前处理的优化
2.1.1甲酯化方法的选择
脂肪酸甲酯化常用方法有如下几种:硫酸-甲醇法、KOH-甲醇法、三氟化硼-甲醇法等,其各有优缺点,适用范围和测定结果各不同。硫酸-甲醇法一般用于游离型和甘油三酯型脂肪酸;KOH-甲醇法一般适用于甘油三酯型;三氟化硼-甲醇法与前2种方法相比步骤繁琐,操作复杂,而且溶液毒性较强,易于挥发,因此本研究不选择此法。当采用KOH-甲醇法时,检测出山茶油中含有11种脂肪酸,各组分能很好的分离。当采用硫酸-甲醇法时,检测出山茶油中含有9种脂肪酸,有可能是脂肪酸在酸性条件下与甲醇发生了酯化反应,但体系中有水的存在抑制其反应进一步发生的可能[3]。结果表明,样品在碱性条件下萃取,经甲酯化处理后,能有效的减少长碳链脂肪酸在高温下的裂解的情况[4],为了检测山茶油中更多种脂肪酸的种类,我们选择KOH-甲醇法对山茶油进行甲酯化。
2.1.2甲酯化催化剂浓度的选择
精密称取样品100 mg于25 ml比色管中,加入5 ml正己烷溶解试样,振摇2 min,试样溶解后分别加入0.2、0.5、0.8、1.0、2.0和4.0 mol/L KOH-甲醇溶液,后续操作按1.3.2进行,结果见图1。
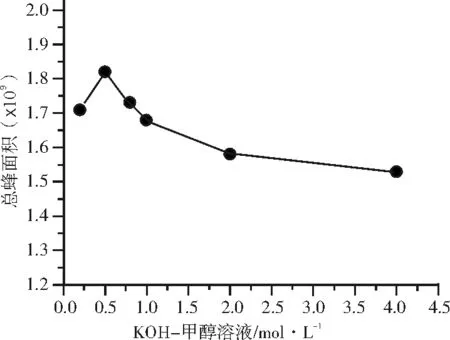
图1 KOH-甲醇溶液浓度对甲酯化的影响
由图1可知,随着KOH-甲醇溶液浓度的增加,总峰面积先增后减,当KOH-甲醇溶液浓度为0.5 mol/L时总面积最大。这是因为KOH-甲醇溶液浓度低于0.5 mol/L时,脂肪酸未完全甲酯化;当KOH-甲醇溶液浓度高于0.5 mol/L时,会引起脂肪酸甲酯皂化。故选用0.5 mol/L的KOH-甲醇溶液作为甲酯化催化剂。
2.1.3甲酯化温度的选择
精密称取样品100 mg 于25 ml比色管中,加入5 ml正己烷溶解试样,振摇2 min,试样溶解后加入0.5 mol/L KOH-甲醇溶液0.5 ml,摇匀,超声温度依次为20、30、40、50、60℃,超声波处理20 min,后续操作按1.3.2进行,结果见图2。

图2 超声温度对甲酯化的影响
由图2可知,超声温度为40℃时,脂肪酸总峰面积达到最大,且分离效果最好。这是因为当温度低于40℃时,脂肪酸甲酯化不完全,当温度高于40℃时,脂肪酸甲酯化会发生皂化等副反应,造成总峰面积的减少[5],故选用40℃作为甲酯化的超声温度。
2.1.4甲酯化时间的选择
精密称取样品100 mg 于25 ml比色管中,加入5 ml正己烷溶解试样,振摇2 min,试样溶解后加入0.5 mol/L KOH-甲醇溶液0.5 ml,摇匀,40℃超声处理时间分别为10、20、30、40 、50 min,后续操作按1.3.2进行,结果见图3。

图3 超声时间对甲酯化的影响
由图3可知,当超声时间为20 min时,脂肪酸总峰面积达到最大,超声时间超过20 min后,皂化等副反应的发生,破坏了这种平衡,则脂肪酸总峰面积减少,故选用超声甲酯化的时间为20 min。
2.2 GC-MS条件优化
2.2.1色谱柱的选择
本研究为了获得最大的峰容量与分离度,对GC-MS中的色谱柱进行选择,因要考虑54种脂肪酸都能达到很好的分离效果,故我们选择了CP-Sil 88(50 m×0.25 mm×0.2 μm)、CP-Sil 88(100 m×0.25 mm×0.2 μm)和TR-FAME(100 m×0.25 mm×0.2 μm)3根柱子进行探讨。柱长度增加一倍,分离度提高一倍以上,碳链越短,出峰越快;饱和脂肪酸甲酯先出峰,不饱和脂肪酸甲酯后出峰;反式先出峰,顺式后出峰,故选择柱长为100 m的色谱柱。CP-Sil 88的固定相为100%二氰丙基-聚硅氧烷,最高温度可达到240℃;而TR-FAME极性固定相为70% 氰丙基聚硅亚苯基硅氧烷,与其他色谱柱相比,能耐受更高的操作温度,最高温度可达到260℃,且流失低,适用于 GC-MS分析脂肪酸甲酯,包括顺式和反式异构体。所以本研究选用TR-FAME(100 m×0.25 mm×0.2 μm)色谱柱进行分析。
2.2.2升温程序的优化
选择合适的柱温是实现各种脂肪酸良好分离的关键[6]。因为54种脂肪酸的相对分子质量、熔点和沸点分布范围较广,所以很难用简单的升温程序得到最佳分离效果。在确保54种脂肪酸具有很好的分离度的前提下,通过不断调节色谱柱的升温程序,发现多阶升温程序对54种脂肪酸有很好的分离效果。最终确定的升温程序为:80℃保持2 min,以30℃/min 速率升温至140℃,保持1 min;以2℃/min速率升温至240℃,保持5 min;离子源温度:220℃;接口温度:250℃;溶剂延迟:5.5 min。
2.2.3定性分析
将54种脂肪酸标准品混合,将全扫描二维谱图中各峰点质谱图导入NIST谱库进行检索而实现定性分析,对于谱图无法识别、相近的同分异构体则采用单一标准品进样的方式来进行判定。结果表明,54种脂肪酸都得到了较好的分离,在二维色谱上出现重组的现象(见表1、图4)。考虑到脂肪酸同分异构体的响应值相近,可用面积归一化法测定各脂肪酸的相对含量。

表1 54种脂肪酸的保留时间、分子量、定量离子和定性离子
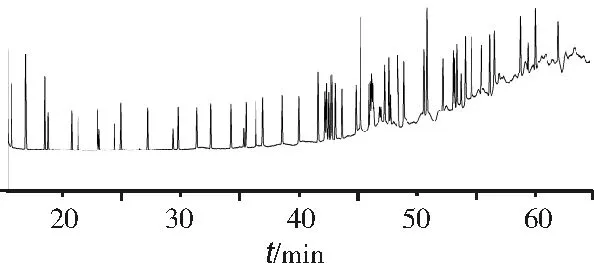
图4 54种脂肪酸甲酯的质谱图
2.3 山茶油脂肪酸组成的测定
山茶油中脂肪酸的定性是采取标准品的保留时间并结合质谱进行的。山茶油中脂肪酸甲酯化合物名称及含量见表2,其图谱见图5。
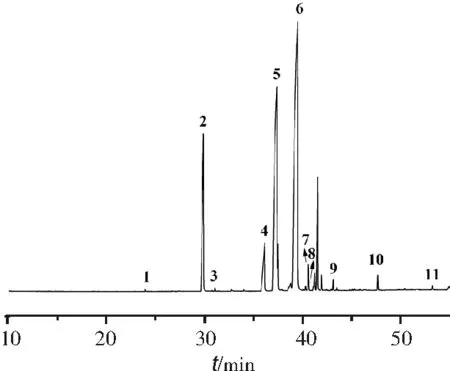
1.十四烷酸甲酯;2.十六烷酸甲酯;3.(Z)-9-十六烯酸甲酯(棕榈油酸甲酯);4.硬脂酸甲酯;5.(Z)-9-十八烯酸甲酯;6.(Z,Z)-9,12-十八烯二烯酸甲酯;7.亚麻酸甲酯;8.二十烷酸甲酯;9.11-二十碳烯酸甲酯;10.二十二烷酸甲酯;11.二十四烷酸甲酯
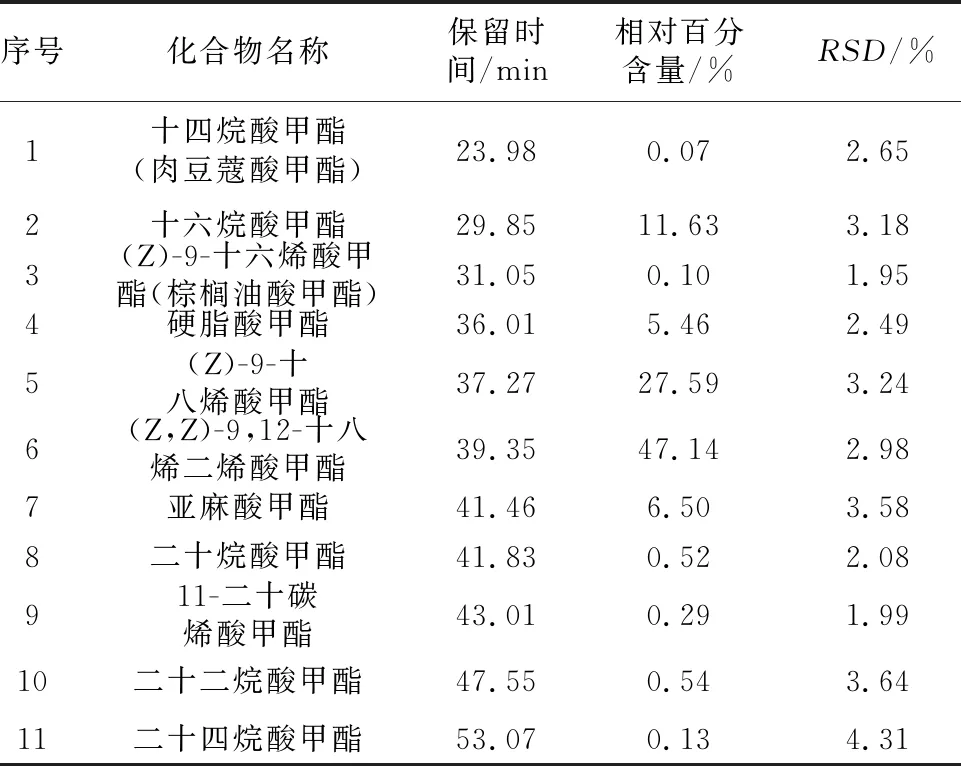
表2 山茶油中脂肪酸甲酯化合物名称及含量(n=3)
利用建立好的54种脂肪酸甲酯的GC-MS方法,按照1.3.2将山茶油样品进行甲酯化,再按照1.3.3色谱-质谱条件进行测定,利用面积归一化法计算其含量及相对标准误,结果见表2。本研究的山茶油中约含有11种脂肪酸,其中不饱和脂肪酸占81.62%,亚油酸甲酯、反-9-十八烯酸甲酯、反9,12-十八烯二烯酸甲酯的比例较高;饱和脂肪酸占18.38%,其中十六碳酸甲酯、硬脂酸甲酯、二十二碳酸甲酯占的比例较高。
3 结论
我们建立了54种脂肪酸的GC-MS定性定量分析方法,实现了对食品中复杂基质中脂肪酸的检测。与传统的GC法相比,本方法能同时测定54种脂肪酸,并且解决了顺反式脂肪酸的测定,可简便、有效、快速开展大量油脂中脂肪酸的检测提供参考。

