肌动蛋白调节剂在胰腺癌细胞中的表观遗传学作用
杨亚利,容雄飞,朱国松,孟凡民,张加强
(河南省人民医院 郑州大学人民医院 麻醉与围手术期医学科,河南 郑州450003)
胰腺癌是一种发病率和死亡率较高且预后较差的恶性肿瘤[1],预计在未来几年内将成为癌症相关死亡的主要原因[2],放射治疗和手术被认为是早期和局部晚期的标准治疗方法[3],但由于其起病隐匿的特点,往往仅有20%的患者可行手术治疗[4]。ENAH是VAPS蛋白家族成员之一,参与细胞粘附和运动所需的肌动蛋白丝组装。最近的研究表明,ENAH在胃癌、肝癌、乳腺癌黑色素瘤等多种癌症中过表达,并且ENAH与肿瘤分级及血管浸润性相关[5]。ENAH在胰腺癌中的表达尚不清楚,本研究旨在探讨ENAH对胰腺癌细胞的影响,并就其调控机制进行进一步的研究。
1 材料与方法
1 材料人正常胰腺导管上皮细胞(HPDE6c7)、胰腺癌细胞(SWl990、CFPAC-1、PANC-1)均购自中国科学院上海细胞库。DMEM培养基、MEM培养基、胎牛血清均购自于以色列BI公司;qRT-PCR试剂盒购自赛默飞世尔科技有限公司;细胞凋亡试剂盒购自上海翊圣生物科技有限公司;小干扰RNA(siRNA)购自锐博生物科技有限公司;引物由擎科生物有限公司设计合成。ENAH、GAPDH一抗购自于Abcam抗体公司;BCA蛋白浓度试剂盒购自于索莱宝生物科技有限公司。
1.2 细胞培养及转染HPDE6c7、SWl990、CFPAC-1胰腺癌细胞株用含有12%胎牛血清的DMEM培养基培养,PANC-1用含有10%胎牛血清的MEM培养基培养,细胞均置于条件为37℃、含5%CO2的恒温培养箱中培养。细胞生长密度为30%-50%时,按转染试剂盒说明进行细胞转染。siRNA转染的SW1990、CFPAC-1、PANC-1作为实验组,以转染阴性对照(NC)的SW1990、CFPAC-1、PANC-1作为对照组,培养24 h后进行后续实验。
1.3 qRT-PCRTrizol试剂提取细胞总RNA,使用逆转录试剂盒将总RNA逆转录为cDNA。qPCR反应条件为:95℃ 30 s,95℃ 5 S、60℃ 34 S,40个循环,将表达量相对于GAPDH表达标准化,2-ΔΔCT法计算ENAH的相对表达量。ENAH引物序列:F:5’-TTGGTGAGGAGACACATTTGA-3’,R:5’-TGTGGCAGACATTCTTACACAATC-3’;GAPDH序列:F:5’-GTG GAC ACC GCA AAG AC-3’,R:5’-AAG TGT AAC GCA ACT A-3’。
1.4 Western blot使用RIPA裂解液裂解细胞,从细胞中提取总蛋白质。BCA方法测定蛋白质浓度。蛋白质样品通过SDS-PAGE电泳90 min,后转移到PVDF膜上。将膜用10%脱脂牛奶封闭30 min,TBST清洗,孵一抗过夜,第二天孵二抗2 h后TBST清洗,使用ECL发光液测量蛋白质表达。
1.5 平板克隆实验取转染后的胰腺癌细胞以1×103/孔的密度接种于6孔板中,置于条件为37℃、含5%CO2的恒温培养箱中培养,定期检测培养基PH值,及时更换培养基。10-14天以后PBS缓冲液清洗细胞,4%多聚甲醛固定15 min,结晶紫染色30 min后,置于无影灯下观察实验组与对照组细胞集落形成结果并拍照。
1.6 流式细胞术取转染后的胰腺癌细胞以1×105/ml的密度接种于六孔板中,置于条件为37℃、含5%CO2的恒温培养箱中培养24 h,按细胞凋亡检测试剂盒说明加入转染后的实验组与对照组胰腺癌细胞中,流式细胞仪检测SW1990、CFPAC-1、PANC-1细胞的凋亡率。
1.7 统计学方法应用SPSS 22.0统计软件分析,计量资料结果均以均值±标准差(Mean±SD)表示,t检验确定各组间的差异是否显著。各项实验重复三次,以P<0.05为差异有统计学意义。
2 结果
2.1 ENAH在胰腺癌细胞株中高表达SW1990、CFPAC-1、PANC-1三株胰腺癌细胞中的表达量(3.92±0.82;4.28±0.36;4.08±0.56)较人正常胰腺导管上皮细胞株的表达量(1.26±0.36)明显增高,差异有统计学意义(P<0.01)(图1)。

图1 ENAH在SW1990、CFPAC-1、PANC-1细胞株表达明显高于正常HPDE6c-7细胞
2.2 平板克隆实验检测SW1990、CFPAC-1、PANC-1三株胰腺癌细胞在培养14天以后集落形成数量实验组均明显低于各自对照组,差异有统计学意义,P值均<0.05(见表1)。集落形成实验证明降低ENAH表达抑制了SW1990、CFPAC-1、PANC-1的细胞增殖能力。

表1 转染ENAH siRNA后SW1990、CFPAC-1、PANC-1细胞14天后集落形成数量实验组较对照组明显减少
2.3 流式细胞术凋亡检测转染后的胰腺癌细胞加入凋亡检测试剂后,流式细胞仪显示,在3株胰腺癌细胞中,实验组细胞凋亡率较对照组细胞凋亡率明显增高(P<0.01),差异有统计学意义(见表2)。

表2 转染ENAH siRNA后SW1990、CFPAC-1、PANC-1细胞凋亡率实验组较对照组明显升高
2.4 选取SW1990细胞进行通路蛋白验证蛋白印迹法显示降低ENAH表达后,p-Erk、p-AKT和p-p65通路蛋白表达明显下调,ImageJ软件定量分析蛋白表达情况,相对于内参表达量(见表3)。
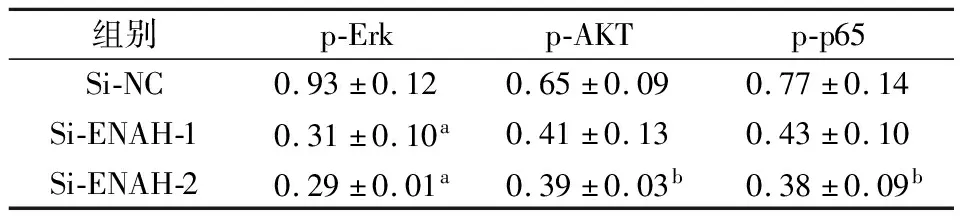
表3 siRNA转染SW1990细胞株中通路蛋白表达情况
3 讨论
ENAH通过控制肌动蛋白丝网络在细胞运动中起重要作用[6],如前所述,在多种恶性肿瘤中表达上调。有研究表明在乳腺癌中,ENAH过表达与肿瘤大小,TNM分期有关,ENAH在肝细胞肝癌中表达上调,并且其过表达与肿瘤预后明显相关,这说明 ENAH可能是HCC的潜在预后生物标志物[7,8]。目前胰腺癌的治疗方法有限,且效果不佳。因此寻找胰腺癌新的治疗靶点至关重要。
本研究,我们从mRNA水平证明了ENAH在SW1990、CFPAC-1、PANC-1胰腺癌细胞株中过表达,平板克隆实验中siRNA转染后胰腺癌细胞的增殖较对照组明显下降,检测细胞凋亡率发现转染后的胰腺癌细胞凋亡率较对照组却明显上升。这说明ENAH的表达促进胰腺癌细胞的增殖并抑制胰腺癌细胞的凋亡从而促进细胞生长。目前ENAH已被证明是Wnt/β-catenin途径的转录靶点,并且是Wnt/β-catenin和Notch信号级联反应的新纽带[9]。此外,ENAH与Wnt/β-catenin途径的可能联系在大肠癌,乳腺癌和肝细胞癌细胞系中也有实验证明[10]。为了探索ENAH在胰腺癌中促进细胞增殖的分子机制,我们通过KEGG分析得出MAPK、AKT通路与ENAH的增殖密切相关,陈迪等人得出ENAH在胃癌中ENAH通过MAPK、AKT通路促进胃癌细胞的增殖和转移[11]。我们通过敲低ENAH表达的SW1990胰腺癌细胞株验证了MAPK、AKT通路上相关蛋白的表达,发现了磷酸化的Erk、AKT蛋白明显降低,这就说明ENAH在胰腺癌中ENAH通过MAPK、AKT通路也可促进胰腺癌细胞的增殖。以上结果表明,ENAH在胰腺癌的增殖中具有重要的调节作用,并通过MAPK、AKT通路影响胰腺癌细胞的增殖。
此外,我们的研究还发现降低ENAH表达促进了胰腺癌细胞的凋亡,但具体的机制尚有待进一步研究。ENAH有望成为胰腺癌新的生物学标志物,为胰腺癌患者的诊疗提供新的靶点。

