肺癌患者化学治疗期间营养不良发生情况及相关影响因素分析
吴 琼,高美玲
肺癌是最常见的恶性肿瘤,发病率及病死率均居我国恶性肿瘤第一位[1]。世界卫生组织数据显示,全球每年有超过160万人被诊断为肺癌,其中我国新发病例占全球总新发病例22%[1-2]。肺癌恶性程度高,侵袭性强,病情进展迅速,早期可无明显临床表现,多数患者确诊时已属中晚期,失去手术治疗机会[3]。无法手术治疗肺癌患者行化学治疗或肺癌患者手术后辅助化学治疗是以往文献报道肺癌的常用治疗方法,化学治疗对肺癌患者肺组织局部病灶及循环系统中微转移灶均具有抑制作用,可延长患者生存期,提高生活质量[4]。由于化学治疗药物常导致胃肠道不良反应及肝脏损伤,以及肿瘤过度消耗,使肺癌患者营养摄入不够,吸收不足,且代谢增多,易出现营养不良[5]。营养不良不仅会降低肺癌患者化学治疗效果,增加不良反应发生率,还可升高肺癌患者病死率,影响其中远期预后[6]。有国外研究显示,40%~80%的恶性肿瘤患者可发生营养不良,其中50%患者需进行营养支持治疗[7]。目前,我国相关文献对肿瘤患者化学治疗期间的营养状况报道较少。本研究探讨肺癌患者化学治疗期间营养不良发生情况,并进一步分析营养不良发生相关影响因素,旨在帮助肺癌患者制订合理营养干预方案,现报告如下。
1 资料与方法
1.1一般资料 采用便利抽样法选取2016年9月—2019年9月在哈尔滨医科大学附属第一医院肿瘤科诊治的符合纳入及排除标准的行化学治疗的肺癌560例,其中男360例,女200例;年龄(56.23±9.58)岁;病理分型为小细胞肺癌60例,非小细胞肺癌500例。本研究经医院医学伦理委员会批准同意执行,患者和(或)其家属对本研究知情同意并签署知情同意书。
1.2纳入及排除标准 纳入标准:①所有入选患者均经组织病理学检查确诊原发性肺癌;②皆接受规范化化学治疗(采用TP方案,即紫杉醇135 mg/m2,静脉滴注,第1天;顺铂75 mg/m2,静脉滴注,第1天,每3周为一个周期,至少完成3个周期);③年龄≥18周岁;④Karnofsky功能状态评分标准[8]评分≥70分,预计生存期≥6个月;⑤意识清晰。排除标准:①合并其他肿瘤者;②无化学治疗适应证或对化学治疗药物过敏者;③本研究开始前已发生营养不良者;④出现腹腔或脑转移者;⑤肝脏、心脏及肾脏等重要脏器严重功能障碍者;⑥有消化系统疾病史者。
1.3方法
1.3.1调查前准备:正式进行问卷调查前,由肿瘤科主任医师、流行病学专家对工作人员进行专业化培训,对调查方法、需注意细节进行详细说明,培训合格后方可参加调查。在对患者进行调查时,首先说明本研究组织单位、研究目的,数据均用于科学研究,承诺不用于商业用途,不泄露患者隐私,请患者放心、真实回答问题,配合本研究。在取得患者同意后才可对患者进行问卷调查。问卷调查时,由调查小组人员按照自行设计好的调查问卷进行依次询问,并认真填写。若患者有听力障碍或表达不清楚时,请家属协助其完成问卷调查。在进行问卷调查时,若发现患者回答有矛盾及模糊不清时,重新核实并确认相应结果,调查结束后仔细检查有无漏项,如存在漏项,及时对患者进行询问,并认真填写,以确保问卷信息的完整。本研究发放560份调查问卷,经核实均为有效问卷,问卷有效率为100%。
1.3.2资料收集:采用自行设计的调查问卷,包括一般资料(性别、年龄、体质量指数、文化程度、婚姻状况、家庭月收入、医疗费用支付方式、合并疾病、吸烟史、饮酒史、心理状态评估、有无肠外营养支持、是否手术治疗、是否同步放射治疗、病理分型及TNM分期)、营养摄入情况及化学治疗不良反应。心理状态评估采用汉密顿抑郁量表[9],该量表总分为68分,≥8分为抑郁,得分越高表示抑郁程度越严重。采用24 h膳食回顾法评估化学治疗期间肺癌患者营养摄入情况,包括碳水化合物及蛋白质、微量元素、维生素等,具体计算方法参照文献[10]。化学治疗不良反应评估依据NCI分级标准[11],包括恶心、呕吐及腹泻,每种不良反应分为Ⅰ、Ⅱ、Ⅲ、Ⅳ级。
1.3.3营养状况评估:化学治疗3个周期时,对所有入选患者营养状况进行评估,采用患者主观整体评估(scored patient-generated subjective global assessment, PG-SGA)量表[12-13],该量表包括患者自我评估及医务人员评估两部分,前者包括临床症状和体征、膳食摄入、近期体质量变化及活动和身体功能,后者包括体格检查、代谢应激状态及疾病与营养需求关系,总分越高提示营养状况越不好,其中PG-SGA量表评分<4分为非营养不良,≥4分为营养不良。

2 结果
2.1营养不良发生情况 PG-SGA量表评分结果显示,560例肺癌中314例(56.07%)营养不良(营养不良组),246例(43.93%)非营养不良(非营养不良组)。
2.2一般资料比较 两组年龄、体质量指数、文化程度、家庭月收入、是否抑郁、有无肠外营养支持及TNM分期比较差异有统计学意义(P<0.01);性别、婚姻状况、医疗费用支付方式、有无高血压病、有无糖尿病、有无吸烟史、有无饮酒史、是否手术治疗、是否同步放射治疗及病理分型比较差异无统计学意义(P>0.05),见表1。
2.3营养摄入情况比较 营养不良组摄入蛋白质、脂肪及维生素C低于非营养不良组,差异有统计学意义(P<0.01);两组摄入碳水化合物、总能量、钙、铁、锌、硒、维生素A、维生素D及维生素E比较差异无统计学意义(P>0.05),见表2。

表2 化学治疗期间营养不良与非营养不良肺癌两组营养摄入情况比较
2.4化学治疗不良反应比较 两组呕吐及腹泻发生情况比较差异有统计学意义(P<0.05或P<0.01);恶心发生情况比较差异无统计学意义(P>0.05),见表3。
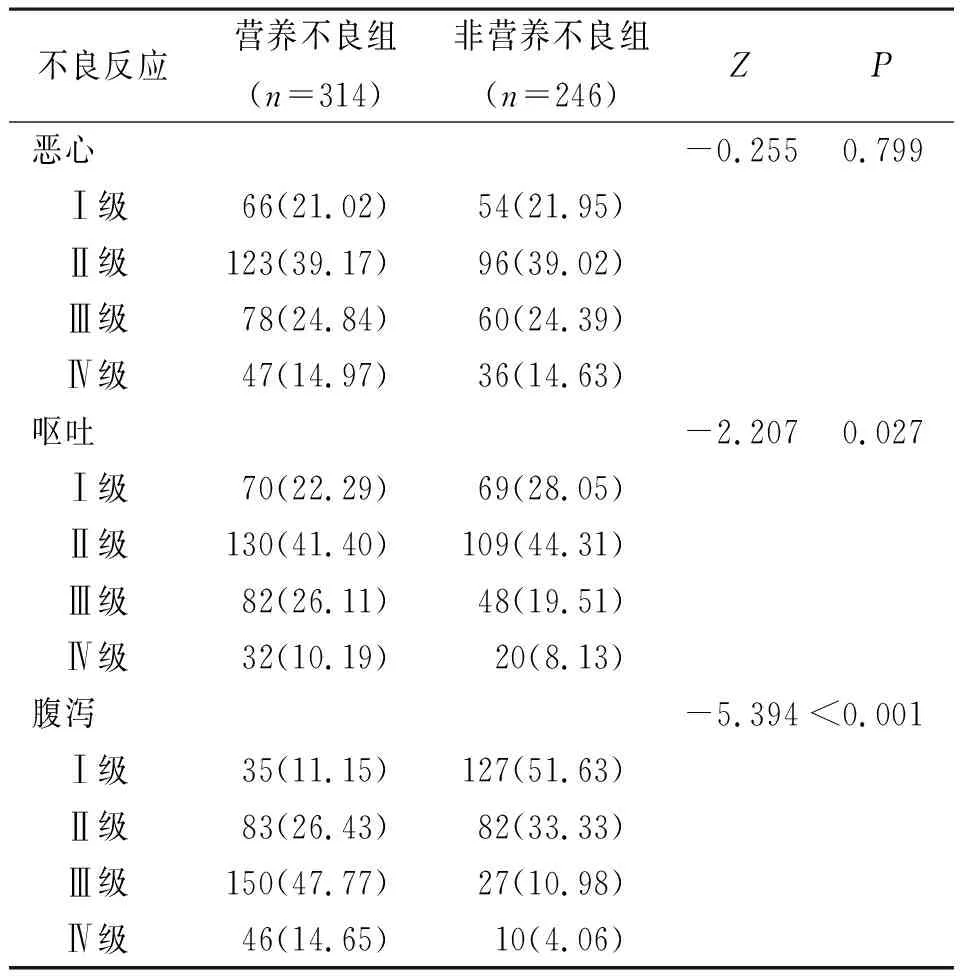
表3 化学治疗期间营养不良与非营养不良肺癌两组不良反应比较[例(%)]
2.5肺癌患者化学治疗期间营养不良发生相关影响因素多因素Logistic回归分析 以年龄、体质量指数、文化程度及家庭月收入等单因素分析差异有统计学意义的指标为自变量,以是否营养不良为因变量进行多因素Logistic回归分析,结果显示年龄≥60岁、家庭月收入<5000元、抑郁、TNM分期Ⅲ和Ⅳ期及呕吐Ⅲ和Ⅳ级是肺癌患者化学治疗期间营养不良发生的危险因素,肠外营养支持及摄入蛋白质是肺癌患者化学治疗期间营养不良发生的保护因素(P<0.05或P<0.01),见表4。

表4 肺癌患者化学治疗期间营养不良发生相关影响因素多因素Logistic回归分析结果
3 讨 论
中国肿瘤流行病学数据报道显示,2015年共新发恶性肿瘤392.9万例,其中肺癌为73.3万例,占所有恶性肿瘤的18.66%[14]。近年来,随着我国人口老龄化的加剧,环境污染的加重,肺癌患病率呈逐年增加趋势。规范化化学治疗是肺癌,特别是中晚期肺癌的主要治疗方案,可提高患者1、3和5年生存率[15]。目前,化学治疗方案多以铂类为主,联合吉西他滨或紫杉醇等药物。营养不良是恶性肿瘤化学治疗期间常见并发症,分析原因如下[5]:①肿瘤代谢旺盛,营养需求较多,可引起碳水化合物、蛋白质、脂肪及微量元素代谢异常;②肿瘤引起的疼痛使患者食欲降低,特别是肺癌可引起食管病变或压迫食管,导致进食减少;③化学治疗引起的恶心、呕吐和腹泻可导致胃肠道吸收营养物质减少;④焦虑和抑郁等精神障碍可使患者进食减少。毛玲红等[16]对采用化学治疗的肺癌112例进行研究显示,84例有营养不良风险,营养不良风险率为75.00%。随意等[17]对中晚期肺癌237例化学治疗期间营养状况进行评估,结果显示营养不良发生率为95.78%。本研究对采用化学治疗的肺癌560例进行评估显示,营养不良发生率为56.07%,与蒋莎莎等[18]的文献报道结果相近,低于随意等[17]的文献报道结果,分析原因可能与本研究对象TNM分期Ⅰ和Ⅱ期患者较多,临床症状较轻,尚未导致营养不良有关。
年龄是导致肺癌患者化学治疗期间营养不良的重要原因。本研究结果显示,营养不良组年龄较非营养不良组大;多因素Logistic回归分析结果显示,年龄≥60岁是肺癌患者化学治疗期间营养不良的危险因素,与以往文献[16]报道结果一致。分析其原因可能与老年患者胃肠功能减弱,消化吸收能力差,摄取营养较少;且部分老年患者肝、肾功能降低,对化学治疗药物耐受能力差,呕吐及腹泻等不良反应严重,营养物质吸收少有关[19]。经济条件也是影响肺癌患者化学治疗期间营养不良发生的一个因素。蒋莎莎等[18]研究显示,化学治疗期间营养不良的风险家庭月收入<3000元的肺癌患者是家庭月收入3000~5000元肺癌患者的2.67倍。本研究多因素Logistic回归分析结果显示,家庭月收入<5000元是肺癌患者化学治疗期间营养不良发生的危险因素。分析其原因可能与经济条件较差者膳食较差,不注意营养补充有关。
由于肿瘤代谢需要大量营养支持,其细胞增殖需消耗大量蛋白,故摄入蛋白质有助于肺癌患者自身蛋白质的补充,减少营养不良。另外,由于肺癌患者胃肠吸收功能差,肠外营养支持可直接补充机体营养物质,缓解蛋白质、脂质及维生素消耗。本研究多因素Logistic回归分析结果显示,肠外营养支持及摄入蛋白质是肺癌患者化学治疗期间营养不良发生的保护因素,与文献[16,18]报道相符。提示肺癌患者化学治疗期间应加强营养的补充。肿瘤临床分期及化学治疗不良反应分级与肺癌患者化学治疗期间营养不良发生也有密切关系。Deans等[20]研究认为,肿瘤临床分期与患者体质量指数呈明显负相关,TNM分期Ⅲ和Ⅳ期者体质量指数较低比例高于TNM分期Ⅰ和Ⅱ期者,提示肿瘤进展可导致较多营养物质消耗。商红等[21]研究显示,TNM分期较高的肺癌患者放射治疗期间发生营养不良的风险是TNM分期较低的2.259倍。本研究多因素Logistic回归分析结果显示,TNM分期Ⅲ和Ⅳ期是肺癌患者化学治疗期间营养不良发生的危险因素。分析其原因可能是由于肿瘤高消耗、高代谢状态时使营养物质过度消耗,或通过合成一些细胞因子,加剧营养摄取,甚至导致恶病质。呕吐和腹泻不仅可使营养摄入减少,长期呕吐和腹泻还可引起电解质紊乱,影响机体正常生理功能。本研究多因素Logistic回归分析结果显示,呕吐Ⅲ和Ⅳ级是肺癌患者化学治疗期间营养不良发生的危险因素,与既往研究[16]结果一致。
由于经济压力及肿瘤本身、化学治疗带来的身体不适,加上心理压力的影响,多数肿瘤患者可出现焦虑、恐慌及抑郁。韦新苗[22]对410例肺癌进行调查显示,合并抑郁比例为53.71%。抑郁患者精神萎靡,态度淡漠,对事物失去兴趣,往往摄食减少,且抑郁可导致胃肠功能障碍[23]。另有研究显示,老年住院抑郁患者营养不良及潜在营养不良发生率分别为43.9%和41.2%[24]。万里红等[25]对老年慢性肾病110例进行研究表明,抑郁程度越严重,营养不良发生率越高。本研究结果显示,营养不良组抑郁比例高于非营养不良组;多因素Logistic回归分析结果显示,抑郁是肺癌患者化学治疗期间营养不良发生的危险因素。提示化学治疗期间应加强肺癌患者心理干预。
通过本研究分析,我们认为减少肺癌患者化学治疗期间营养不良发生情况,可采取以下干预措施:①对老年、经济条件较差以及临床分期较高者应加强营养干预,增加蛋白质摄入,必要时进行肠外营养支持;②对化学治疗不良反应较重者应及时进行止吐和止泻干预;③合并精神障碍者应进行心理疏导,加强心理关注。
综上所述,肺癌患者化学治疗期间营养不良发生率较高,年龄≥60岁、家庭月收入<5000元、抑郁、TNM分期Ⅲ和Ⅳ期及呕吐Ⅲ和Ⅳ级是肺癌患者化学治疗期间营养不良发生的危险因素,肠外营养支持及摄入蛋白质是肺癌患者化学治疗期间营养不良发生的保护因素。临床上对具有上述危险因素的行化学治疗的肺癌患者应进行个体化干预,以降低营养不良发生率。当然本研究亦存在不足之处,如未对营养不良严重程度进行分级及未将患者血清学指标纳入多因素分析,可能存在混杂因素,故尚需进行进一步研究对本研究结果进行验证。

