巧用曲线和常数比较粒子浓度大小
贾玉梅
(黑龙江省七台河市第一中学 154600)
在教学工作中,听到越来越多的学生抱怨化学越来越难学,特别是选择题中关于电解质溶液中比较粒子浓度大小的试题.分析近几年的高考试题不难发现这类试题的考查角度多样,形式多变,常常通过坐标曲线给出信息,需要学生结合化学知识挖掘隐含信息得出结论,对学生的能力要求越来越高,是高中化学教学的难点.
一线教师针对这类习题也总结了很多方法,在学生比较熟悉的弱电解质的电离、盐类水解程度小和三大守恒的基础上,本文主要从酸碱中和滴定曲线入手,结合三大常数的关系谈谈比较电解质溶液中粒子浓度大小的方法.
一、巧用酸碱中和滴定曲线
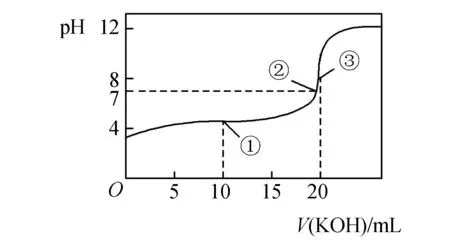
例1以0.100 mol·L-1KOH溶液滴定20.00 mL 0.100 mol·L-1HCOOH溶液为例,其滴定曲线如图所示.
分析解此类习题学生要准确把握以下几个关键点:
1.原点O,原点为HCOOH的单一溶液,由曲线可知0.100mol·L-1HCOOH的pH>1,说明HCOOH是弱酸,结合弱电解质的电离程度小可知c(HCOOH)>c(H+)>c(HCOO-)>c(OH-).
2.点①,根据加入KOH的体积为10 mL可知反应后所得溶液是等物质的量HCOOH和HCOOK的混合溶液,由上图曲线可知溶液pH<7,说明HCOOH电离程度大于HCOO-水解程度,则c(HCOO-)>c(K+)>c(HCOOH)>c(H+)>c(OH-)成立.在此点,要特别关注依据元素守恒可得c(HCOO-)+c(HCOOH)=2c(K+),这一等量关系在解决有关电解质溶液中离子浓度大小关系或等量关系试题中的作用不可小觑.
3.点②,此时溶液pH=7,溶液呈中性,HCOOH没有完全被消耗,根据电荷守恒可知c(HCOO-)=c(K+)>c(H+)=c(OH-).
4.点③,此时两者恰好反应生成HCOOK,为强碱弱酸盐溶液,c(K+)>c(HCOO-)>c(OH-)>c(H+).
5.点③之后,此时KOH过量,溶液显碱性,可能出现c(K+)>c(HCOO-) >c(OH-)>c(H+)或者c(K+)>c(OH-)>c(HCOO-)>c(H+).
二、巧用“三大常数”的关系
例2常温下将KOH溶液滴加到戊二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( ).
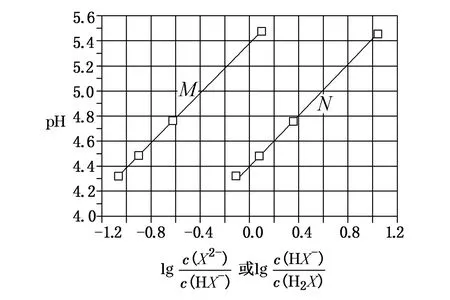
A.KHX溶液中c(H+)>c(OH-)
B.当混合溶液呈中性时,c(K+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
C.Ka1(H2X)的数量级为10-5
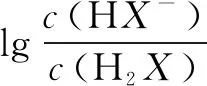

突出学科素养,关注学生综合能力的考查是今后高考的命题趋势,有关电解质溶液的考查更为灵活,图像、数据信息的大量引入对学生的能力要求更高,教师在教学中要指导学生掌握利用图形分析和学科知识相融合解决问题的方法,培养学生的学科思维和提高学生的能力.

