2-氰基-3-三氟甲基-5-异硫氰基吡啶的绿色合成
(上海康鹏科技股份有限公司,上海 200331)
阿帕鲁胺(apalutamide),化学名为4-[7-(6-氰基-5-(三氟甲基)吡啶-3-基)-8-氧代-6-硫代-5,7-二氮杂螺[3-4]辛烷-5-基]-2-氟-N-甲基苯甲酰胺,是由强生公司研发、美国FDA 批准的第一个用于治疗非转移性去势抵抗性前列腺癌药物[1],具有广阔的开发前景。因此,研究其绿色合成工艺具有重要的现实意义。
据文献报道,阿帕鲁胺主要通过中间体2-氰基-3-三氟甲基-5-异硫氰基吡啶和N-甲基-2-氟-4-(1-氰基环丁胺基)苯甲酰胺经环合反应制备得到[2]。而中间体2-氰基-3-三氟甲基-5-异硫氰基吡啶由2-氰基-3-三氟甲基-5-氨基吡啶与硫光气反应得到[3]。2-氰基-3-三氟甲基-5-氨基吡啶的合成路线主要有以下2 条:① 以3-三氟甲基吡啶为原料,经N-氧化、氰化、硝化、还原得到,反应总收率为5.0%[4]。该法中使用了甲基三氧化铼、三甲基氰硅烷等价格昂贵的试剂,成本较高,且使用有毒的硫光气,工业生产中存在安全隐患。② 以2-羟基-3-三氟甲基吡啶为原料,经硝化、溴代、氰化、硝基还原得到,反应总收率为40.3%[5]。该法反应总收率较高、原料易得,但硝化反应有较多的“废酸”产生,且氰化反应使用了毒性较大的氰化亚铜,对环境有较大污染并且存在安全隐患。
为了进一步降低成本,减少对环境的污染,本文在路线②的基础上对硝化、氰化和异硫氰酸酯合成三步反应进行了较大的改进,取得了较好的效果。硝化工艺由“混酸”硝化改为Zn (OTf)2催化下的98%硝酸硝化,提高了反应收率,并减少了“废酸”的排放;氰化工艺将氰化试剂由Cu (CN)2改为K4[Fe (CN)6]·3H2O,避免使用毒性高的Cu (CN)2作为原料,反应收率也有较大的提高;最后一步异硫氰酸酯的制备工艺,采用二硫化碳代替毒性较大的硫光气,减少了对环境的污染并降低了反应的危险性,且得到了外观较好,含量较高的2-氰基-3-三氟甲基-5-异硫氰基吡啶。优化后,6 步反应总收率65.6%,产品液相色谱含量99.1%。该工艺成本较低、操作方便、反应条件温和、绿色环保,具有工业放大的前景。
1 实验部分
1.1 主要仪器与试剂
安捷伦1200 系列液相色谱仪(美国安捷伦公司)、Agilent 1200/6220 液相色谱-质谱联用仪(美国安捷伦公司)、HP6890/5973MSD 型气相-质谱联用仪(美国HP 公司,EI 离子源)、Advance DMX400 型核磁共振仪(TMS 为内标,德国Bruker 公司),MP70熔点仪系统(梅特勒-托利多国际贸易(上海)有限公司),S312-120W 数显电动搅拌器(上海羌强实业发展有限公司)。
三溴氧磷(上海海曲化工有限公司,98.0%),三聚氯氰(TCT,连云港超帆化工有限公司,99%),2-羟基-3-三氟甲基、锌粉、氧化铜、氧化镍、三氧化二铋、氧氯化锆、醋酸钯均购自国药集团化学试剂有限公司化学纯试剂。其他原料均为商业可得的国产工业级产品,未经过处理直接使用。
1.2 合成路线
目标产品的合成路线如图1所示。
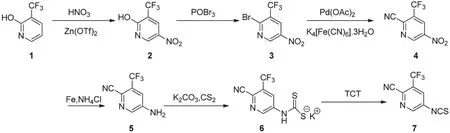
图1 2-氰基-3-三氟甲基-5-异硫氰基吡啶的合成路线Fig.1 Route for synthesis of 2-cyano-3-trifluoromethyl-5-isothiocyanopyridine
1.3 实验方法
1.3.1 2-羟基-3-三氟甲基-5-硝基吡啶(NTFPO)的合成
催化剂三氟甲磺酸盐Zn (OTf)2、Cu (OTf)2、Ni (OTf)2、Bi (OTf)3、Zr (OTf)4参照文献[6]的方法制备。
在装有回流冷凝管的2 L 四口烧瓶中依次加入Zn (OTf)2催化剂54.6 g(0.15 mol)、1,2-二氯乙烷1 223.5 g 、2-羟基-3-三氟甲基吡啶(TFPO) 244.7 g(1.5 mol)。加热至回流,滴加98% 硝酸106.2 g (1.65 mol)。滴加完毕,回流反应4.0 h,液相色谱跟踪至反应结束。降温至室温,加入200.0 g 水,搅拌0.5 h。静置分液,有机相用5%质量分数的碳酸氢钠溶液洗涤,分出的有机相用无水MgSO4干燥,减压脱溶回收溶剂(可回收套用)得到粗产品。粗产品经结晶、干燥后得到白色固体290.1 g,液相色谱含量99.1%,收率92.1%。熔点:157~158 ℃。1H NMR(400 MHz,DMSO-d6)δ:8.47(d,J=2.8 Hz,1H),8.96(d,J=3.2 Hz,1H),13.48(s,1H,OH);GC-MS,m/z(%):209.0[M+H]+。
1.3.2 2-溴-3-三氟甲基-5-硝基吡啶(BNTFP)的合成
装有回流冷凝管和溴化氢吸收装置的2 L 四口瓶中,依次加入2-羟基-3-三氟甲基-5-硝基吡啶231.0(1.1 mol)、1,2-二氯乙烷1 386.0 g 和催化剂DMF 1.0 g,加热至回流,滴加三溴化磷357.3 g(1.32 mol)。滴加完毕,回流反应12 h,液相色谱跟踪至反应结束。将反应液滴加至924.0 g 水中,搅拌0.5 h。静置分液,水相再用1,2-二氯乙烷462.0 g萃取。合并有机相,依次用水(200 g×1) 和饱和氯化钠溶液(200 g×1)洗涤。有机相用无水硫酸钠干燥,过滤,滤液减压回收溶剂(可回收套用)得到粗产品。粗产品经结晶、干燥后得到淡黄色固体277.4 g,液相色谱含量99.2%,收率92.3%。熔点:88.9~89.7 ℃;GC-MS(m/z):269.9[M]+、271.9[M+2]+;1H NMR(400 MHz,DMSO-d6)δ:8.85(d,J=2.0 Hz,1H),8.54(d,J=2.0 Hz,1H)。
1.3.3 2-氰基-3-三氟甲基-5-硝基吡啶(NTFPN)的合成
N2保护下,在2 L 四口瓶中依次加入2-溴-3-三氟甲基-5-硝基吡啶271.0 g(1.0 mo1)、碳酸钾138.3 g(1.0 mo1)、Pd (OAc)20.23 g、N,N-二 甲基乙酰胺1 084.0 g。升温至140℃,再加入74.8 g (0.2 mol)K4[Fe (CN)6]·3H2O。140 ℃保温反应4.0 h,液相色谱跟踪至反应结束。冷却至室温,过滤,滤液减压回收N,N-二甲基乙酰胺(可回收套用)。剩余物加入乙酸乙酯813.0 g 和水135.5 g,搅拌0.5 h,静置分液,有机相减压回收溶剂得到粗产品。粗产品用50%质量分数的乙醇结晶、干燥得到白色固体207.5 g,液相色谱含量99.4%,收率95.0%。熔点:41~42 ℃;1H NMR (400 MHz,CDCl3)δ:8.78(d,J=2.0 Hz,1H),7.91(d,J=2.0 Hz,1H)。LC-MS(m/z):217.0[M]+。
1.3.4 2-氰基-3-三氟甲基-5-氨基吡啶(ATFPN)的合成
在2 L 四口瓶中依次加入水589.8 g、氯化铵4.8 g(0.09 mol)、还原铁粉150.8 g(2.7 mol),加热至70 ℃,保温搅拌0.5 h。保持温度70~80 ℃分批加入-氰基-3-三氟甲基-5-硝基吡啶196.6 g(0.9 mol)。加毕,70~80℃保温反应1.0 h,液相色谱跟踪至反应结束。滴加乙酸乙酯589.8 g,搅拌0.5 h,冷却至50 ℃,将反应液抽滤( 过硅藻土垫层)。滤液静置分液,水相再用乙酸乙酯196.6 g 萃取一次。合并有机相,减压脱溶回收乙酸乙酯(可回收套用)得到粗产品。粗产品用50%质量分数乙醇结晶、干燥得到白色固体142.5 g,液相色谱含量99.3%,收率84.0%。熔点:152.1~153.8 ℃。1H NMR(400 MHz,DMSO-d6)δ:8.19(d,J=2.4 Hz,1H),7.29(d,J=2.4Hz,1H),6.99(s,2H,NH2); LC-MS(m/z):187.0.0[M]+。
1.3.5 2-氰基-3-三氟甲基-5-异硫氰基吡啶(ITFPN)的合成
在2 L 四口瓶中加入无水碳酸钾粉末179.6 g(1.3 mo1)和水179.6 g,搅拌溶解,再加入1,2-二氯乙烷245.0 g 和2-氰基-3-三氟甲基-5-氨基吡啶122.5 g(0.65 mol)。升温至25 ℃,搅拌混合均匀,0.5 h 内滴加二硫化碳59.4 g(0.78 mo1)。滴加完毕,升温至45 ℃保温反应2.0 h。反应体系降温至0 ℃,缓慢滴加三聚氯氰143.9 g(0.78 mo1)溶于1,2-二氯乙烷287.8 g 的溶液。滴加完毕,0~5 ℃保温反应2.0 h。反应结束,滴加10%质量分数的氢氧化钠溶液调节体系pH 值至11,体系逐渐分层。静置分液,有机相水洗后减压脱溶回收1,2-二氯乙烷(可回收套用)得到粗产品。粗产品用50%质量分数的乙醇结晶、干燥得到类白色固体145.6 g,液相色谱含量99.1%,收率96.8%。熔点:38~39 ℃;1H NMR (400 MHz,CDCl3)δ:8.78(d,J=2.0 Hz,1H,PyH),7.91(d,J=2.0 Hz,1H,PyH),LC-MS(m/z):229.0.0[M]+。
2 结果与讨论
2.1 2-羟基-3-三氟甲基-5-硝基吡啶(NTFPO)的合成工艺优化
芳香化合物的混酸硝化法是工业生产中最常用和最经济的制备芳香硝基化合物的方法,但该方法存在设备腐蚀性大且废酸污染严重的问题。为了满足可持续发展的需要和对绿色化学理想的追求,尝试了以三氟甲磺酸盐作为催化剂的硝化方法[6],并得到了较为满意的结果。
2.1.1 硝化反应机理
2-羟基-3-三氟甲基吡啶在三氟甲磺酸盐催化下的硝化反应是以NO2+为亲电试剂的苯环上的亲电取代反应。NO2+的产生机理是金属离子的极化使与之配位的硝酸释放出质子,质子又能使游离的硝酸分子质子化,释放出活性中间体NO2+。在三氟甲基磺酸盐催化剂作用下,大量的硝酸分子被质子化生成NO2+,促使反应速度变快,副反应减少,收率提高。可能的反应机理如图2所示(以Zn (OTf)2催化剂为例):
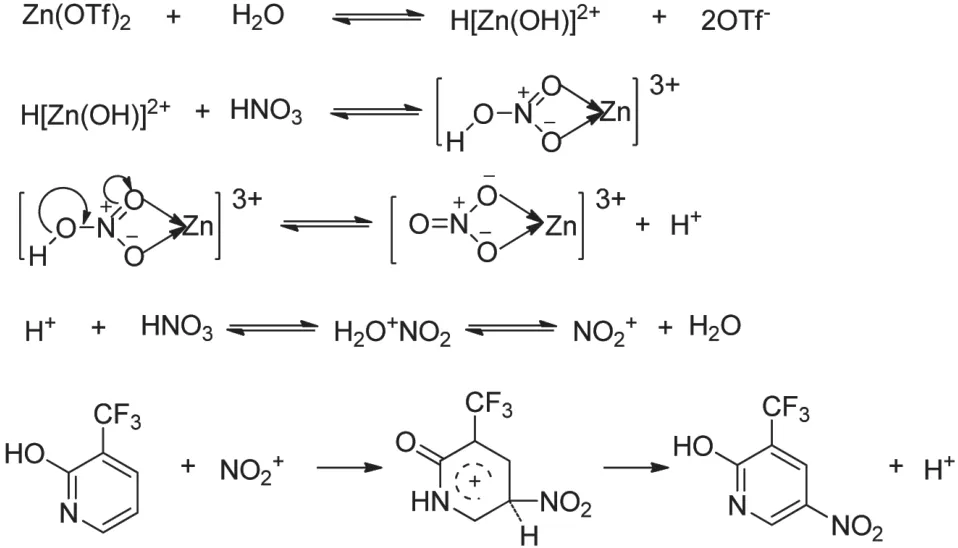
图2 2-羟基-3-散氟甲基砒啶硝化反应机理Fig.2 Nitration mechanism of 2-hydroxy-3-trifluoromethylpyridine
由上述反应机理分析,影响反应的主要因素是催化剂、硝酸浓度及原料配比。下面对上述因素逐一进行了试验及考察。
2.1.2 催化剂的选择
首先,考察了Zn (OTf)2、Cu (OTf)2、Ni (OTf)2、Bi (OTf)2、Zr (OTf)4分别作为催化剂条件下98%硝酸硝化和不加上述催化剂条件下混酸硝化的收率,试验结果如表1所示。
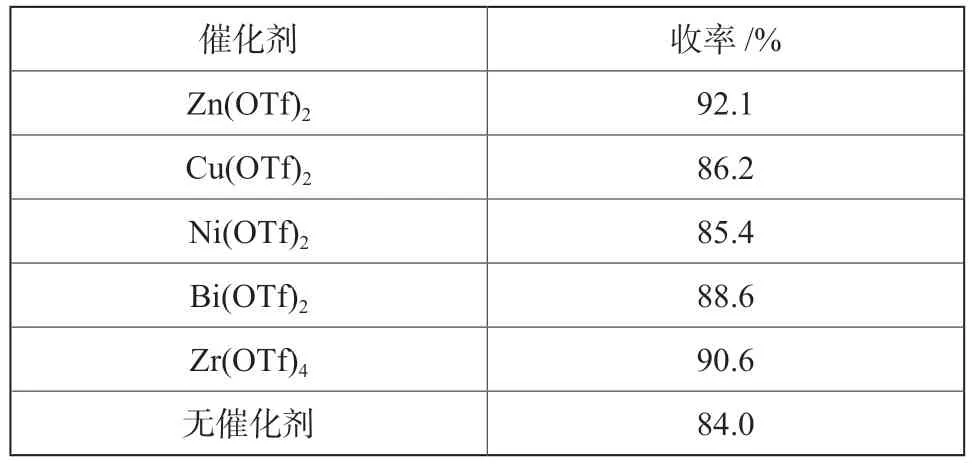
表1 不同三氟甲磺酸盐催化2-羟基-3-三氟甲基吡啶硝化Tab.1 Nitration of 2-hydroxy-3-trifluoromethylpyridine catalyzed by different metal triflates
从表1可以看出,与不加催化剂的混酸硝化相比,各种催化剂都具有一定的催化作用,其中以Zn (OTf)2作为催化剂的收率最高,达92.1%。因此,选择Zn (OTf)2作为该硝化反应的催化剂。
2.1.3 硝酸浓度的选择
然后,以Zn (OTf)2作为催化剂,试验考察了硝酸浓度对硝化反应的影响,试验结果如表2所示。
表2 硝酸浓度对硝化收率的影响Tab.2 Effect of nitric acid concentration on yield
由表2可以看出,随着硝酸浓度的增加,硝化反应收率呈现出增大趋势,这可能是由于随硝酸浓度增加,体系含水量减少,促使反应平衡向产物一边移动,从而使反应收率增大。因此,选择98%的发烟硝酸作为硝化试剂。
2.1.4 硝酸用量的选择
除了催化剂和硝酸浓度的影响外,硝酸用量对反应收率也有很大的影响。以Zn (OTf)2作为催化剂,98%的发烟硝酸作为硝化试剂,考察了硝酸用量对硝化反应的影响,试验结果如表3所示。

表3 n (NTFPO)/n (HNO3)对硝化收率的影响Tab.3 Effect of n (NTFPO)/n (HNO3) on yield
由表3可以看出,硝化反应收率先随硝酸用量的增加而增加,当n(NTFPO)∶n(HNO3)=1∶1.1 时,反应收率较高,继续增加硝酸的用量,收率基本不增加。因此,选择n(NTFPO)∶n(HNO3)=1∶1.1。
由上述讨论可知,采用Zn (OTf)2作为催化剂,98%的发烟硝酸作为硝化试剂,n(NTFPO):n(HNO3)=1∶1.1 时,反应速度较快,副反应少,反应收率较高(92.1%),且反应残余的废酸是过量的硝酸,后处理简单。与混酸硝化工艺比较,该工艺绿色环保,且反应收率较高(文献[5]收率为84%)。
为了进一步降低生产成本,下一步将重点考虑Zn (OTf)2催化剂的回收和重复利用。拟采用浸渍法将各种三氟甲磺酸稀土金属盐负载于硅胶上,考察催化剂的回收和重复利用效果。
2.2 2-氰基-3-三氟甲基-5-硝基吡啶(NTFPN)的合成工艺优化
氰化反应常用试剂有:NaCN、KCN、CuCN 以及K4[Fe (CN)6],其中NaCN和KCN剧毒;CuCN会造成重金属污染。研究了以2-溴-3-三氟甲基-5-硝基吡啶为原料、K4[Fe (CN)6]为氰化试剂制备2-氰基-3-三氟甲基-5-硝基吡啶的反应工艺[7],得到了较为满意的结果。
2.2.1 氰基化反应机理
2-溴-3-三氟甲基-5-硝基吡啶以K4[Fe (CN)6]作为氰化试剂的氰基化反应是以CN-为亲核试剂的苯环上的亲核取代反应[8]。首先在碳酸钾和配体作用下,Pd (OAc)2还原为Pd(0),Pd(0)与2-溴-3-三氟甲基-5-硝基吡啶反应生成氧化加成产物(Ⅰ),产物(Ⅰ)中的溴与亚铁氰化钾中的氰根交换生成配合物(Ⅱ),随后配合物(Ⅱ)还原消除生成2-氰基-3-三氟甲基-5-硝基吡啶并得到Pd(0)。其可能的反应机理如下所示:

图3 2-溴-3-三氟甲基-5-硝基吡啶氰基化反应机理Fig.3 Cyanation mechanism of 2-bromo-3-trifluoromethyl-5-nitropyridine
从上述反应机理可以看出,影响反应的主要因素是原料配比、反应时间、反应温度、催化剂的用量等,下面对以上因素进行试验考察。
2.2.2 原料配比对反应的影响
固定n[K4[Fe (CN)6]∶n[Pd (OAc)2]=1∶0.1%,反应温度140 ℃,反应时间4.0 h,考察亚铁氰化钾用量对反应收率的影响,试验结果如表4所示。
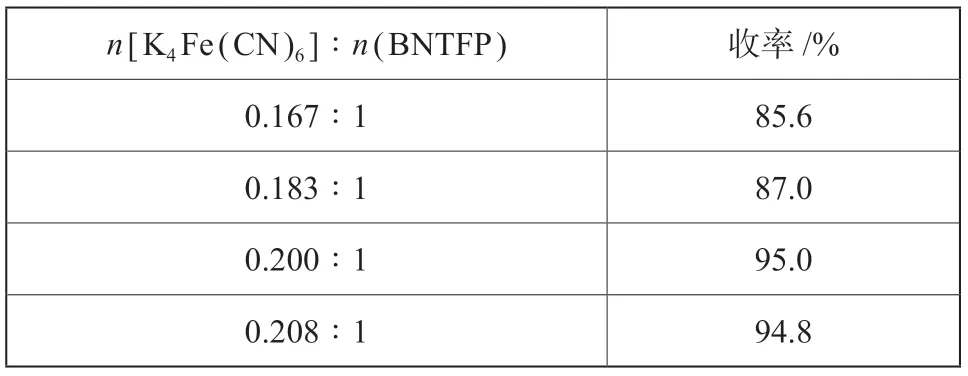
表4 n [K4[Fe (CN)6]/n (BNTFP) 对氰化反应的影响Tab.4 Effect of n [K4[Fe (CN)6]/n (BNTFP) on the yield
从表4可以看到,反应收率先随亚铁氰化钾用量增加而增加,当n[K4[Fe (CN)6]∶n(BNTFP)=0.2∶1 时,反应收率达到最高值,继续增加亚铁氰化钾用量,反应收率反而略有降低。因此,确定n[K4[Fe (CN)6]∶n(BNTFP)=0.2:1。
固定n[K4[Fe (CN)6]∶n(BNTFP)=0.2:1,反应温度140 ℃,反应时间4.0 h,考察催化剂Pd (OAc)2用量对反应收率的影响,试验结果如表5所示。

表5 n (BNTFP)/n [ Pd (OAc)2 ]对氰化反应的影响Tab.5 Effect of n (BNTFP)/n [ Pd (OAc)2 ]on the yield
由表5可见,当催化剂Pd (OAc)2用量逐渐增加时,反应收率呈现出先增加后逐渐降低的趋势,当n(BNTFP)∶n[ Pd (OAc)2]=1:0.1% 时,反应收率达到最高值,当催化剂用量继续增加时反应收率反而下降。这可能是因为过多的催化剂致使钯的聚集,形成钯黑,导致催化剂失活。因此,确定n(BNTFP)∶n[ Pd (OAc)2]=1∶0.1%。
2.2.3 反应条件对反应的影响
固定n(BNTFP):n[K4[Fe (CN)6]∶n[ Pd (OAc)2]=1∶0.200∶0.1%,反应温度140 ℃,考察反应时间对反应收率的影响,试验结果见表6。
由表6可以看出,随反应时间增加,反应收率呈现先逐渐增加后降低的趋势,当反应时间为4.0 h时,反应收率最高。因此,确定反应时间为4.0 h。
固定n(BNTFP):n[K4[Fe (CN)6]∶n[ Pd (OAc)2]=1∶0.2∶0.1%,反应时间4.0 h,考察反应温度对反应收率的影响,试验结果如表7所示。
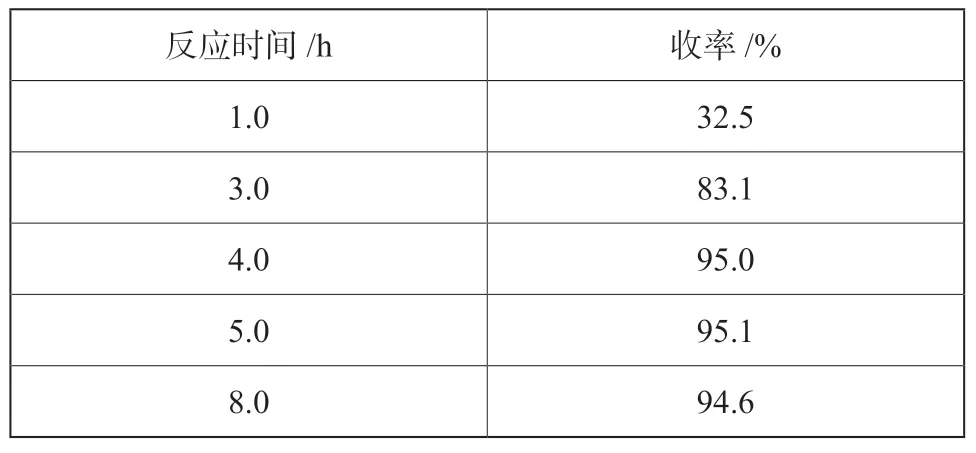
表6 反应时间对氰化反应的影响Tab.6 Effect of reaction time on the yield
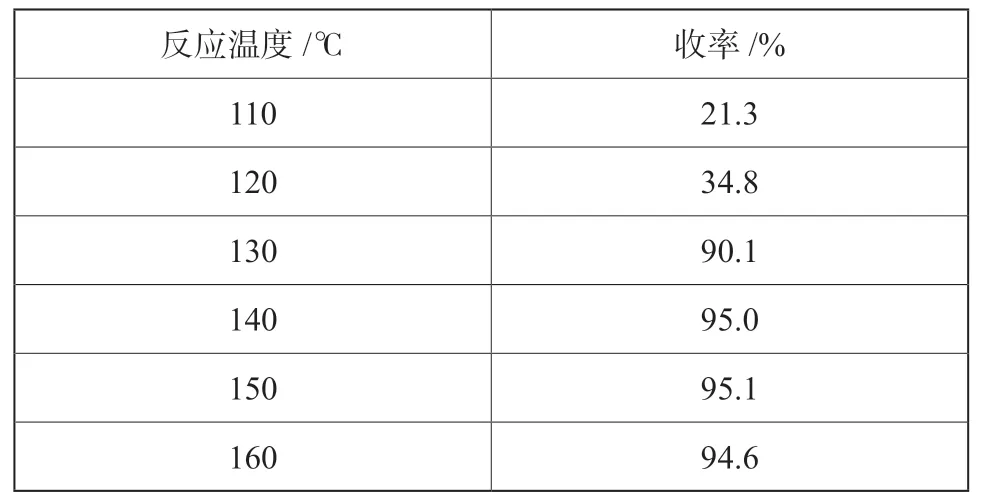
表7 反应温度对氰化反应的影响Tab.7 Effect of reaction temperature on the yield
由表7可见,反应温度低于120 ℃时,反应收率较低,说明氰根不易从亚铁离子上转移。当温度升到140 ℃时,反应收率最高,继续升高温度反应收率反而略有降低。因此选择140 ℃作为氰化反应温度。
由上述讨论可知,当n(BNTFP):n[K4[Fe (CN)6]:n[ Pd (OAc)2]=1∶0.2∶0.1%,反应温度140 ℃,反应时间4.0 h 时,反应收率最高(95.0%),且溶剂N,N-二甲基乙酰胺可回收套用。与Cu (CN)2工艺比较,该工艺后处理简单,产生“三废”较少,且溶剂可回收,符合绿色环保的生产理念。
2.3 2-氰基-3-三氟甲基-5-异硫氰基吡啶(ITFPN)的合成工艺优化
考虑到文献[3]采用硫光气作为反应试剂,毒性较大,且对环境造成较大污染。参考文献[8]制备异硫氰酸酯的方法,以2-氰基-3-三氟甲基-5-氨基吡啶(ATFPN)和二硫化碳为原料,三聚氯氰作为脱硫试剂,采用两步“一锅法”的合成方法制备得到了目标产物2-氰基-3-三氟甲基-5-异硫氰基吡啶(ITFPN),并研究了不同种类的碱以及不同的原料配比对反应收率的影响。
2.3.1 碱的种类与用量选择
固定投料量2-氰基-3-三氟甲基-5-氨基吡啶(0.1 mol)、二硫化碳(0.11 mol),考察了三乙胺、吡啶、碳酸钾三种碱及其用量对反应的影响,实验结果如图4所示。
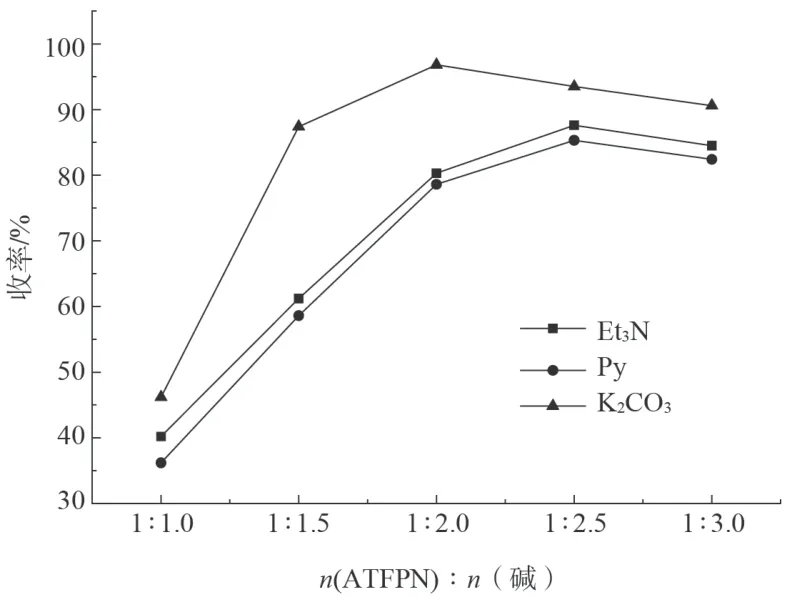
图4 碱的种类和用量对收率的影响Fig.4 Effect of type and quantity of alkali on yield
由图4可见,随碱的用量增加,反应收率整体呈现出先增加后降低的趋势。其中,以K2CO3作为反应的碱,且当n(ATFPN)∶n(K2CO3)=1∶2.0 时,反应收率最高。反应体系不加碱,无产物生成。
2.3.2 原料配比选择
固定投料量2-氰基-3-三氟甲基-5-氨基吡啶(0.1 mol)、三聚氯氰(0.12 mol)、碳酸钾(0.2 mol),考察二硫化碳用量对反应收率的影响,试验结果如图5所示。

图5 n (ATFPN)/n (CS2)对收率的影响Fig.5 Effect of n (ATFPN)/n (CS2) on the yield
从图5可看到,随二硫化碳用量增加,反应收率逐步提高,当n(ATFPN)∶n(CS2)=1∶1.2 时,反应收率基本趋于稳定。
固定2-氰基-3-三氟甲基-5-氨基吡啶(0.1 mol),二硫化碳(0.12 mol)和碳酸钾(0.2 mol),考察三聚氯氰用量对反应收率的影响,实验结果如图6所示。
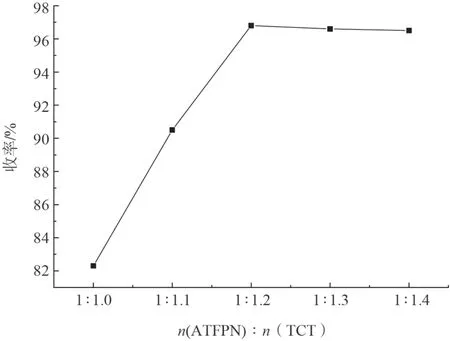
图6 n (ATFPN)/n (TCT) 对收率的影响Fig.6 Effect of n (ATFPN)/n (TCT) on Yield
从图6可看出,反应收率先随TCT 用量的增加而增加,当n(ATFPN)∶n(TCT)=1∶1.2 时,反应收率最高,继续增加TCT 的用量,可能是由于副产物增加的原因,反应收率反而略有降低。
由上述讨论可知,当n(ATFPN)∶n(CS2):n(K2CO3)=1∶1.2∶2.0%时,反应收率最高(96.8%)。该工艺避免了较毒的原料硫光气的使用,降低了反应的风险,并且生成了类白色且品质较好的2-氰基-3-三氟甲基-5-异硫氰基吡啶。
3 结论
(1)探讨了2-氰基-3-三氟甲基-5-异硫氰基吡啶的合成工艺并进行了优化。以低成本的2-羟基-3-三氟甲基吡啶为起始原料,经6 步反应,以65.6%的总收率合成了目标化合物。
(2)对各步反应工艺进行了优化。优化后反应条件为:硝化反应[催化剂:三氟甲磺酸锌,硝化试剂:98% 硝酸,n(NTFPO)/n(HNO3)=1∶1.1,收率:92.1%];氰化反应[n(BNTFP)∶n[ K4Fe (CN)6]:n[ Pd (OAc)2]=1∶0.200∶0.1%,反应温度140 ℃,反应时间:4.0 h,收率:95.0% ];ITFPN 合成[n(ATFPN)∶n(K2CO3):n(CS2):n(TCT)=1∶2.0∶1.2∶1.2,收率:96.8% ]。
(3)各步反应溶剂可实现回收套用。
(4)优化后的工艺反应具有反应条件温和、操作简单、反应总收率高和环境友好等优点,并且该工艺应用的硝化方法和氰化方法可应用于类似的反应 中。

