p-AXL与c-MYC和/或BCL-2共表达在弥漫大B细胞性淋巴瘤中的临床意义
缪娜波,黎绮铭,李淑华,聂钊铭,张芬芬,彭挺生
(中山大学附属第一医院病理科,广东广州 510080)
弥漫大B 细胞性淋巴瘤(diffuse large B cell lymphoma,DLBCL)是最常见的成熟B 细胞性肿瘤,其临床病理特征、免疫表型具有明显的异质性[1-3];我国DLBCL 发病率约占所有淋巴瘤的35.8%[4]。根据免疫学表型DLBCL 分为GCB 型和Non-GCB型[5],两种分型对靶向药物的化疗反应及患者的生存期显著不同[6]。R-CHOP 方案化疗可使DLBCL得到缓解,但仍有30%~40%患者对化疗不敏感致其生存率下降[7];因此,寻找新的提示肿瘤治疗反应或预后的生物学标记物有重要的临床意义。受体酪氨酸激酶(Anexelekto,AXL)最早发现于慢性粒细胞白血病,AXL 与肿瘤的侵袭转移密切相关,可作为生存率的预测因子[8-9],本课题组也曾证实AXL在骨肉瘤中高表达且与预后不良呈正相关[10],但是,目前国内外尚未有关于AXL 与淋巴瘤相关性的研究。MYC基因可影响细胞凋亡、增殖和生长,MYC阳性的DLBCL 预后差[11-14],c-MYC 蛋白表达对DLBCL 患者的预后评估基本等同于MYC基因易位[15]。研究表明c-MYC 过表达可增强AXL的表达[16],提示AXL 与c-MYC 之间存在调控机制。B 淋巴细胞瘤-2(B-cell lymphoma-2,BCL-2)基因可抑制细胞凋亡,BCL-2 蛋白过表达是DLBCL 患者预后不良的独立指标[17-19]。c-MYC 和BCL2蛋白双表型的DLBCL 侵袭性增强、预后更差[1,20-21]。本研究拟通过检测DLBCL 组织中p-AXL、BCL-2、c-MYC 蛋白及MYC断裂基因的表达水平,探索p-AXL 在DLBCL 中的表达情况及其临床意义,并探讨p-AXL/c-MYC、p-AXL/BCL-2、p-AXL/c-MYC/BCL-2 蛋白共表达的临床意义,以及p-AXL 与MYC断裂基因之间的临床病理联系。
1 材料与方法
1.1 选择入组病例
本研究纳入2012年至2017年在中山大学附属第一医院确诊为原发性DLBCL的病例394例,根据以下标准筛选出118 例DLBCL 进行研究。入组标准:明确诊断为DLBCL;年龄>18 岁;送检组织直径>1 cm。剔除标准:合并其他重大疾病,如恶性肿瘤、艾滋病、移植术后;由其它类型淋巴瘤转化而来;既往有淋巴瘤病史者。本研究经中山大学附属第一医院伦理委员会批准。所有患者均签署知情同意书。
收集上述患者的一般信息、实验室和影像学检查结果、病理形态及免疫组化和基因检测等结果、临床治疗信息及放化疗方案、疗程和疗效评价等。对所有病例进行病历记录或电话随访,结局采用无进展生存期(PFS)和总生存期(OS)表示。
1.2 组织芯片的免疫组化染色
1.2.1 组织芯片制作 收集118 例DLBCL 患者的HE 和免疫组化切片及蜡块,由两位高年资病理医师阅片,在HE切片上选择肿瘤细胞丰富的区域,并在蜡块上相应的位置标记。设计好组织芯片阵列图,使用1.0 mm 采样针在蜡块标记处穿取组织,制作成组织芯片备用。
1.2.2 免疫组织化学染色 将组织芯片切成4 μm薄片,56 ℃,4 h;二甲苯脱蜡3 次×10 min;100%、95%、80%梯度乙醇各10 min;蒸馏水清洗2 次×5 min、PBS 清洗5 min;柠檬酸钠/EDTA 修复液高压处理2.5 min 后,室温冷却1 h;PBS 清洗3 次;3%H2O2溶液浸泡10 min;PBS 清洗3 次后封闭1 h;一抗4 ℃孵育过夜,p-AXL 兔抗人多克隆抗体(美国R&D 公司)1∶40,c-MYC 浓缩抗体(广州深达公司)1∶200,BCL-2 即用型抗体(DAKO,丹麦);复温后PBS 清洗5 次;即用型二抗(CST)室温孵育40 min;PBS 清洗5 次后DAB 显色,苏木素复染,冲洗,梯度乙醇脱水,中性树脂封片。
复习所有免疫组化片,由两名高年资病理医师进行双盲判读,判读不一致时讨论后统一意见。CD10、BCL-2以肿瘤细胞膜着色为阳性表达;BCL-6、Mum-1、c-MYC 以肿瘤细胞核着色为阳性表达;高倍镜(×400)随机挑选10 个视野计数阳性细胞比例。阳性细胞比例≥30%为阳性(+);其中c-MYC以阳性细胞比例≥40%为阳性(+)。p-AXL 以细胞膜或胞浆着色为阳性表达,随机选择10 个高倍镜视野判断阳性细胞区域及染色强度。<25%记1分,25%~50%记2 分,51%~75%记3 分,>75%记4分。染色强度判定:无染色记0 分,染色稍高于背景记1 分,染色明显高于背景记2 分,强染色记3分。将两次得分相乘,得分0~1 分为阴性(-),2~3分为弱阳性(+),4~6 分为阳性(++),7~8 分为强阳性(+++)。
1.3 荧光原位杂交(FISH)
1.3.1 实验步骤 将组织芯片切成4 μm 薄片,56 ℃,2 h;脱蜡,梯度100%乙醇脱水;蒸馏水洗3次,用吸水纸吸取多余的水分;双蒸水煮沸后放入切片煮10~15 min;蛋白酶消化,37 ℃,10~30 min;SSC 清洗2 次;甲醛固定10 min;70%乙醇、85%乙醇和100%乙醇各3 min。放入56 ℃烤箱5 min;滴加10 μL 探针混合物于切片上,盖上盖玻片,用封片胶封边;放入杂交仪器,设置共变性条件:83 ℃,5 min,杂交条件:42 ℃,16 h;SSC 清洗2 次;70%乙醇3 min;置于暗房自然干燥切片;滴加15 μL 的DAPI 细胞核复染剂复染15 min;在暗房用油镜(×1 000)观察切片;阅片结束后将片子保存在-20 ℃。
1.3.2MYC断裂基因结果判读 参照文献的判读方法[22],光镜下找到肿瘤区域后转为油镜,打开双通道观察细胞内信号。未发生基因断裂的细胞显示有2 个融合的黄色信号,发生断裂的细胞显示为1 黄1 红1 绿3 个信号,若细胞中只能观察到1 个信号、1黄1绿或1黄1红时不纳入判读范围。随机观察至少100 个细胞,阳性细胞比例≥15%时记为阳性(+)。
1.4 统计分析
统计分析采用SPSS 20.0 软件,定性资料对比采用χ2检验或秩和检验;应用Kaplan Meier 法计算生存率及绘制生存曲线,采用Log Rank 检验;单因素及多因素分析釆用Cox 回归;定义P<0.05 有统计学意义。
2 结果
2.1 本组DLBCL患者的临床特征
入组的118 例患者中,男性占55.1%(65/118),女性占44.9%(53/118);中位年龄57.5岁,发病高峰期集中在50~60 岁之间。27.1%(32/118)的患者起病时伴随有B 症状,Ann Arbor 分期、淋巴瘤国际预后指数(internationalprognosticindex,IPI)评分等临床资料详见表1。
2.2 本组DLBCL患者的随访信息
本组病例随访时间1~85 月,中位随访时间23个月,共86.4%(102/118)的患者获得随访信息,失访率13.6%(16/118)。确诊后进行了手术或化疗,并具有影像学资料用以评估病情发展的有96 人,随访结束时患者的平均生存时间(33.9±24.4)月,平均复发和(或)死亡时间(29.2±24.2)月。49%(50/102)的患者出现复发和(或)死亡,且多在第一年内复发(32/50)。36.3%(37/102)的患者死亡,且多在第一年内死亡(23/37),另外63.7%(65/102)的患者仍存活,最长生存时间超过85个月。
2.3 本组DLBCL临床病理分型
本组病例Hans 分型如图1 所示,Hans 分型根据肿瘤细胞CD10,Bcl-6 和MUM-1 免疫组化表达情况来划分DLBCL,CD10 阳性诊断为GCB 型;CD10、Bcl-6均为阴性诊断为Non-GCB型,若Bcl-6阳性则还需结合MUM-1 的表达情况再划分;本组DLBCL 病例中GCB 型占43.2%(51/118),Non-GCB型占56.8%(67/118)。
2.4 p-AXL表达与DLBCL的临床病理联系
2.4.1 p-AXL,c-MYC 及BCL-2 蛋白在本组病例中的表达 本组病例分为GCB 组和non-GCB 组,其HE形态(HE×400)及p-AXL、c-MYC、BCL-2免疫组化(IHC×200)表达情况如图2。GCB 型DLB⁃CL 肿瘤细胞p-AXL 蛋白阳性表达量较低(图2C),non-GCB 型瘤细胞p-AXL 蛋白表达量较高(图2D);c-MYC在不同组织学亚型DLBCL中呈核阳性(图2E,F);不同的DLBCL 组织学类型中BCL-2阳性比例及染色强度不尽相同,但均为阳性表达(图2G,H)。
2.4.2 p-AXL 表达与DLBCL 患者临床特征的相关性研究 p-AXL在肿瘤细胞的胞膜或胞质中表达,阳性率44.1%(52/118),16 例呈高表达。c-MYC 蛋白在细胞核表达,应用χ2检验统计本组实验结果,发现p-AXL 表达与DLBCL 患者的性别、年龄、B 症状、原发部位、血清中β2-MG、乳酸脱氢酶(LDH)水平、Ann Arbor 分期、IPI 评分均无关(P>0.05),但与患者化疗缓解率显著相关(P<0.01),p-AXL 阳性患者的化疗缓解率明显较低。p-AXL 表达与DLB⁃CL 组织的Hans 分型显著性相关(P<0.01),阳性表达中73.1%(38/52)为Non-GCB型(表1)。

图1 本组118例DLBCL的Hans分型Fig.1 Hans classification of 118 cases of DLBCL in this study
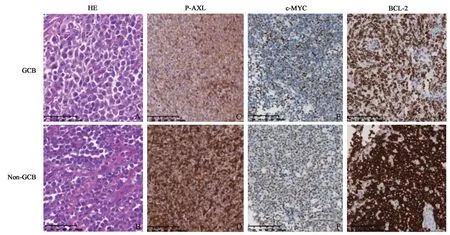
图2 DLBCL的组织学形态及免疫组化表达情况Fig.2 The morphology features of the two sub-styles in this group of DLBCL
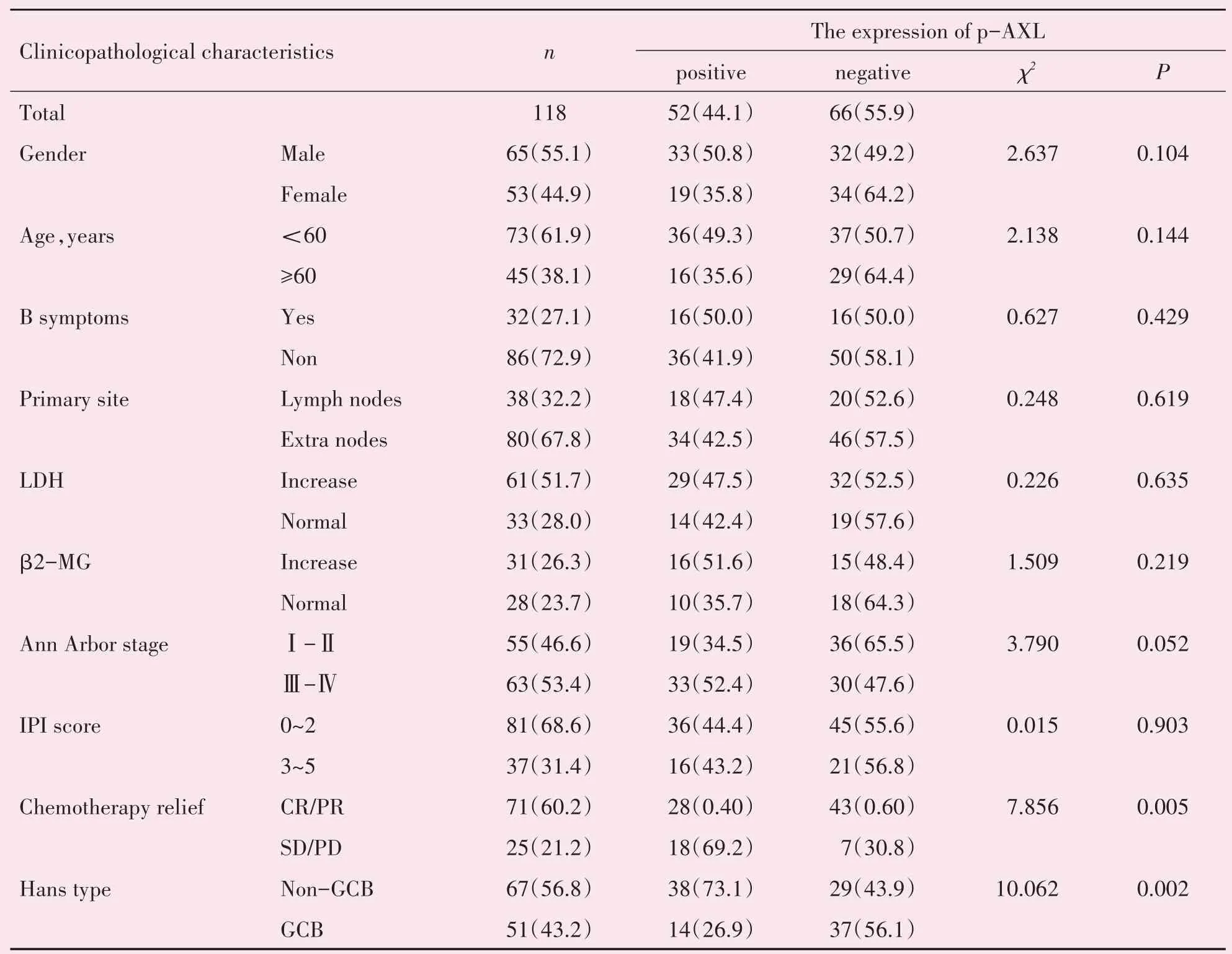
表1 p-AXL表达与DLBCL临床病理特征的关系Table1 The relationship between the expression of P-AXL and the clinic-pathological features [n(%)]
2.4.3 p-AXL 与BCL-2 或c-MYC 表达 的相关 性研究 本组病例组织中MYC断裂基因阳性率9.7%(11/113),发生断裂的阳性细胞比例在15%~80%。p-AXL 与c-MYC、BCL-2 蛋白表达均显著性相关(P<0.01);与MYC 断裂基因表达未见显著相关性(P>0.05;表2)。
2.4.4 p-AXL 表达与DLBCL 患者预后的相关性研究 单变量Cox 回归分析发现p-AXL 表达与性别(P=0.003)、IPI 评分(P=0.016)及Hans 分型(P=0.029)等因素协同均是DLBCL 患者PFS 的显著影响因素;但是,多变量Cox 回归(backward:LR)分析发现p-AXL 表达仅与性别协同是患者PFS 的独立影响因素,而p-AXL 表达及其与IPI 评分、Hans 分型均不是独立影响因素(表3)。
应用多变量Cox 回归(backward:LR)分析,发现p-AXL 表达与性别是患者OS 的独立影响因子,而p-AXL 与Hans 分型不是独立预后影响因素(表4)。
Kaplan Meier 分析显示,DLBCL 患者中p-AXL阳性组的PFS 率低于阴性组(Log Rankχ2=6.449,P=0.011),OS率亦低于阴性组,但差异尚未达到统计学意义(Log Rankχ2=3.684,P=0.055);其中p-AXL阴性组的3 年PFS 率和OS 率为61.2%和69.9%,而p-AXL 阳性组的3 年PFS 率和OS 率仅41.9%和52.4%。另外,p-AXL 阳性的男性患者的PFS 率(Log Rankχ2=7.836,P=0.005)和OS 率(Log Rankχ2=6.215,P=0.013)也均明显降低,其3 年PFS 率和OS率仅23.6%和30.0%,而女性或p-AXL阴性患者的3年PFS率和OS率为62.6%和72.8%(图3)。
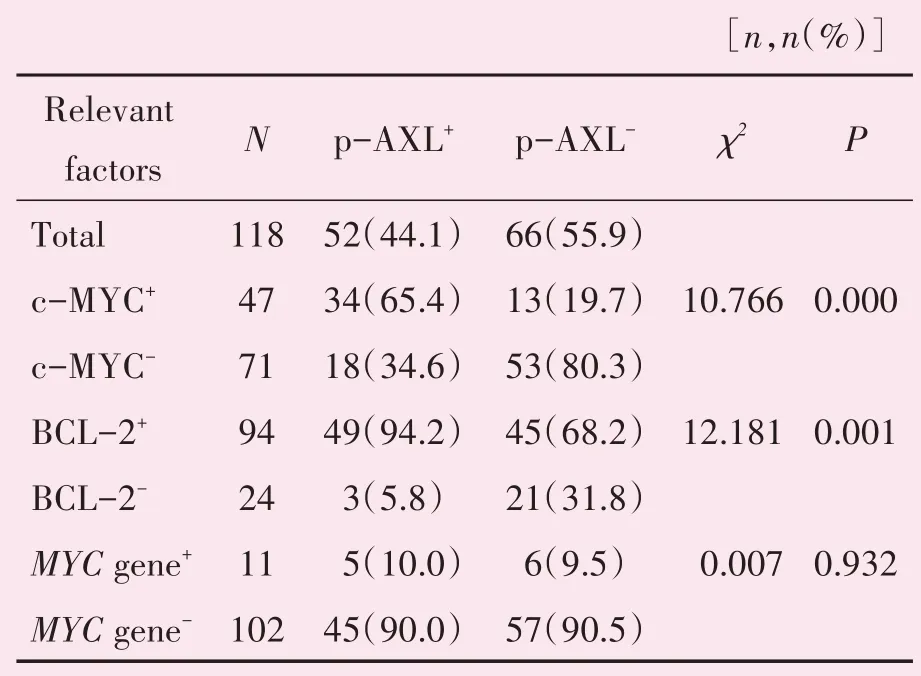
表2 p-AXL与BCL-2或c-MYC表达的相关性研究Table 2 Relationship between the expression of PAXL and the expression of BCL-2 or c-MYC
2.4.5 p-AXL/c-MYC/BCL-2 蛋白共表达与DLB⁃CL 临床病理特征的相关性研究 应用χ2检验统计本组实验结果,p-AXL/c-MYC/BCL-2 共表达者患者的化疗缓解显著性降低(P=0.001);p-AXL/c-MYC/BCL-2蛋白共表达者与患者的Hans分型显著性相关(P=0.001),其中Non-GCB 型为81.3%(26/32;表5);3 种蛋白共表达与其他临床参数包括性别、年龄、B 症状、原发部位、血β2-MG、LDH 水平、Ann Arbor分期及IPI评分均无相关性(P>0.05)。
2.4.6 p-AXL 与c-MYC 和/或BCL-2 共表达与DL⁃BCL 患者预后的相关性研究 单变量Cox 回归分析发现p-AXL/c-MYC(P=0.000)、p-AXL/BCL-2(P=0.024)、p-AXL/c-MYC/BCL-2(P=0.002)蛋白共表达都是DLBCL 患者PFS 的危险因素;多变量Cox回归分析(backward:LR)显示只有p-AXL/c-MYC蛋白共表达是DLBCL 患者PFS 独立危险因素(P<0.001;表6)。

表3 52例DLBCL患者PFS的多变量Cox回归结果(1)Table 3 Multivariate cox analysis of PFS in 52 patients with DLBCL(part 1)
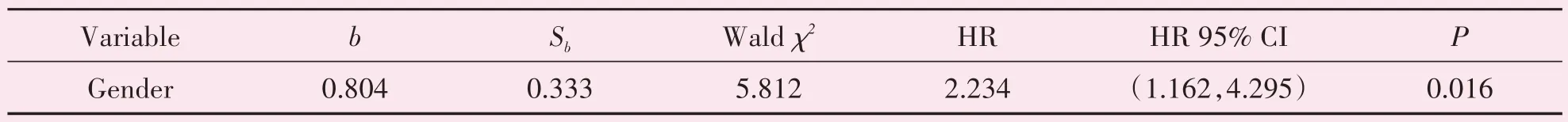
表4 52例DLBCL患者OS的多变量Cox回归结果(2)Table 4 Multivariate cox analysis of OS in 52 patients with DLBCL(part 2)

图3 生存曲线分析Fig.3 Survival curves of the patients
与DLBCL 的PFS 影响因素相类似,单变量Cox回归分析发现p-AXL/c-MYC(P=0.003)、p-AXL/c-MYC/BCL-2(P=0.01)蛋白共表达是DLBCL 患者OS 的危险因素,而p-AXL/BCL-2 共表达不是患者OS 的影响因素;多变量Cox 回归(backward:LR)分析发现只有p-AXL/c-MYC 蛋白共表达是DLBCL患者OS的独立危险因素(P=0.002;表7)。
Kaplan Meier 分析显示,p-AXL/c-MYC 蛋白共表达组的PFS 率(Log Rankχ2=13.659,P=0.000)和OS 率(Log Rankχ2=10.363,P=0.001)明显低于非共表达组,p-AXL/c-MYC 共表达患者的3年PFS率和OS 率仅22.5%和28.8%,而非共表达患者的PFS 率和OS率为66.6%和75.3%,明显高于共表达组的生存率(图4)。
3 讨论

图4 p-AXL/c-MYC 蛋白共表达与DLBCL患者的生存曲线Fig.4 Survival curves of patients with co-expression of p-AXL/c-MYC proteins
非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)更常见于发达地区,发病率最高的分别是北美洲、澳洲和欧洲,最低的是加勒比地区和亚洲[3]。尽管淋巴瘤不在我国最常见的10 种恶性肿瘤之内,但其死亡率仍排名第十位[23]。DLBCL 是NHL中最常见的组织学类型[1-3],因此,对DLBCL 进行更多的临床病理研究有助于深入地认识淋巴瘤的发病机制,为临床预后评估提供更多的理论依据。

表5 p-AXL/c-MYC/BCL-2蛋白共表达与DLBCL患者临床病理参数的关系Table 5 Relationship between co-expression of P-AXL/BCL-2/c-MYC and the clinic-pathological features[n,n(%)]

表6 p-AXL和c-MYC与DLBCL患者PFS的多变量Cox回归分析Table 6 Multiple cox analysis of PFS between P-AXL and the expression of c-MYC [n(%)]

表7 p-AXL与c-MYC和/或BCL-2影响DLBCL患者OS的多变量Cox回归分析Table 7 Multiplecox analysis of OS between P-AXL and the expression of c-MYC [n(%)]
AXL 蛋白阳性表达或与其他抗体联合表达是乳腺癌、肺癌及胶质母细胞瘤等[24-26]预后不良的生物学标志物。AXL 异常表达亦参与肉瘤的发生发展,Gas6 激活的AXL 能促进骨肉瘤细胞的迁移和侵袭[10]。但目前国内外尚无人报道AXL 与DLBCL之间的相关关系。本研究发现活化的p-AXL 蛋白可在DLBCL 中表达,阳性率44.1%(52/118)。p-AXL 与c-MYC 蛋白、BCL-2 蛋白表达显著性相关(P<0.01);并发现p-AXL 与Hans 分型显著相关(P<0.01),阳性表达中73.1%(38/52)为Non-GCB型。此外,还发现p-AXL 与DLBCL 患者的化疗缓解显著相关(P<0.01),阳性患者的化疗缓解率显著低于阴性患者。Kaplan Meier生存曲线分析显示p-AXL 阳性患者的PFS 率和OS 率明显低于阴性患者。Cox 单因素分析得出p-AXL 阳性表达是影响DLBCL 患者PFS 的危险因素(P<0.05),但不是影响患者OS 危险因素(P>0.05)。以上结果表明p-AXL 参与了DLBCL 的发生发展,与患者的化疗缓解率和PFS呈显著性负相关,因此p-AXL蛋白有望成为评估DLBCL患者预后的新指标。
既往研究[17-19]表明BCL-2 蛋白过表达是DLB⁃CL 患者预后不良的独立指标。BCL-2 蛋白阻断化疗药物诱导的细胞死亡途径,使肿瘤细胞产生耐药性,临床上利妥昔单抗(美罗华)提高BCL-2阳性者对化疗药物的应答率,从而抵消BCL-2 蛋白对DL⁃BCL 患者生存带来的不良影响[20]。BCL-2 在本组DLBCL 中的阳性率为79.7%(90/118),其中p-AXL/BCL-2 蛋白共表达率为41.5%(49/118),p-AXL/BCL-2 共表达者化疗缓解率显著性降低(P<0.01),常见于Non-GCB 型且具有显著性意义(P<0.01)。Cox单因素分析中显示,p-AXL/BCL-2蛋白共表达者患者PFS 显著性降低(P<0.05),但对患者OS 无明显影响(P>0.05)。c-MYC 蛋白表达和MYC基因易位亦是DLBCL患者的重要预后指标[15]。本组DLBCL 病例中p-AXL 与c-MYC 蛋白表达具有显著的相关性(P<0.01),118 例中有34 例(28.8%)存在p-AXL/c-MYC 蛋白共表达且与Hans分型显著相关(P<0.01),其中82.4%(28/34)为预后较差的Non-GCB 型。此外,p-AXL/c-MYC 蛋白共表达DLBCL 患者的化疗缓解率显著性降低(P<0.01);Kaplan Meier 生存曲线显示,p-AXL/c-MYC共表达亦显著性降低患者的PFS 率和OS 率(P<0.01)。Cox 多因素回归分析证实了p-AXL/c-MYC蛋白共表达是DLBCL患者显著的不良预后因素。
c-MYC/BCL-2蛋白共表达与DLBCL的侵袭性密切相关,且是患者预后不良的因素之一[20-21]。本研究中Cox单因素回归分析显示c-MYC/BCL-2、p-AXL/c-MYC、p-AXL/c-MYC/BCL-2 共表达都是DLBCL 患者PFS 和OS 的危险因素(P<0.05),共表达组的PFS 率和OS 率均明显低于非共表达组(P<0.05)。将上述指标用逐步后退法(backward:LR)进行Cox 多因素回归分析,结果显示,只有p-AXL/c-MYC 共表达是患者独立的预后因素(P<0.01),而c-MYC/BCL-2 和p-AXL/c-MYC/BCL-2 共表达不是患者预后的独立危险因素(P>0.05)。我们分析出现此结果可能是由于引入了p-AXL 变量,这一变量在以往DLBCL 预后研究中从未被发现过,由于p-AXL/c-MYC 共表达可能对患者预后意义影响更大,经过Cox 多因素回归校正混杂因素后,影响较小的c-MYC/BCL-2共表达不再具有统计学意义。
AXL 可以通过激活AKT 信号通路来介导肿瘤细胞的致癌作用或耐药性[10,27-28]。食管腺癌的癌细胞中AXL 过表达后通过激活AKT/β-catenin 蛋白信号通路,可以上调c-MYC 的转录活性、mRNA 和蛋白水平,从而导致患者对表阿霉素产生耐药[29]。另有文献[16]报道肿瘤细胞通过释放活性氧可以促进Gas6 分泌,使其与受体AXL 结合,通过激活Ras/PI3K/AKT 信号通路,导致细胞中c-MYC 的过表达来正向调节精氨基琥珀酸合成酶1(ASS1)的生成,从而合成肿瘤细胞中所需的ASS1,同时还发现c-MYC 的过表达可以反馈增强AXL 的表达。综上所述,c-MYC 和AXL 之间并不是简单的平行关系,两者之间可能存在信号通路相互调节的机制。我们推测在DLBCL 细胞中,过表达的AXL 可能通过激活AKT 或其他信号通路上调c-MYC 水平,AXL 和c-MYC的同时过表达可能增强DLBCL的侵袭性,或降低了患者对化疗药物的应答率,从而使患者的生存率下降,其详细分子机制需要进一步的深入研究。
约10%的DLBCL 中可检测到MYC 易位(范围在4%~14%之间),且更多见于GCB 型患者,此时GCB 型的预后明显差于Non-GCB 型[22]。在本研究中,113例可判读的组织中有11例MYC基因出现断裂,阳性率9.7%,与文献报道一致。MYC基因断裂阳性组织中GCB 型为63.6%(7/11),而Non-GCB 型仅为36.4%(4/11);11 例MYC基因断裂者中9 例有随访结果,5 例GCB 型患者4 例死亡,而4 例Non-GCB型患者仅1例死亡,与文献所述结论基本一致,但因例数所限,本组病例中组织分型及预后的差异尚无统计学意义。本研究中p-AXL 表达与MYC断裂基因共表达者仅5 例,未能发现p-AXL 蛋白与MYC基因断裂之间具有显著性临床病理联系。
有研究[2,30]显示,男性DLBCL 患者预后较女性差,原因之一是由于不同性别体内的化疗药物代谢率不同,男性体内血浆中的利妥昔单抗(美罗华)清除率明显快于女性。当男性使用强化剂量的美罗华时,可消除由性别引起的治疗差异[2,31]。Kaplan Meier 生存曲线显示,男性且p-AXL 阳性患者的PFS 率和OS 率均明显低于不同时具备这两个条件的患者。Cox回归分析显示,虽然性别并不是DLB⁃CL 患者预后的影响因素,但男性和p-AXL 阳性两个因素并存却是患者PFS 和OS的独立危险因素(P<0.05)。这一结论与文献报道的男性患者预后较女性差相一致,但还需要更深入的研究以揭示其相关分子机制。
综上所述,本研究首次发现磷酸化受体酪氨酸激酶p-AXL蛋白在弥漫大B细胞性淋巴瘤中表达,且与c-MYC、BCL-2 的表达均显著性相关;p-AXL阳性表达与DLBCL 患者Hans 分型、化疗缓解率降低、无进展生存期及总生存期缩短显著性相关;p-AXL/c-MYC 协同表达、男性且p-AXL 阳性均可作为DLBCL的独立性预后指标。
致谢:本研究中组织芯片制作得到中山大学附属肿瘤防治中心病理科主任云径平教授、杨霞技师的大力支持,在此表示衷心感谢!

