癌相关成纤维细胞促进胃癌细胞迁移与侵袭
周 畅,陈伟强,王宇恒,杨晓夏,涂 幸,刘 靖,罗 利
(广东药科大学1.生命科学与生物制药学院;2.护理学院,广东广州 510006)
胃癌是我国第二大恶性肿瘤,是导致癌症相关死亡的第三大原因[1-2]。转移是导致胃癌治疗失败的原因之一,转移不仅与肿瘤自身有关,更与肿瘤细胞所处的微环境相关[3-4]。肿瘤微环境包括细胞外基质和多种间质细胞。肿瘤相关成纤维细胞(cancer associated fibroblasts,CAFs)是间质细胞中最丰富的细胞类型[5]。临床数据显示CAFs与胃癌预后密切相关[6]。然而CAFs对胃癌细胞转移能力的影响及相关机制仍未明确。胃癌转移是复杂的演变过程,“上皮-间质”转化(epithelial-to-mesen⁃chymal transition,EMT)是影响转移的重要因素[7]。EMT 指上皮细胞向成纤维细胞表型的转变并获得迁移的能力[8-9]。E-钙粘蛋白(E-cadherin)、波形蛋白(Vimentin)、N-钙粘蛋白(N-cadherin)是上皮-间质转化的重要标志物[10]。E-cadherin 可介导细胞粘附,抑制肿瘤转移[11]。Vimentin 和N-cadherin是间质细胞中的中间丝蛋白,参与细胞运动的调节[12-13]。有研究表明肺癌CAFs 内高表达EMT 相关基因,提示两者存在相关性[14]。另有报道显示CAFs 可诱导前列腺癌和乳腺癌细胞的EMT 进程[15-16]。但有关CAFs对胃癌细胞EMT 影响的研究较少。在本研究将通过细胞功能实验评估CAFs对胃癌细胞迁移和侵袭的影响;CAFs 作用于胃癌细胞后,通过光学显微镜观察胃癌细胞形态变化;通过荧光定量PCR 检测胃癌细胞中EMT 相关指标变化,以此证实CAFs 的促癌作用与胃癌中EMT 进程激活有关。
1 材料与方法
1.1 材 料
胃癌细胞株AGS 及MGC803 购自中国科学院上海细胞库;1640 培养基、DMEM/F12 培养基、PBS缓冲液、青链霉素、胎牛血清及胰酶均购自美国Hycolon 公司;DNA 酶、Ⅳ型胶原蛋白酶、透明质酸酶购自美国Sigma 公司;Vimentin 抗体、Alexa-Fluor 594 结合山羊抗兔IgG(H+L)二抗购自美国Proteintech 公司;DAPI 购自北京索莱宝公司;Trizol裂解液购自广州英伟创津公司;qRT-PCR 引物由武汉谷歌生物公司合成;qRT-PCR 检测试剂盒购自瑞士罗氏公司;细胞周期试剂盒购自上海碧云天公司;8.0 μm Transwell 小室购自美国康宁公司。
1.2 方 法
1.2.1 细胞培养 经广东药科大学临床医学伦理委员会的批准,收集3 例胃癌手术患者的肿瘤组织及相配对的正常粘膜组织(距离肿瘤组织最近边缘>5 cm),分别用于培养CAFs 及NFs。配置含DNA 酶溶液(2 mg/mL)、透明质酸酶溶液(20 mg/mL)、IV 型胶原蛋白酶溶液(20 mg/mL)、1%青霉素-链霉素双抗溶液、10%FBS的DMEM/F12培养基的组织消化液。在超净台内用含1%青霉素-链霉素双抗的PBS 溶液清洗组织块3次,剪碎组织块至1 mm3大小并加入组织消化液充分进行组织裂解。裂解液经筛网过滤,收集滤液离心(2 000 r/min,r=10 cm,10 min),弃上清,用含20% FBS 的DMEM/F12 培养基重悬细胞,并接种于24 孔细胞培养板内,在37 ℃,体积分数为5%CO2培养箱中培养。待细胞贴壁生长至融合度达到80%,用2.5 g/L 胰蛋白酶消化细胞进行传代。第3 代传代后细胞可用于后续实验。待细胞贴壁生长至融合度达到90%,弃去培养基,PBS 溶液清洗2 次,加入无血清的DMEM/F12 培养基。培养48 h 后,收集两种细胞的培养液并离心(2 000 r/min,r=10 cm,10 min),吸取上清冻存于-80 ℃冰箱。实验前解冻上述细胞培养液并加入10%FBS,此时获得两种细胞的条件培养基(NFs-CM、CAFs-CM)。胃癌细胞AGS 和MGC803 采用含10%FBS 的1640 培养基,在37 ℃,体积分数5%CO2培养箱中培养。
1.2.2 免疫荧光实验 2×104个NFs 或CAFs 在24孔板上爬行过夜,在4 ℃下用40 g/L 多聚甲醛固定30 min。预冷的100 μL 0.5%TritonX-100 室温下处理15 min,PBS 洗涤3 次。5% BSA 溶液37 ℃孵箱中封闭1 h,之后加入兔抗人Vimentin 多克隆抗体(1:200)4 ℃孵育过夜。标本中加入Alexa-Fluor 594结合山羊抗兔IgG(H+L)二抗(1∶500)在室温下避光孵育30 min 中,PBS 清洗后,加入DAPI 染色细胞核。最后用荧光显微镜对图像进行观察(放大倍率,200×)。
1.2.3 荧光定量PCR 检测 使用Trizol 试剂从细胞中提取总RNA,RNA 作为模板反转录成cDNA。按照荧光定量PCR 使用说明书检测α-SMA、FAP、E-cadherin、N-cadherin、Vimentin的表达水平,反应条件为∶95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火1 min,72 ℃下延伸34 s,40 个循环,肌动蛋白(Actin)用作内参。引物序列如表1 所示。检测每个模板的CT 值(C 代表周期,T 代表阈值)。2-ΔΔCT法计算基因的相对表达量。实验重复3 次,计算平均值。
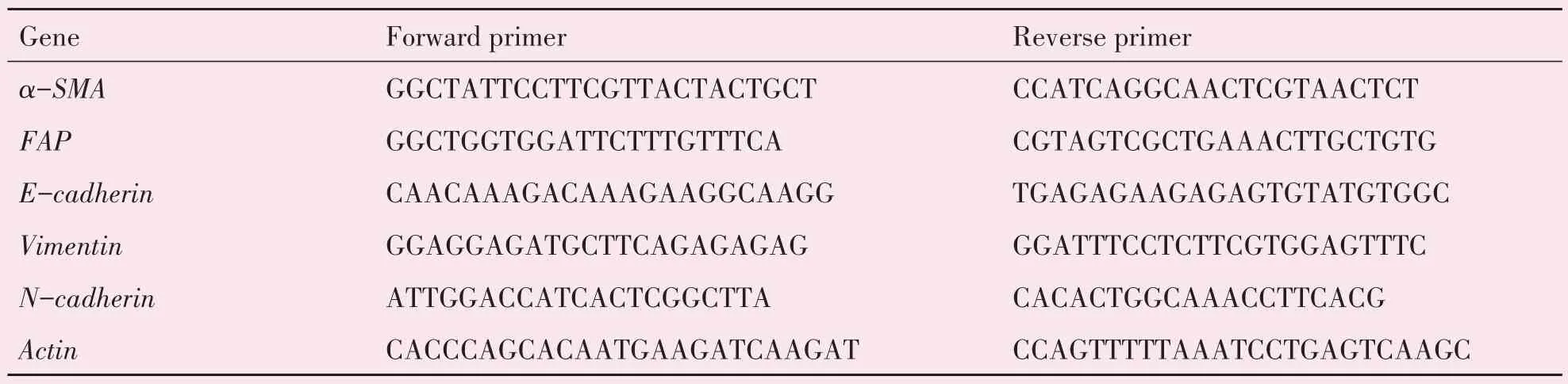
表1 检测基因的引物信息Table 1 The primer information of detected genes
1.2.4 细胞周期分析 收集1×106个NFs 和CAFs,PBS 洗2 次后,缓慢加入预冷的70%乙醇溶液中,4 ℃固定过夜。PBS 洗2 次后,加入细胞周期试剂盒中的碘化丙啶染色液(50 ng/mL)/RNase(0.2 mg/mL)/0.1%Triton X-100 混合液重悬细胞,并在37 ℃水浴箱中,避光孵育30 min。采用流式细胞仪检测细胞周期分布。
1.2.5 划痕试验 将5×105个AGS 接种于6 孔板中,用NFs-CM 和CAFs-CM 培养至细胞融合率达90%。MGC823 细胞也进行同样的处理。之后用10 μL 无菌移液管头垂直于培养孔底划3 条平行线,造成伤口。PBS 洗涤脱落细胞,之后加入无血清1640 培养基,置于37 ℃、体积分数为5% CO2培养箱培养,镜下观察0、24和48 h划痕愈合程度(放大倍率,200×)。
1.2.6 Transwell 细胞迁移和侵袭实验 侵袭试验将基质胶用预先冷却的无血清1640 培养基稀释(稀释比为1∶3),将50 μL 稀释后的凝胶加入Tran⁃swell 小室上室面并置入培养箱中2 h,将1×105个AGS用200 μL无血清培养基重悬后,接种于8.0 μm Transwell 小室上室,并将600 μL NFs-CM 或CAFs-CM 加入下室。在37 ℃和5%CO2的培养箱中培养48 h 后,取出Transwell 小室,弃去小室中培养液,PBS 清洗2 遍,在室温下用100%甲醇固定15 min。用棉签擦拭未穿Transwell 小室基底膜的细胞。膜用结晶紫染色15~20 min。迁移实验不铺基质胶,4×104个AGS 加入Transwell 小室上室,其他步骤同侵袭实验。在光学显微镜下选择5 个代表性视野进行拍照计数(放大倍率,200×)。MGC803 细胞迁移与侵袭实验的操作流程同上。
1.3 统计学分析
2 结果
2.1 NFs与CAFs 的分离培养及鉴定
NFs 和CAFs 分别从胃癌手术患者的配对的正常粘膜组织及胃癌组织中分离培养(n=3)。传代第3 代后的NFs 和CAFs 形状均为长梭形;但与NFs 相比,CAFs 多出现胞质突起,排列较紊乱,更易发生融合性生长(图1A)。为了检测NFs 和CAFs 的纯度,我们对这两种细胞株的间质细胞标记物——Vimentin 进行检测。免疫荧光结果显示NFs 和CAFs 均表达Vimentin(图1B)。后对CAFs 的特征性标记物α-平滑肌肌动蛋白(α-SMA)和成纤维细胞活化蛋白(FAP)进行检测,荧光定量PCR 结果表明:CAFs 中α-SMA 和FAP 的mRNA 表达水平高于NFs,差异具有统计学意义(α-SMA:t=17.847,P=0.000 058;FAP:t=7.698,P=0.016 456;图1C)。细胞周期实验常常用来反映细胞的增殖能力。流式细胞仪检测细胞周期分布结果显示:与NFs 相比,CAFs 的细胞周期主要分布在S 期,而相应的G1 期在细胞周期实验中减少,差异具有统计学意义(G1:t=3.793,P=0.019 218;G2:t=-3.169,P=0.033 903;S:t=4.379,P=0.011 888;图1D)。这些数据表明我们成功地从正常的胃粘膜组织中分离及培养NFs,并成功地从胃癌组织中分离及培养CAFs。
2.2 CAFs-CM促进GC细胞的迁移和侵袭
为了探索CAFs 对胃癌细胞的迁移和侵袭是否产生影响,我们收集NFs-CM(n=3)及CAFs-CM(n=3)作用于胃癌细胞并进行划痕实验,划痕实验结果显示无论在24 h 还是48 h,CAFs-CM 作用后的AGS 细胞迁移率高于NFs-CM 组细胞,差异有统计学意义(AGS 24 h:t=10.575,P=0.000 452;AGS 48 h:t=-5.270,P=0.006;图2A)。之后再利用Tran⁃swell 小室的方法检测细胞迁移及侵袭能力。迁移实验结果显示与NFs-CM组相比,CAFs-CM能增加AGS 细胞的迁移数量(t=-6.390,P=0.000 211;图2B)。在侵袭实验中,我们观察到与NFs-CM 组相比,当CAFs-CM 作为吸引血清时,AGS 细胞穿过基层胶的数量增加(t=-4.114,P=0.003 372;图2C)。类似的结果也在MGC803 细胞中得到证实。划痕实验结果显示无论在24 h还是48 h,CAFs-CM作用后的MGC803 细胞迁移率高于NFs-CM 组细胞,差异有统计学意义(MGC803 24 h:t=-7.690,P=0.001 538;MGC803 48 h:t=-8.572,P=0.001 017;图3A)。之后再利用Transwell 小室的方法检测细胞迁移及侵袭能力。迁移实验结果显示与NFs-CM 组相比,CAFs-CM 能增加MGC803 细胞的迁移数量(t=-10.826,P=0.000 005;图3B)。在侵袭实验中,我们观察到与NFs-CM 组相比,当CAFs-CM 作为吸引血清时,MGC803 细胞穿过基层胶的数量增加(t=-4.273,P=0.006 741;图3C)。总之,这些数据表明CAFs能促进胃癌细胞的迁移与侵袭。
图1 NFs和CAFs的生长特性与特异标记Fig.1 The growth characteristics and special molecular markers of NFs and CAFs

图2 CAFs体外促进AGS细胞迁移与侵袭Fig.2 CAFs promoted migration and invasion of AGS cells in vitro
2.3 CAFs-CM启动GC细胞EMT过程
为进一步探讨CAFs促进胃癌细胞迁移与侵袭的机制,我们通过光学显微镜镜观察到:与NFs-CM 组相比,CAFs-CM 作用后的AGS 和MGC803 细胞形态均由鹅卵石状的上皮细胞形态变为梭形、纺锤形的间质细胞形态。细胞变细,突起增多。同时,细胞之间的联系变得松散(图4A)。进一步荧光定量PCR 结果NFs-CM 组相比,CAFs-CM 组AGS 和MGC803 细胞中的上皮标志物E-cadherin表达(AGS:t=2.801,P=0.048 767;MGC803:t=5.933,P=0.004 046;图4B)均降低,间质细胞标志 物Vimentin(AGS:t=3.232,P=0.031 910;MGC803:t=-6.382,P=0.003 094;图4B)、N-cad⁃herin(AGS:t=-4.083,P=0.015 060;MGC803:t=-8.073,P=0.001 279;图4B)表达上升。结果表明,CAFs可通过调节EMT过程促进AGS和MGC803细胞的转移。
3 讨论

图3 CAFs体外促进MGC803细胞迁移与侵袭Fig.3 CAFs enhanced migration and invasion of MGC803 cells in vitro
我国是胃癌的高发高死亡地区。大部分胃癌患者就诊时已处于进展期,多数病人易出现转移现象[17]。胃癌的转移是多步骤、多因素参与的极其复杂的过程,其中最重要的一个因素是肿瘤细胞和肿瘤微环境的相互影响。在肿瘤微环境中,活化的成纤维细胞被称CAFs,可通过分泌生长因子和细胞因子作用于肿瘤细胞,促进肿瘤发生生长、血管的形成[18]。但CAFs影响胃癌进展的机制尚不清楚。
本研究成功分离并培养NFs 及CAFs,Vimentin在NFs 及CAFs 中的高表达证实两者具有纤维细胞的特征。尽管CAFs 表现出异质性,但是α-SMA 及FAP 常常被认为是区分CAFs 细胞和NFs 细胞的重要标志物。α-SMA 是肌纤维母细胞的典型标志,也是间质细胞活化的标志。当NFs 与肿瘤细胞接触后,可以自发地转化为α-SMA 高表达的成纤维细胞,从而获得CAFs 的表型特征。并且α-SMA 高表达的CAFs 更容易促进肿瘤的侵袭与转移[19]。FAP 属于丝氨酸蛋白酶,常在CAFs 表面高表达,具有胶原酶活性,能溶解细胞外基质(ECM)促进肿瘤转移[20]。本研究也同样发现α-SMA 和FAP 在所培养的CAFs中呈现高表达,证明所获得的CAFs处于肿瘤刺激下的成纤维细胞活化状态。细胞周期分析表明:CAFs 较NFs的S期分布增加,而G1期分布减少;此结果表明CAFs的增殖率高于NFs,CAFs细胞具有异常增殖的特点。
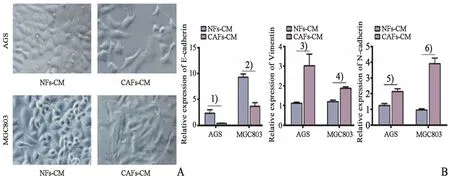
图4 CAFs调控AGS、MGC803细胞中的EMT变化Fig.4 CAFs caused EMT in AGS cells and MGC803 cells
为了探索CAFs 对胃癌细胞转移能力的影响。我们采用CAFs-CM 与胃癌细胞共培养的方式进行实验,这种培养方式可达到成纤维细胞与胃癌细胞非接触式生长,并保证了细胞间正常信号传导及相互影响,更接近于人体肿瘤微环境。细胞划痕实验证明:与NFs-CM 组相比,CAFs-CM 组创面愈合较快,说明CAFs 促进了AGS 细胞和MGC803 细胞的迁移。同时我们采用Transwell 迁移和侵袭实验研究CAFs-CM 对AGS 和MGC803 细胞迁移与侵袭的作用。我们发现CAFs 能促进AGS 和MGC803 细胞的迁移和侵袭。
最后我们对CAFs促胃癌细胞转移的机制进行了初步探究。EMT 在刺激许多癌症的侵袭性方面常发挥关键作用[8,10,21]。在本研究中,我们观察到与NFs-CM 组相比,CAFs-CM 处理的AGS 细胞和MGC803 细胞逐渐失去细胞间的连接,细胞变得松散,呈现长梭形外观。结果表明,AGS 细胞和MGC803 细胞由上皮细胞向间质细胞形态转化。此外,我们还对EMT 相关基因的表达进行检测。荧光定量PCR 检测表明:与NFs-CM 组相比,CAFs-CM 组上皮细胞标志物E-cadherin 表达下调,而间充质细胞标志物Vimentin 和N-cadherin 表达上调。这些结果证实CAFs 可以通过诱导EMT过程促进AGS细胞和MGC803细胞的生长。
在本研究中,我们成功地分离和培养了NFs 和CAFs。我们发现CAFs 可以通过诱发EMT 反应,促进AGS 细胞和MGC803 细胞的迁移和侵袭。今后,我们将继续深入探究CAFs通过哪些具体的分子信号通路影响胃癌细胞EMT的进程。

