组蛋白H3的22个赖氨酸去甲基化酶对胎鼠棕色脂肪细胞分化的调控作用
武晓慧,徐玉乔,张 丰,郜 松,魏佳昶,许久航,李 青,苏兴利
(1.西安医学院肥胖与代谢病研究所,陕西西安 710021;2.空军军医大学第一附属医院病理科暨病理学教研室,陕西西安 710032;3.空军军医大学学员队,陕西西安 710032;4.西安医学院教务处,陕西西安 710021)
随着社会经济的发展和人类生活方式的转变,肥胖成为全球范围内重大的公共卫生问题[1]。肥胖是由于长期的能量摄入和消耗的不平衡导致的。在减少能量摄入的同时,增加机体的能量消耗,是治疗肥胖的有效途径[2]。研究[3]表明棕色脂肪可以通过产热消耗大量的能量。在啮齿目动物体内,例如小鼠,其棕色脂肪可以终身存在,近年来采用PET-CT 技术发现成年人体内也存在棕色脂肪,可以利用棕色脂肪缓解人类肥胖和胰岛素抵抗[4-5]。深入了解棕色脂肪细胞的分化调控,可以为利用棕色脂肪产热耗能治疗肥胖提供更多的理论基础[6]。作为常用的棕色脂肪研究模式动物的小鼠,其棕色脂肪在胚胎期的分化过程尚不清楚,本文拟观察棕色脂肪分化的具体时间、形态学发展变化及重要调控基因的表达情况,为后续研究提供理论基础。表观遗传学调控机制中组蛋白H3 去甲基化酶Jmjd3和Utx被认为与小鼠棕色脂肪细胞分化密切相关[7-8],但其他的去甲基化酶研究较少,已经发表的研究均针对单个基因在出生后小鼠棕色脂肪中的功能展开,缺乏多基因表达的系统性研究,在胚胎期棕色脂肪分化中的研究更是空白。据报道,胎鼠白色脂肪出现时间是E16 d[9],课题组将实验时间点前移,收集了E13.5~E19.5 d不同孕龄的小鼠胚胎及其肩胛间区棕色脂肪组织(brown adipose tissue,BAT),探索随着小鼠胚胎的发育和棕色脂肪细胞的分化,组蛋白H3 四个常见的赖氨酸修饰位点:H3k4、H3k9、H3k27和H3k36目前已知的22种去甲基化酶的基因表达情况,为棕色脂肪分化调控提供更加系统化的研究基础,并发现一些可能发挥作用的基因,为进一步深入了解棕色脂肪细胞分化的调控及利用棕色脂肪进行肥胖治疗的相关研究提供理论依据。
1 材料与方法
1.1 收集E13.5-E19.5胎鼠
8 周龄C57BL/6J 雌性小鼠24 只,雄性小鼠8只,购于空军军医大学实验动物中心[实验动物为SPF 级,生产许可证编号:SCXK(陕)2019-001;使用许可证编号:SYXK(陕)2019-001];实验动物饲养于空军军医大学基础医学部动物房,室温保持在(25±2)℃,湿度保持在(55±5)%。动物自由进食、饮水,采用辐照后小鼠生长繁殖鼠粮(江苏协同),每天保持12 h 的昼夜循环光照。待动物适应1 周后,以雌雄比3∶1 的比例于前一天黄昏时合笼交配。次日晨取出雄鼠,并观察雌鼠阴栓,见栓者记E0.5 d,未见栓或者阴栓不明确者继续观察,2 周后,确定未怀孕的雌鼠重新合笼交配。以上方法可以避免假性见栓,确保怀孕时间的准确性。取孕E13.5-E19.5 d 的胎鼠进行实验。实验中所有操作符合空军军医大学和西安医学院实验动物伦理委员会标准。
1.2 组织学分析
剖腹取不同胎龄胎鼠,CO2处死后,剪开背部皮肤,整个胎鼠或取出的背部棕色脂肪组织用40 g/L多聚甲醛固定24 h。将胎鼠标本沿着体中轴矢状位剖开,常规脱水,剖面向下石蜡包埋,每个标本间断切片10 张,切片厚度3 μm,苏木素-伊红(Hema⁃toxylin-eosin,HE)染色。光学显微镜筛选观察并取典型部位拍照。
1.3 Realtime RT-qPCR 法检测基因表达
PCR 主要试剂:总RNA 提取试剂盒为RNAiso Plus(9108;Takara;日本),反转录试剂盒为Prime⁃Script RT Master Mix(RR036A;Takara)。进行Real⁃time-qPCR 的催化酶使用SYBR Green master mix(RR820A;Takara)。
因E15.5 以前的胚胎过小,不易取出较纯的棕色脂肪组织,实验中Realtime RT-qPCR 和Western blot 实验均取E15.5~E19.5 d 胚胎的BAT。BAT 加入RNAiso Plus 后匀浆,按照说明书提取各样本中的总RNA,Nanodrop ND-2000 超微量核酸蛋白测定仪测定所提RNA 的质量和浓度,反转录成cD⁃NA,Realtime qPCR 反应采用20 μL 体系在CFX96(C1000 Touch Thermal Cycler;Bio-Rad;美国)实时荧光定量PCR 仪上进行。以小鼠β-actin 为内参基 因,以2-ΔΔCT法计算各组的mRNA 相对表达量。PCR 反应程序:95 ℃预变性5 s,95 ℃变性5 s,56 ℃退火延伸30 s,40个循环。引物由大连宝生生物公司设计并合成,基因名称、全称及引物序列见表1。
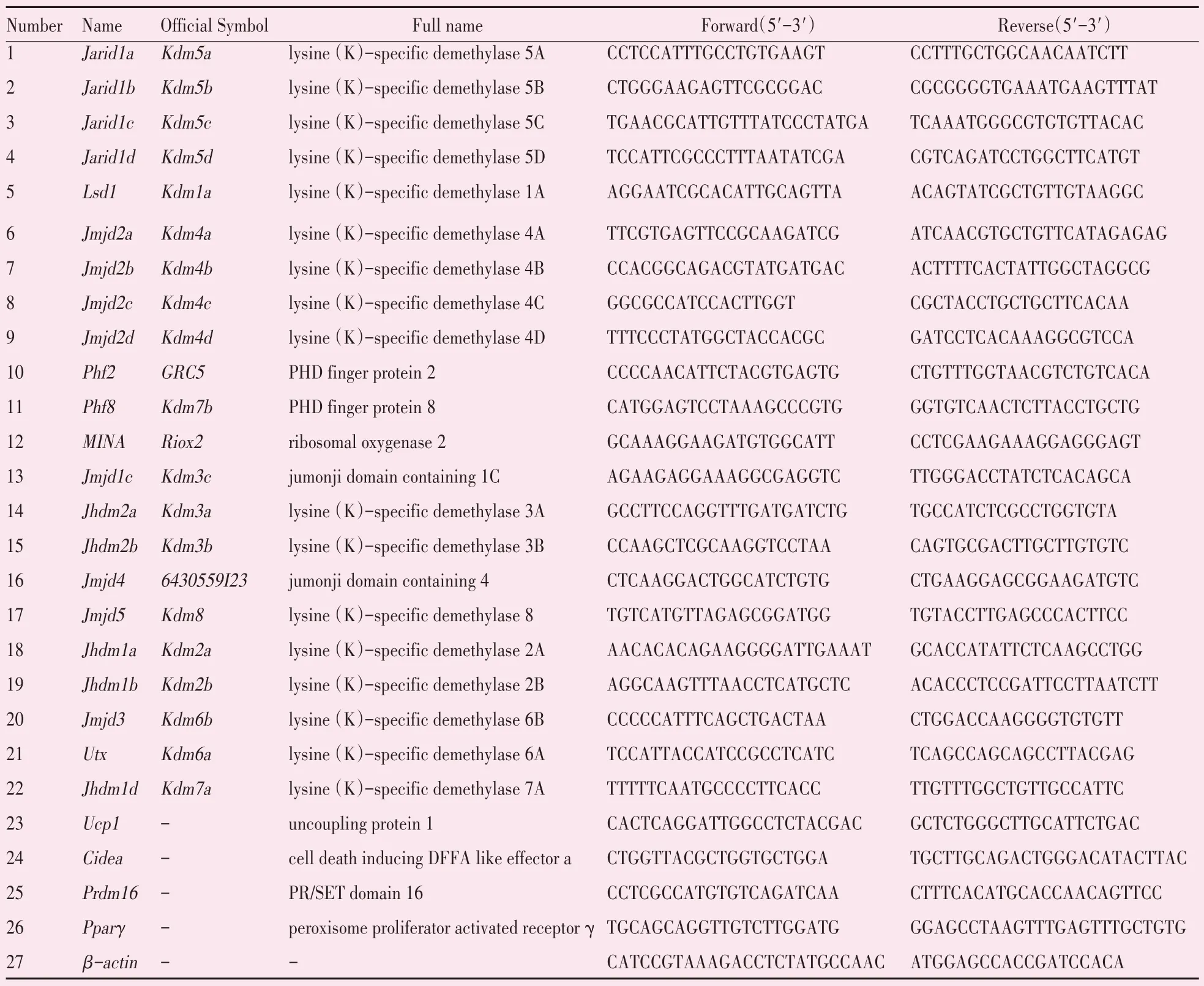
表1 被测基因及所用引物Table 1 Genes tested and primers
1.4 Western blot
提取BAT 总蛋白后测定蛋白含量,采用8%的SDS-Page 凝胶进行电泳分离蛋白,每孔蛋白上样量为20 μg。100V 湿法转膜1h 至PVDF 膜后5%脱脂奶粉室温封闭l h,1×PBST 洗膜5 min×3 次,一抗(Ucpl,兔抗,abcam,美国;β-Tubulin,鼠抗,天津三箭;浓度均为1∶1 000)中4 ℃孵育过夜。二抗(中杉金桥羊抗兔IgG/羊抗鼠IgG,浓度为1∶5 000)室温孵育1 h,配制ECL 发光液加至膜上目标蛋白所在处,凝胶成像仪采集图像。
1.5 统计学分析
数据用IBM SPSS Statistics 20.0 统计软件进行分析。符合正态分布的定量数据采用均数±标准差(Mean±SD)表示。组间比较方差齐时采用单因素方差分析(One-Way ANOVA),方差分析有统计学意义时,多重比较采用Bonferroni 法,所有统计学分析均为双侧检验,以P<0.05 为差异具有统计学意义。
2 结果
2.1 胎鼠棕色脂肪的形态学表现
实验收集了E13.5~E19.5的胎鼠背部棕色脂肪组织并HE染色后镜下观察,在E13.5 d小鼠背部肩胛间区未能观察到棕色脂肪组织;自E14.5 d 开始在胎鼠背部肩胛间区观察到了棕色脂肪组织,如黄色框选区所示。BAT 体积随着胎龄增加而逐渐增大(图1),在E18.5 d时光镜下可观察到棕色脂肪细胞内形成了脂滴(图1)。
2.2 胎鼠背部BAT中的棕色脂肪特异性标志基因表达增高
胎鼠BAT 的Realtime RT-qPCR 结果显示,相比于E15.5 d,E17.5~E19.5 d 的棕色脂肪标志物Ucp1(F=93.318,P=0.000)表达升高,差异有统计学意义,E17.5~E19.5 d 分别为(4.91±1.05)、(9.39±0.29)和(23.13±2.38)倍。Cidea(F=18.205,P=0.000)表达升高,差异有统计学意义,E16.5~E19.5 分别为(3.06±0.82)、(5.03±0.82)、(4.98±0.34)和(5.87±0.81)倍。Prdm16(F=105.429,P=0.000)的表达升高幅度较大,差异有统计学意义,E16.5~E19.5 d分别 为(7.87±1.47)、(7.59±0.57)、(18.02±1.63)和(27.94±2.33)倍。脂肪细胞分化通用标志物Pparγ(F=43.061,P=0.000;图2A)表达也升高,差异有统计学意义,E16.5~E19.5 分别为(4.34±1.06)、(5.72±0.48)、(8.07±0.55)和(8.29±0.67)倍。Western blot结果显示,Ucp1 蛋白表达随着棕色脂肪分化成熟表达升高(F=35.283,P=0.000;图2B),相比于E15.5 d,E17.5 d(P=0.001),E18.5 d(P=0.000)和E19.5 d(P=0.000)表达升高,差异有统计学意义。这些标志基因和蛋白的表达升高,与形态学分化逐渐成熟的表型相一致。
2.3 组蛋白H3 赖氨酸位点的22 个去甲基化酶基因呈差异化表达
取小鼠背部棕色脂肪提取RNA,对组蛋白H3的已知22 个去甲基化酶进行检测,以El5.5 d 的表达量为基准,计算El6.5~E19.5 d 的基因相对表达量。结果显示,在H3k4 的去甲基化酶中,Jarid1a表达降低,E16.5、E19.5 d差异有统计学意义(均P<0.01)。Jarid1b表达降低,E19.5 d 差异有统计学意义(P<0.01)。Jarid1c表达差异无统计学意义(P>0.05)。Jarid1d表达降低,在E16.5和E19.5差异有统计学意义(均P<0.001),而Lsd1则在E16.5~E1 9.5 均表达下降,差异有统计学意义(均P<0.001;图3A,表2)。
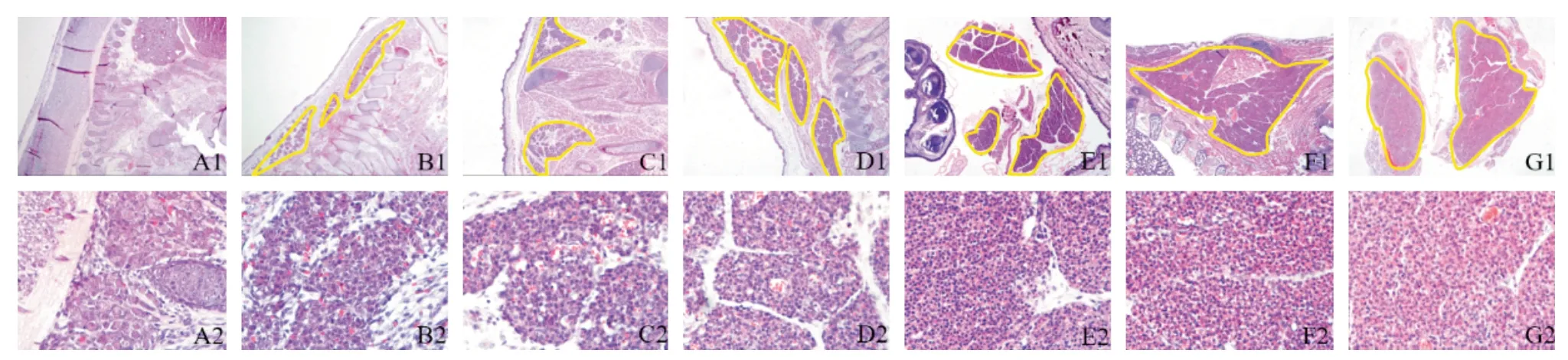
图1 小鼠背部棕色脂肪组织Fig.1 Brown adipose tissues in the back of mice
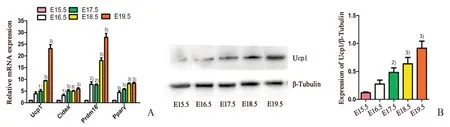
图2 胎鼠BAT中棕色脂肪细胞分化标志物的表达情况Fig.2 Expression of genes related to brown adipocytes differentiation in BAT of fetal mice
在H3k9 的去甲基化酶中,Jmjd2a表达降低,E16.5 和E19.5 差异有统计学意义(均P<0.001)。Jmjd2b表达降低,在E18.5、E19.5 差异有统计学意义(均P<0.05)。Jmjd2c表达降低,E16.5-E19.5差异有统计学意义(均P<0.01)。Phf2表达降低,E16.5 和E19.5 差异有统计学意义(均P<0.01)。Phf8表达有升高趋势,E16.5、E18.5、E19.5天差异有统计学意义(均P<0.05)。MINA表达差异无统计学意义(均P>0.05)。Jmjd1c表达降低,E16.5、E18.5、E19.5 d 差异有统计学意义(均P<0.05)。Jhdm2a表达减少,E16.5 和E19.5 差异有统计学意义(均P<0.05)。Jhdm2b表达升高,E16.5、E19.5 差异有统计学意义(均P<0.05)。Jmjd2d基因表达显著增高,E17.5、E18.5 和E19.5差异有统计学意义(均P<0.01;图3B,C,表2)。
在H3k36 的去甲基化酶中,Jmjd4表达在E16.5、E17.5、E19.5 d 均降低,差异有统计学意义(均P<0.05)。Jmjd5表达减少,E16.5,E18.5 和E19.5 差异有统计学意义(均P<0.01)。Jhdm1a表达在E18.5 表达增加,差异有统计学意义(P<0.001)。Jhdm1b在E16.5-E19.5 表达均降低,差异有统计学意义(均P<0.01;图3D,表2)。
在H3k27的去甲基化酶中,Jmjd3表达升高,在E17.5~E19.5 有明显的增加(均P<0.01),差异有统计学意义。Utx表达也有增高,E17.5~E19.5差异均有统计学意义(均P<0.001)。Jhdm1d表达升高,E17.5~E19.5 差异有统计学意义(均P<0.01;图3E,表2)。
3 讨论
近年来有多项研究表明表观遗传调控机制的组蛋白修饰在个体发育和细胞分化中发挥重要作用[10-11]。2015 年,有两项研究分别对H3k27me3 的去甲基化酶Jmjd3和Utx在棕色脂肪分化过程中的作用进行了研究[7-8],结果发现,Jmjd3和Utx在棕色脂肪分化的过程中,通过其酶活性,改变H3k27me3的甲基化状态,影响一系列基因的激活或沉默,对棕色脂防细胞的分化发挥促进作用。此外也有研究报道,Lsd1在棕色脂肪细胞的分化过程中发挥重要的作用[12]。因此我们推测,组蛋白H3 不同位点的去甲基化酶,可能在棕色脂肪细胞分化过程中发挥重要的调控作用。我们较为系统地筛查了组蛋白H3 常见赖氨酸位点的22 个去甲基化酶,在小鼠背部棕色脂肪分化过程中的表达情况。此外,小鼠胚胎期棕色脂肪分化的具体过程,日前并无相关报道,本研究对此过程进行了观察。
在实验中,我们发现,小鼠胚胎期棕色脂肪最早出现在E14.5 d 的胎鼠。先前有作者用荧光素酶标记的小鼠进行观察,发现白色脂肪最早出现于E16 d 的胎鼠[9],本研究发现,棕色脂肪最早出现于E14.5 d 胚胎,棕色脂肪细胞的分化早于白色脂肪,这间接支持了棕色和白色脂肪起源于不同祖细胞系的观点[13-14]。随后实验检测了小鼠背部棕色脂肪中棕色脂肪标志物的表达情况,发现Ucp1,Cidea,Prdml6这3 个棕色脂肪特异性标志物的表达[15]随着棕色脂肪细胞分化成熟,出现较为迅猛的增高。而Ucp1 的蛋白表达也表现为逐渐增高趋势。棕色脂肪最重要的功能是产热,以便帮助个体在出生后适应寒冷环境。其中线粒体内的解偶联蛋白1(Ucp1)是最重要的行使产热功能的分子,也是棕色脂肪细胞最有特异性的标志物。而脂滴则负责提供产热的能源。在E18.5 d 的棕色脂肪细胞中,首次观察到脂滴。Ucp1 的表达增加和脂滴的形成,表明胚胎在出生前的1~2 d 已经为出生后产热维持体温基本做好准备[16]。
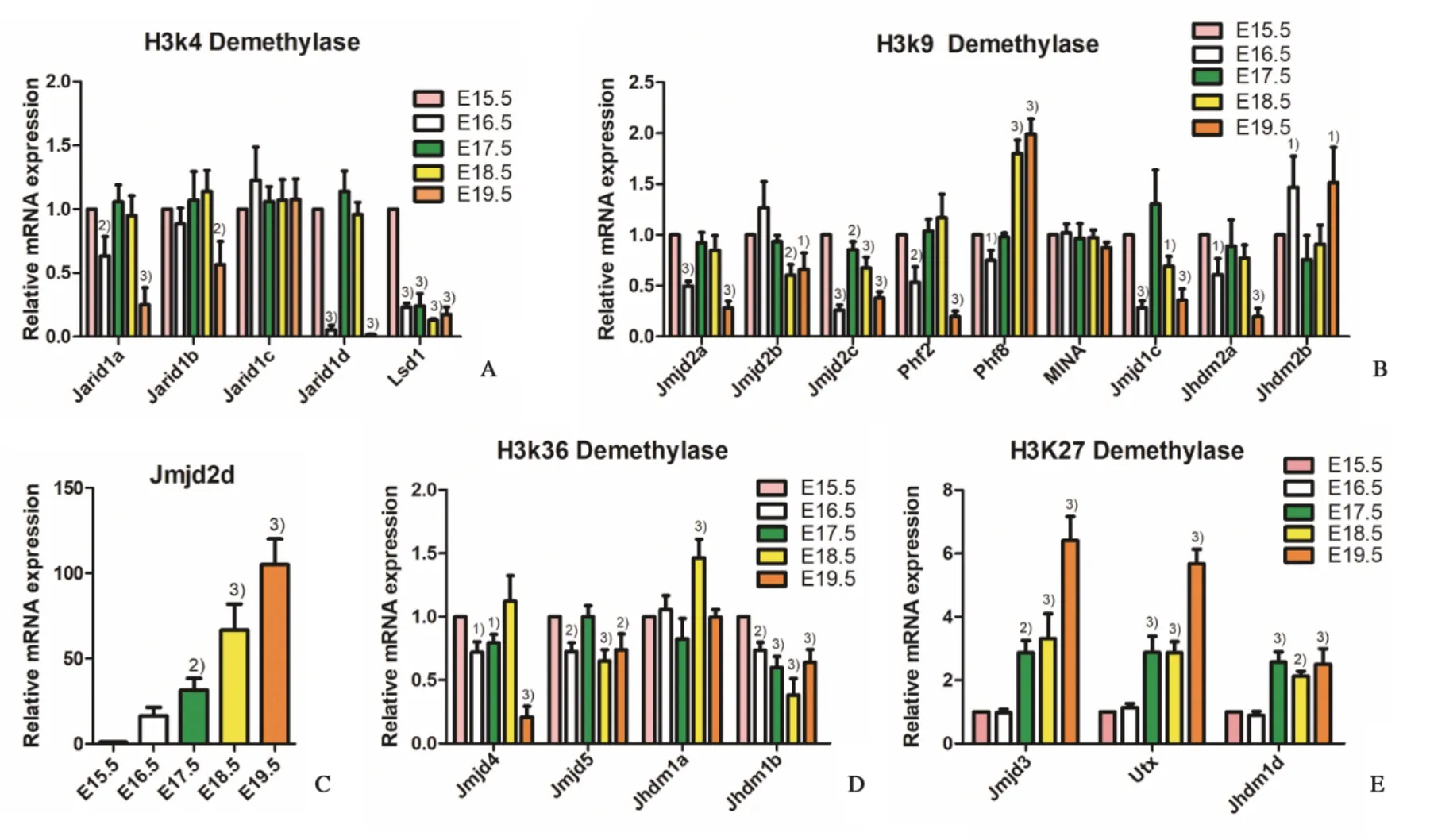
图3 胎鼠背部BAT中组蛋白H3k4、H3k9,H3k36和H3k27的22种去甲基化酶相对于E15.5天组的基因表达Fig.3 Gene expression of 22 demethylases of histones H3k4、H3k9,H3k36 and H3k27 relative to E15.5 group in BAT of fe⁃tal mice
我们选取了已知的组蛋白H3 的22 种去甲基化酶,对胎鼠背部肩胛间区的棕色脂肪组织进行了基因表达分析,以E15.5 d 为基准,计算E16.5~E19.5的mRNA 相对表达量。各组蛋白H3赖氨酸位点的甲基化修饰由甲基化酶和去甲基化酶共同承担,表现出此消彼长的动态平衡。H3k9 和H3k27 甲基化后主要表现为转录沉默,去甲基化后表现为转录激活[17-18]。实验结果中,H3k9 被检测的10 个去甲基化酶中,Jmjd2d,Phf8和Jhdm2b[19]表达升高,其余7 个去甲基化酶表达下调或无明显变化。这10 个去甲基化酶具有类似功能,均可催化H3k9 位点甲基擦除,部分去甲基化酶表达升高,部分表达降低,分析其原因,可能在分化过程中不需要全部去甲基化酶均参与其中,因而一部分去甲基化酶的表达发生了关闭,而另外几个去甲基化 酶Jmjd2d,Phf8和Jhdm2b高表达,即可发挥作用。
H3k27 的去甲基化酶Jmjd3,Utx和Jhdm1d的表达增高,表明这些酶在棕色脂肪分化过程中可能催化了H3K27 位点的甲基擦除,使得分化基因开始转录。其中Jmjd3和Utx已经有报道,可以促进棕色脂肪分化,但研究是在成年小鼠中进行的[7-8],本研究的结果表明,在胚胎期,这两个基因同样发挥促进棕色脂肪细胞分化的作用。
H3k4 甲基化后主要诱导转录激活,去甲基化后引起转录沉默[20]。筛查的5 个H3k4 位点的去甲基化酶均为低表达或表达无改变,这表明在胚胎期棕色脂肪细胞分化过程中,H3k4 的去甲基化酶是表达关闭的,使得抑制基因表达的H3k4 去甲基化修饰占据劣势,激活基因表达的甲基化修饰相对占据优势,配合H3K27 的去甲基化,将激活分化基因转录,分化得以进行。
H3k36 甲基化后表现为转录延长,去甲基化后延长受阻[21]。其去甲基化酶Jhdm1a仅在E18.5 一过性表达升高,其余时间点和其他去甲基化酶均为低表达或表达无明显变化,表现出以促进转录延长的效应为主。根据前述对其他H3位点去甲基化酶的表达分析,这些酶表现为转录激活效应为主的表达模式,与H3k36 位点的转录延长效应相协调,也就是在胚胎棕色脂肪细胞的分化过程中,这些表观遗传学调控机制形成复杂的调控网络,相互协调,以激活基因表达和促进转录延长的效应为主,最终使得细胞分化成熟。

表2 22种去甲基化作用底物及基因表达单因素方差分析结果Table 2 Substrates of 22 demethylation and gene expression analyzed by One-Way ANOVOA
综上所述,在小鼠胚胎期棕色脂肪细胞的分化过程中,H3k4 和H3k36 去甲基化酶基因主要为表达下调,H3k27 和H3k9 位点的几种去甲基化酶基因部分表达关闭,部分上调,最终呈现出转录激活和转录延长的表达模式。研究结果揭示了棕色脂肪细胞分化调控的复杂性,要想清楚地掌握棕色脂肪细胞分化调控机制,并利用棕色脂肪细胞耗能来治疗肥胖,还需要付出很大的努力,做大量的研究工作,才有可能实现在人体的应用。

