骨肉瘤细胞外泌体激活肺组织成纤维细胞炎性信号通路
谢显彪,温丽丽,吕东明,李洪波,刘伟海,邹雨桐,姚 浩,沈靖南
(1.中山大学附属第一医院骨肿瘤科,广东广州 510058;2.广东省骨科学重点实验室,广东广州 510058;3.中山大学肿瘤防治中心麻醉科,广东广州 510060)
骨肉瘤是青少年最常见的原发恶性骨肿瘤,其致死、致残率较高。随着新辅助化疗及外科手术技术的进步,目前骨肿瘤5 年生存率提高到60%左右。研究[1-2]表明80%骨肉瘤患者在临床诊断时已经存在肺部微转移灶,20%患者在确诊骨肉瘤时就已发现有临床确定的肺转移灶,其余在确诊时未发现肺部转移的患者20%~50%在治疗过程中发生肺转移。因此,控制骨肉瘤肺转移是进一步提高骨肉瘤患者生存率的关键所在。最新研究[3]发现肿瘤细胞来源外泌体可通过介导与远处靶器官常驻细胞间的通讯,在靶器官转移前微环境调控中发挥重要作用。目前骨肉瘤细胞外泌体介导靶器官微环境调控的研究尚少。因此,本研究主要是探讨骨肉瘤细胞源性外泌体介导的靶器官微环境调控作用及机制,为骨肉瘤远处转移的治疗提供实验依据及理论指导。
1 材料与方法
1.1 细胞株与细胞培养
骨肉瘤细胞株143B 和人肺成纤维细胞HPF 均购于ATCC,在含10 g/L 胎牛血清、1%青霉素和链霉素的DMEM 培养液中,置于37 ℃及体积分数为5%CO2培养箱中培养,2~3 d传代1次。
1.2 药物与试剂
外泌体标志分子抗体TSG101、Flotillin-1、CD9、CD63 及calnexin(上海艾博抗生物科技有限公司,货号:ab125011、ab41927、ab92726、ab134045、ab92573),p-p38、p-p65、p-ERK、GAPDH 抗体(CST公司,货号:4511、3033、4370、5174),胎牛血清、DMEM、青霉素和链霉素双抗溶液(广州天骏生物科技有限公司,货号:10270-106、C11995、03-034-1B),IL-1β、IL-6和TNF-α 引物购于广州锐博生物技术有限公司。引物序列如下:IL-1β 上游引物序列:ATGATGGCTTATTACAGTGGCAA,下游引物序列:GTCGGAGATTCGTAGCTGGA;IL-6 上游引物序列:ACTCACCTCTTCAGAACGAATTG,下游引物序列:CCATCTTTGGAAGGTTCAGGTTG;TNF-α 的上游引物序列:CCTCTCTCTAATCAGCCCTCTG,下游引物序列:GAGGACCTGGGAGTAGATGAG;GAPDH 上游引物序列:GAGTCAACGGATTTGGTC⁃GT,下游引物序列:TTGATTTTGGAGG GATCTCG。
1.3 外泌体提取及鉴定
4 ℃3 000 ×g离心15 min 去除细胞及细胞碎片;将上清液转移至无菌管中,加入2 mL 的Exo⁃Quick-TC 沉淀液,反复颠倒3 次使其混匀;4 ℃过夜;1 000×g离心ExoQuick-TC 混合液30 min。离心后,收集管底外泌体沉淀,BCA 试剂盒定量外泌体蛋白浓度,样品可立即使用或冻于-80 ℃备用。
取5 μL 外泌体样品悬浮于已覆膜的铜网上,室温静置使其稍干燥后将外泌体样品用3% 磷钨酸负染固定,用透射电镜下观察,在80 kV 下观察并以50 000 倍拍照;Western Blot 验证外泌体表面特异性分子标志;将外泌体样品用过滤以PBS稀释后,上纳米颗粒跟踪分析(NTA)机测试,得出相关外泌体粒径大小。
1.4 动物试验
4 周龄雌性SPF 级裸鼠,购于南京大学-南京生物医药研究院,动物质量合格编号为No.32002100005788,严格遵照《实验动物环境及设施国家标准(GB14925-2001)》规定,根据中山大学附属第一医院动物实验中心的实验动物操作标准进行动物实验。使用荧光染料PKH26 标记外泌体30 μg,经尾静脉注射入裸鼠体内,24 h 后提取动物肝、脾、肺、肾及脑组织切片、固定,通过荧光显微镜拍摄观察外泌体在不同器官中摄取情况,并对红色荧光区域进行量化分析[11]。
1.5 免疫荧光染色
石蜡切片经脱蜡、梯度酒精脱水后,进行抗原修复,然后用PBST漂洗3次,置于10 g/L BSA,37 ℃湿盒中封闭30 min;在标本上先后滴加适当稀释的一抗、二抗进行孵育,最后洗去多余的荧光素标记抗体,封片,在荧光显微镜下观察。
1.6 蛋白印迹法
收集107个细胞于预冷的EP 管中,向EP 管中加入裂解缓冲液(7 mol/L urea,2 mol/L thiourea,4%CHAPS,65 mmol/L DTT,0.5 mmol/L EDTA,2 mmol/L PMSF)后反复吹打;冰上静置30 min,4 ℃15 000×g离心60 min,取上清即为总蛋白质。将蛋白样品进行SDS电泳后电转移至PVDF膜上,体积分数5%脱脂牛奶室温封闭1 h;1:1 000 的一抗4 ℃孵育过夜;二抗(1:10 000)室温孵育1 h,最后用X 线片暗室发光。收集图像并用Image J 软件对得到的Western Blotting图片条带进行灰度值分析。
1.7 逆转录-聚合酶链式反应
把细胞接种在6 孔板中,当细胞近90%融合时,用Trizol 试剂提取总RNA 并检测浓度,使用Ta⁃kara 试剂盒逆转录为cDNA。RT-qPCR 按照SYBR-Green PCR 试剂盒的说明书操作。扩增反应条件为:预变性95 ℃30 s;PCR 反应95 ℃15 s,60 ℃1 min,循环35次。用GAPDH 标准化,每个样品重复3次,用2-ΔΔct方法分析结果。
1.8 统计学方法
统计学分析采用SPSS 21.0 软件,图形处理使用GraphPad Prism 8.0。每组实验均重复3 次,数据以均数±标准差描述;两组间比较,若呈正态分布且方差齐的则用t检验;若呈正态分布但方差不齐的数据则采用秩和检验。多组计量资料数据比较,若符合正态分布及方差齐性时用one-way ANOVA 分析方法;若数据非正态或方差不齐时用Kruskal-WallisH检验;多组间比较有差异时,组间两两比较用Bonferroni 法。检验水准α=0.05(双侧),P<0.05为差异具有统计学意义。
2 结果
2.1 骨肉瘤细胞源性外泌体鉴定
WesternBlot 检测可见143B 细胞外泌体中标志蛋白TSG101、Flotillin-1、CD63和CD9均存在表达,内质网来源的钙联接蛋白(Calnexin,CANX)则表达缺失(P<0.05;图1A);透射电镜下观察发现提取的外泌体具有清晰的“茶托”样形状(图1B);进一步使用纳米颗粒跟踪分析(NTA)技术检测外泌体大小,发现143B 细胞外泌体直径为(141.92±52.85)nm,在147 nm处出现峰值(图1C)。
2.2 骨肉瘤细胞源性的外泌体主要分布于裸鼠肺组织中
我们将PKH26红色荧光染料标记的143B细胞外泌体30 μg,经尾静脉注射进入裸鼠体内,24 h后提取实验动物肺、肝、脾、肾及脑等组织并切片,在荧光显微镜下摄片并在不同视野计数外泌体阳性细胞数,发现肺组织中摄取外泌体的量显著高于肝、脾、肾及脑等组织(P<0.05;图2)。
2.3 肺成纤维细胞摄取骨肉瘤细胞来源外泌体
为了观察143B 细胞外泌体在肺组织中被哪类细胞所摄取,进一步将肺组织常驻细胞成纤维细胞、巨噬细胞、内皮细胞分别采用相应标志分子S100A4、F4/80、CD31 进行免疫荧光标记,激光共聚焦观察发现红色荧光标记的外泌体主要集中在S100A4阳性的肺组织成纤维细胞中(图3A)。体外实验将提取的143B 细胞外泌体与人肺成纤维细胞共培养4 h 后,荧光显微镜下观察可见肺成纤维细胞大量摄取骨肉瘤细胞外泌体(图3B)。
2.4 骨肉瘤细胞外泌体激活肺组织成纤维细胞炎性信号通路
体外实验将143B 外泌细胞体与肺成纤维细胞共培养24 h 后,通过RT-qPCR 检测发现成纤维细胞中炎性因子IL-1β、IL-6 及TNF-α 的mRNA 表达水平明显升高(P<0.05;图4A);进一步利用West⁃ern blotting 检测炎性信号通路NF-κB 的关键分子p-p65 及MAPK 信号通路的关键分子p-ERK 及pp38,发现经外泌体处理后肺成纤维细胞中p-p65、p-ERK 及p-p38 磷酸化水平显著升高(P<0.05;图4B、C)。
3 讨论

图2 外泌体在小鼠体内器官间的分布情况Fig.2 Distribution of exosomes in organs of mice
随着肿瘤转移“种子与土壤学说”的提出和研究深入,研究者们指出肿瘤细胞在转移前其靶器官已经优先活化,靶器官在转移前微环境改变为肿瘤向该组织转移提供极其有利的条件[4-5]。目前肿瘤细胞源性外泌体通过介导与远处靶器官常驻细胞间通讯,调控靶器官转移前微环境,已经成为肿瘤转移方面研究焦点[6-7]。Rana 等[8]研究发现胰腺癌细胞通过外泌体介导淋巴结间质细胞及肺成纤维细胞间通讯,调控淋巴结及肺组织的转移前微环境,进而促进胰腺癌淋巴结及肺转移。本研究中我们将荧光染色的骨肉瘤细胞外泌体经尾静脉注射入裸鼠体内,发现在肺组织中存在外泌体特异性聚集的现象;随后将肺组织常驻细胞成纤维细胞、巨噬细胞和内皮细胞进行免疫荧光标记,发现外泌体主要集中在S100A4 阳性的肺组织成纤维细胞中。骨肉瘤作为血道转移性肿瘤的典型代表,95%以上的远处转移部位发生在肺,本研究结果证实骨肉瘤细胞来源的外泌体主要被肺组织的成纤维细胞所摄取,这提示骨肉瘤细胞外泌体可能通过成纤维细胞促进肺组织的转移前微环境的形成。
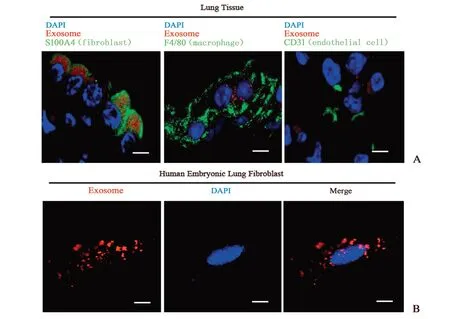
图3 肺成纤维细胞摄取骨肉瘤细胞来源外泌体Fig.3 Lung fibroblast cells ingested the osteosarcoma cells derived exosomes
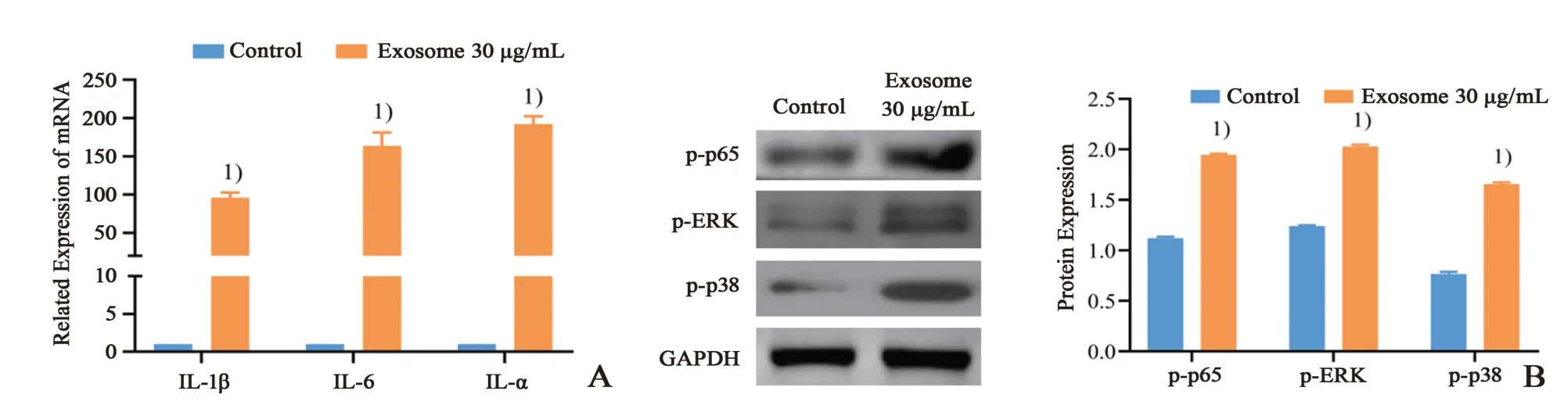
图4 肉瘤细胞外泌体激活肺组织成纤维细胞炎性信号通路Fig.4 Osteosarcoma cells derived exosomes activated inflammatory signaling of lung fibroblast cells.
外泌体内包含蛋白质、microRNA、mRNA、DNA等多种生物活性分子,进入靶器官后可介导出现持续炎症反应、骨髓干细胞聚集、基质重塑、氧自由基增多以及生物活性致癌因子富集等多种现象,促进靶器官的转移前微环境形成,为肿瘤的远处转移创造条件[4-5,9]。Hoshino 等[10]报道外泌体表面的整合蛋白能够协助肿瘤到达特定远处转移器官常驻细胞,增强与受体细胞的黏附作用,通过激活p-Src,上调促炎因子S100 表达,活化炎性通路,从而促进肿瘤的转移。Fang 等[11]发现具有高转移能力的肝癌细胞分泌的外泌体,通过miR-1247-3p 直接作用于B4GALT3,导致人肺成纤维细胞β1-integrin-NF-κB 信号通路的激活。活化的癌相关成纤维细胞进一步分泌促炎因子IL-6 和IL-8 等促进肿瘤进展。本研究结果表明143B 细胞外泌体与人肺成纤维细胞共培养后,外泌体被成纤维细胞大量摄取,同时炎性因子子IL-1β、IL-6 及TNF-α 的mRNA 表达水平明显升高,炎性信号通路NF-κB 的关键分子p-p65 及MAPK 信号通路的关键分子p-ERK 及p-p38 磷酸化水平显著升高。这提示骨肉瘤细胞外泌体刺激后肺成纤维细胞内的炎性信号通路活化,使得炎性因子表达显著升高,进一步促进肺组织局部形成炎性微环境。
炎性信号通路活化是转移前微环境的重要特征之一,在肿瘤转移中发挥重要作用。研究表明炎性因子TNF-α 可诱导活化S100A8-SAA3-TLR4 通路并刺激肺组织Clara 细胞,上调SAA3 表达来促进肺部转移前炎症微环境的形成,促进肺转移的发生[12]。炎症因子IL-6 通过TLR5 介导表达上调、构建局部缺氧环境,进而促进转移前炎性微环境的形成,促进肿瘤转移[13]。Mac1+髓系细胞在粒细胞集落刺激因子作用下可进入靶器官,产生大量MMP9、S100A8、S100A9 等蛋白,这些分子可驱化髓系细胞、促进肿瘤细胞归巢;S100A8/9诱导肺组织产生SAA3,并通过TLR-4 介导活化NF-κB 炎症通路,促进分泌炎症因子IL-1β、单核细胞趋化蛋白-1、基质细胞衍生因子-1 及巨噬细胞源趋化因子等调控靶器官炎性微环境,促进肿瘤靶器官转移[14-15]。
综上所述,本研究表明骨肉瘤细胞来源性外泌体可以激活肺成纤维细胞NF-κB 及MAPK 炎性信号通路,促进炎性因子IL-1β、IL-6及TNF-α 产生,进而促进肺组织局部炎性微环境的形成。本文为研究骨肉瘤肺转移的发生机制及诊断治疗提供实验依据和理论基础。

