腹腔注射四氢姜黄素对卵清蛋白诱导过敏性哮喘小鼠的治疗作用
武音帆,李 琴,邹进超,毛钰蘅,郭兴悦,陈彦球,杨 燕
(1.中山大学公共卫生学院,广东广州 510080;2.广东省营养与健康重点实验室,广东广州 510080;3.广东省营养转化工程技术研究中心,广东广州 510080;4.中山大学公共卫生学院(深圳),广东深圳 518000;5.广州市妇女儿童医疗中心耳鼻喉科,广东广州 510623)
近20 年来过敏性鼻炎、哮喘等气道炎症发病率不断升高[1-2],其影响因素和发病机制错综复杂,而防治关键在于及时有效地控制病情[3]。糖皮质激素作为过敏性气道炎症发作时的首选药物在临床上广泛引用[4-5],可快速缓解呼吸道症状,但长期依赖激素治疗引起的副作用也不容忽视,如骨质疏松、发音障碍以及儿童生长发育迟缓等[6-9]。因此选择安全性更高的营养素作为辅助或替代性防治手段得到了越来越多的关注,例如姜黄素、花色苷、白藜芦醇以及维生素D 等已被证实具有良好的抗哮喘功效[10-14]。由于此类营养素的生物利用度极低,通过膳食补充难以在较短时间内发挥保护效应[15-16],而采用注射的方式能够帮助其更快起效:例如给予哮喘小鼠腹腔注射维生素D,可在短时间内缓解呼吸道症状和减轻炎症反应[17-18],从而发挥更高的临床应用价值。四氢姜黄素(terahydrocurcumin,THC)是姜黄素的主要代谢产物,具有比姜黄素更强的抗炎、抗氧化等生物学功效[19-21]。动物实验发现,THC 在急性肾损伤、缺血再灌注以及肝脂肪病变、癌症等多种急、慢性疾病中均起到保护作用[19,22-23]。本课题组前期的研究结果已证明长期膳食补充THC 可有效抑制哮喘小鼠气道炎症反应,且防治效果优于姜黄素[24],然而THC 能否通过注射的方式在哮喘发作时更快地控制病情,值得更进一步的研究。因此,本研究通过腹腔注射THC 对过敏性哮喘小鼠进行治疗,观察短期THC 干预对小鼠呼吸道症状和炎症反应的控制效果,探讨THC 能否作为过敏性哮喘的一种替代性治疗手段。
1 材料与方法
1.1 实验动物
4 周龄雌性BALB/c 纯系小鼠(20 只)购买于中山大学动物实验中心,并饲养于中山大学公共卫生学院SPF 级动物房,实验动物相关操作符合动物实验伦理规定,获得中山大学动物伦理委员会批准,许可证号:SYXK[粤]2017-0080。
1.2 仪器和试剂
卵清蛋白(ovalbumin,OVA)(Sigma A5503 纯度5 级),氢氧化铝(Sigma A8222),AIG 95G 饲料(江苏美迪森),四氢姜黄素(上海源叶),地塞米松(dexamethasone,DEX)压缩空气式雾化器(江苏鱼跃),ELISA 试剂盒(eBioscience),破膜破核剂(eBioscience),胶原酶(Sigma),DNaseⅠ(Roche)、细胞刺激剂(eBioscience),流式细胞术抗体CD3e(PE-eFluor®610)、CD4(APC-eFluor®780)、CD8a(FITC)、IFNgamma(APC)、IL-17A(PE)、IL-4(PECyanine7)、CD25(PE-Cyanine7)、IL-10(APC)、Foxp3(PE)购自eBioscience。
1.3 分组及处理
实验动物按随机数表法分为4 组(n=5):空白对照组(PBS)、模型组(OVA)、阳性对照组(OVA+DEX)和THC 治疗组(OVA+THC)。过敏性气道炎症小鼠模型的建立同本课题组已发表文献[11,24],主要步骤为:实验第0、7 和14 天腹腔注射200 μL OVA 致敏液(含40 μg OVA 和4 mg 氢氧化铝),间隔1 周后即第21~25 天,每日通过空气压缩雾化器雾化吸入5 mL 5% OVA 溶液,持续30 min 后使用40 μg/μL OVA 进行滴鼻处理(两侧鼻腔各滴入10 μL)。阳性对照组和THC 治疗组小鼠在每次激发前分别经腹腔注射给予2.5 mg/kg DEX 或20 mg/kg THC,空白对照组小鼠使用PBS 进行相应处理(图1A)。
1.4 组织病理学分析
取左肺叶浸泡于40 g/L 多聚甲醛固定,经石蜡包埋,切片后进行常规苏木精-伊红(hematoxy⁃lin-eosin,HE)染色和过碘酸雪夫(periodic acidschiff,PAS)染色,光学显微镜下分别观察肺组织炎症细胞浸润及气道上皮杯状细胞增生及粘液分泌水平。组织病理学评分方法参考已发表文献[25]:根据支气管增厚以及支气管周、毛细血管周和薄壁组织中炎性细胞浸润的指标,按照严重程度分为0~4 分。采用Image J 软件测定PAS 阳性区域的百分比,进而评估杯状细胞增生和粘液分泌水平。
1.5 流式细胞术分析肺组织T细胞亚型
新鲜肺组织经过剪切、研磨和消化获取单细胞悬液,然后加入细胞刺激剂于二氧化碳培养箱中37 ℃培育5 h。刺激后使用相应抗体进行表面染色,破膜破核后继续进行核内染色,将所得样本加入200 mL BufferⅡ重悬,上机检测,检测结果用FlowJo软件分析各类T细胞亚型。
1.6 肺泡灌洗液(BALF)中细胞因子检测
BALF 中Th2 细胞因子白介素(interleukin,IL)IL-4、IL-5、IL-13,Th17 细胞因子IL-17A,Th1 细胞因子干扰素(interferon,IFN)IFN-γ 和Treg 细胞因子IL-10 的检测使用酶联免疫吸附法(ELISA),具体方法参照试剂盒说明书进行。检测结果使用多功能酶标仪进行读数。
1.7 统计学分析
2 结果
2.1 THC 对OVA 激发引起的小鼠体质量变化和摄食水平无显著影响
通过监测和记录小鼠体质量变化,发现实验的第0~21 天(即小鼠致敏阶段),各组小鼠体质量稳定增长。第21~25天(即OVA激发阶段),除正常对照组外各组小鼠体质量均出现不同程度的负增长趋势(图1B)。激发前后体质量差值在正常对照组和OVA 组之间差异显著(P<0.05,图1B,C),而THC 和DEX 未能有效缓解OVA 引起的小鼠体质量丢失(图1B、C)。各组间小鼠每日摄食量差异无统计学意义(P>0.05;图1D)。
2.2 THC减轻小鼠鼻部症状和减少挠鼻频率
OVA 末次激发后,观察小鼠胡须状态,以及计数各组小鼠10 min 内挠鼻次数(重复3 次并进行统计分析)。与正常对照组相比,模型组小鼠表现烦躁不安、抓挠频繁以及弓背呼吸,其鼻部皮肤暴露、鼻周胡须明显较短或丢失,且挠鼻频率显著升高。THC 或DEX 治疗组小鼠鼻部毛发保存较为完整,挠鼻频率明显低于模型组,差异具有统计学意义(P<0.05;图2),其中THC与OVA两组均数之差为5.2,其95%置信区间(CI)为0.66~9.74,DEX 与OVA两组均数之差为10.6,其95%CI为6.06~15.14。进一步比较发现DEX 治疗组挠鼻频率比THC治疗组明显更少,差异具有统计学意义(P<0.05;图2),两组均数之差为-5.4,其95%CI为-9.94~-0.86。
2.3 THC 减少小鼠肺部炎性细胞浸润和杯状细胞增生

图1 小鼠体质量和摄食量变化Fig.1 Changes of mice’s body weight and food intakes
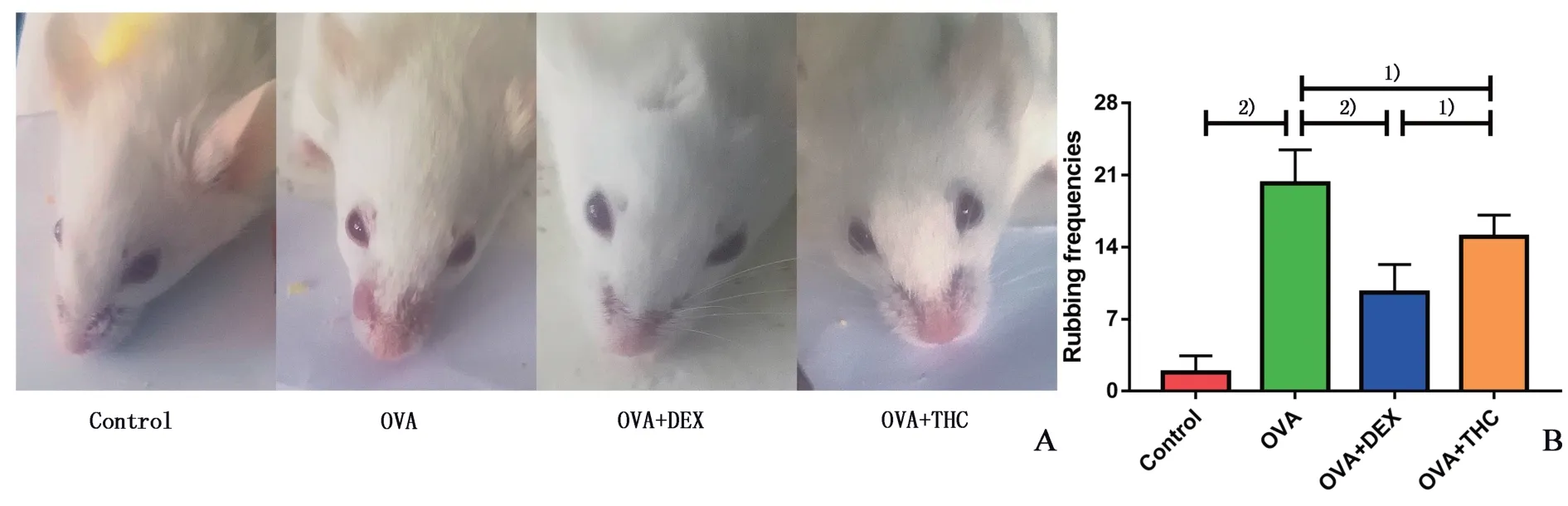
图2 小鼠鼻部症状和挠鼻频率Fig.2 Nasal symptoms and rubbing frequencies of OVA-induced mice
小鼠肺组织切片HE染色后镜下观察和进行病理评分,发现与正常对照组相比,模型组小鼠支气管和血管周炎性细胞浸润明显增加、支气管壁增厚,而THC 或DEX 治疗组小鼠炎性细胞浸润和其管壁增厚症状显著减轻(P<0.05;图3A、B),其中THC与OVA两组均数之差为1.6,其95%CI为0.32~2.88,DEX 与OVA 两组均数之差为2,其95% CI 为0.72~3.28,两组治疗组间病理学评分差异无统计学意义。PAS 染色可见模型组小鼠气管上皮杯状细胞增生明显,粘液分泌增加,THC 或DEX 治疗可明显抑制杯状细胞增生以及粘液分泌(P<0.05,图3C 和D),其中THC 与OVA 两组均数之差为9.56,其95%CI为5.05~14.07,DEX 与OVA 两组均数之差为13.81,其95% CI 为9.3~18.31,两组治疗组间差异无统计学意义。
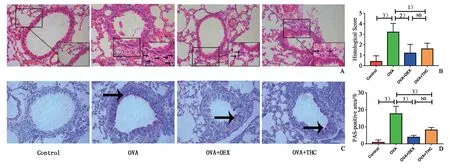
图3 小鼠肺组织病理染色及分析Fig.3 Histopathology changes of lungs in each group
2.4 THC 抑制小鼠肺部Th2和Th17细胞
通过流式细胞术检测小鼠肺组织中Th 细胞亚型的百分比,评估肺部免疫反应类型和程度。发现OVA 组小鼠肺组织中Th2(CD3+CD4+IL-4+)和Th17(CD3+CD4+IL-17A+)型T细胞百分比与正常对照组相比显著升高。THC 和DEX 治疗均可有效抑制Th2 和Th17 细胞的过度分化,差异有统计学意义(P<0.05;图4A、B),其中THC 与OVA 两组均数之差分别为1.49 和2.15,其95%CI 分别为0.50~2.49和0.72~3.58,DEX 与OVA 两组均数之差分 别为2.64 和2.98,其95% CI 分 别为1.65~3.64 和1.56~4.41。进一步比较发现DEX 治疗组小鼠肺部Th2细胞百分比低于THC 治疗组,差异有统计学意义(P<0.05;图4A、B),两组均数之差分别为-1.15,其95%CI 分别为-2.15~-0.16。Th1 和Treg 细胞百分比在各组间差异无统计学意义(P>0.05;图4C、D)。
2.5 THC 降低BALF中Th2和Th17细胞因子水平
使用ELISA 试剂盒检测BALF 中Th2(IL-4、IL-5 和IL-13)和Th17(IL-17A)促炎性细胞因子水平。与正常对照组相比,模型组小鼠IL-4,IL-5、IL-13 和Th17 IL-17A 细胞因子水平显著升高,经THC 或DEX 治疗后,IL-4、IL-5、IL-13和IL-17A 的水平均明显降低(P<0.05,图5A-D),THC 和OVA两组均数之差分别为5.45、4.13、5.17 和2.44,其95%CI 分别为1.95~8.94、1.08~7.19、0.80~9.54 和-0.30~5.17,DEX 和OVA 两组均数之差分别为9.14、8.76、6.13 和3.74,其95%CI 分别为5.65~12.63、5.71~11.81、1.76~10.5 和1.01~6.48。进一步比较发现DEX 治疗组小鼠IL-4 和IL-5 的水平比THC 治疗组更低(P<0.05;图5A、B),两组均数之差分别为-3.69 和-4.63,其95%CI 分别为-7.18~-0.20、-7.68~-1.57,而对于IL-13 和IL-17A 的抑制效果,两组间差异无统计学意义(P>0.05;图5C、D)。Th1(IFN-γ)和Treg(IL-10)细胞因子水平各组间差异无统计学意义(P>0.05;图5E、F)。
3 讨论
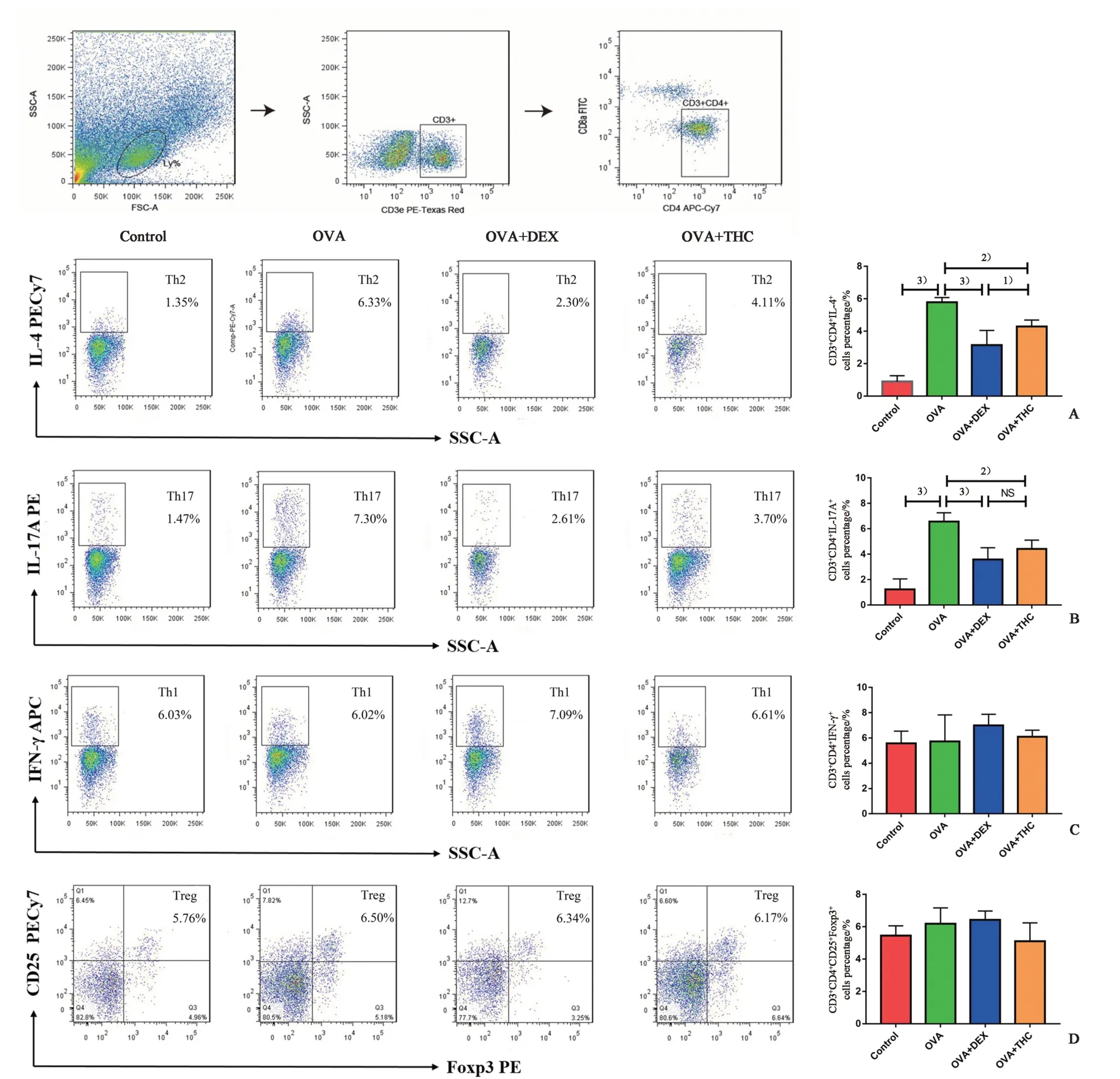
图4 小鼠肺组织T淋巴细胞亚型Fig.4 Subsets of T lymphocytes in lungs of mice
过敏性哮喘患者中Th2 细胞介导的炎症反应类型最为常见[1,26],主要表现为嗜酸性粒细胞大量浸润、杯状细胞增生以及多种促炎因子(IL-4,IL-5等)的释放,从而造成炎症反应加剧、气道狭窄和炎性损伤。此外,还有研究发现Th17 细胞具有较高的可塑性和适应性,其中一部分可以转化为Th2 型细胞[27]。THC作为姜黄素的主要代谢产物,具有类似姜黄素的生物学功效和更高的生物利用度,对多种急慢性疾病均可发挥保护性作用,如癌症、神经退行性改、心血管疾病和急性肾损伤等[28]。动物研究发现THC 可以通过抑制TAK1-NF-Kb、IL⁃4Rα⁃Jak1⁃STAT6 和Jagged1/Jagged2⁃Notch1/Notch2 等信号通路发挥免疫调节的作用,从而抑制Th 细胞过度分化以及减少促炎因子的释放[22,24]。本研究的结果表明THC 和DEX 均可有效缓解过敏性气道炎症小鼠的呼吸道症状(降低挠鼻频率、减轻气道狭窄和粘液过度分泌)以及抑制炎症反应(减少Th2和Th17 细胞数量及其细胞因子水平)。对于炎性细胞浸润、气管壁增厚、粘液分泌以及Th17 细胞和IL-13、IL-17A 等指标的作用效果,THC 与DEX 具有可比性,说明THC 具有作为防治过敏性气道炎症替代性治疗手段的潜在价值。
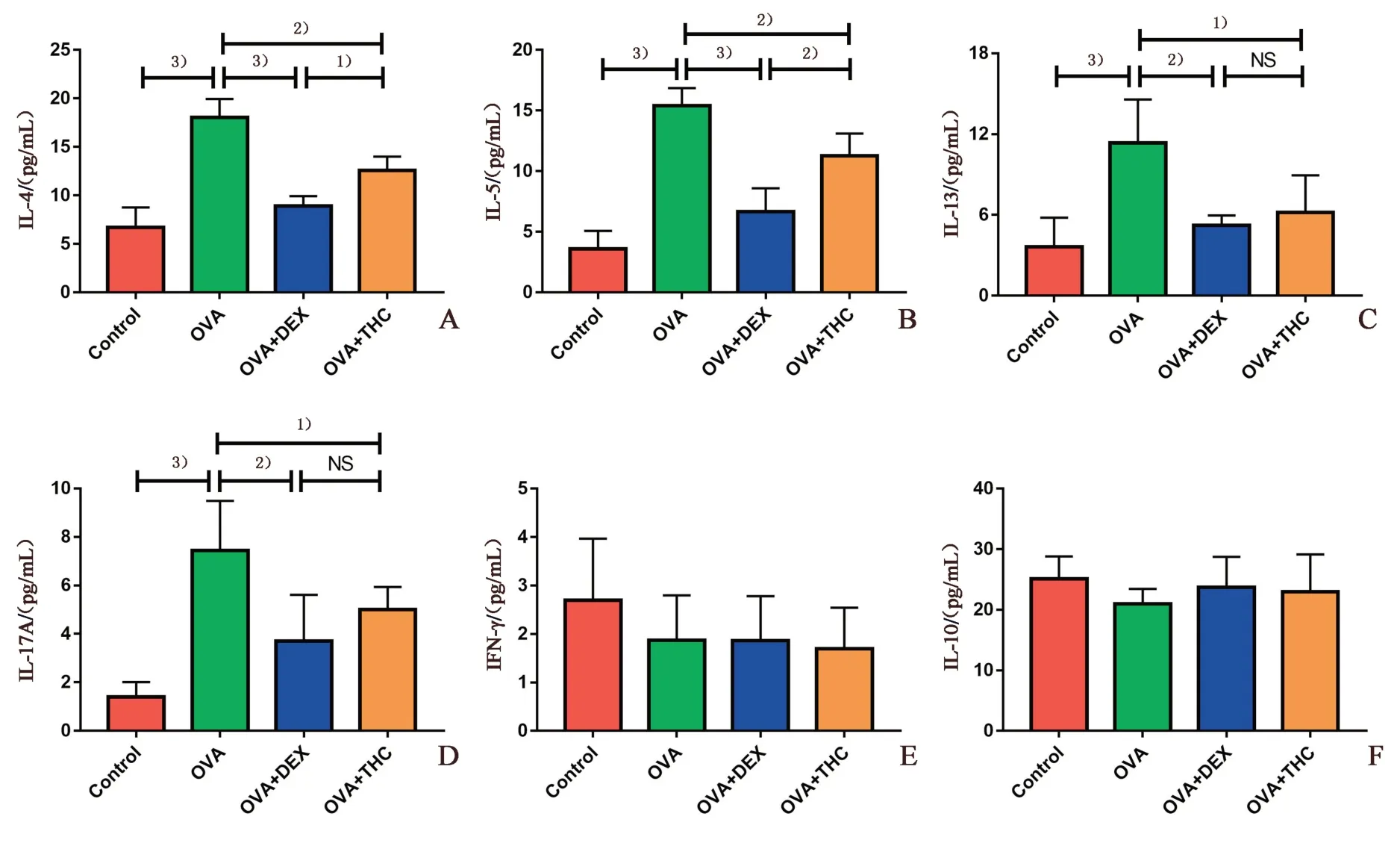
图5 小鼠肺泡灌洗液中细胞因子水平分析Fig.5 Levels of cytokines in BALF from mice
目前尚缺乏治愈过敏性哮喘等气道炎症的有效手段,如果没能及时有效地控制病情或缓解症状,甚至可能威胁患者的生命安全[2]。前期研究已经证实:给予小鼠长期(26 d)膳食添加THC 可以有效减轻Th2 型炎症反应以及缓解过敏性哮喘呼吸道症状[24],说明THC 作为营养补充剂能够调节免疫功能,起到良好防治过敏性哮喘的作用。为了进一步探索THC 在过敏性哮喘发作期的短效治疗效应,本研究采用腹腔注射的方式以保证更快的吸收和利用[28]。实验结果表明:相较于为期26 d THC膳食添加的干预方法,连续5 d THC 腹腔注射治疗大大缩短了干预时间,且同样可以显著减少Th2 细胞及相应细胞因子水平,从而减轻过敏性哮喘小鼠呼吸道症状和抑制炎症反应。主要是因为小鼠腹腔部位含有大量血管和淋巴管道,可以充分、迅速得吸收营养物质而无需经过肠道消化过程,因此在短时间内即可将这些物质运输到靶器官发挥治疗作用。这些研究结果为THC 作为哮喘发作时的候选急救药物提供了数据支持,值得更深入地开发和更广泛地利用。
临床一线药物糖皮质激素可以有效控制病情,降低住院率,部分研究认为系统性糖皮质激素的治疗效果优于吸入性治疗[3]。然而考虑到长期使用带来的副作用以及对于激素不敏感或难治性哮喘患者的治疗效果不佳,合理剂量的选择仍尚未有定论[29-31]:在动物实验或人体试验研究当中,激素用量范围非常广(0.5~80 mg/kg)[3,29],本研究选择了相对较低以及使用较多的剂量(即2.5 mg/kg)用于该动物实验。而关于THC 剂量的选择,本研究参考了以往动物实验中的报道:发现THC 在20~25 mg/kg 剂量时可以发挥较高的保护作用[32-33],且在400 mg/(kg·d)的剂量下也未出现生殖、发育等毒性[34],同时结合本课题组已有关于膳食补充0.08%THC 防治过敏性哮喘的研究结果,经换算后采用20 mg/(kg·d)的干预剂量。
综上所述,我们的研究证实了腹腔注射THC可以在较短时间内有效缓解呼吸道症状和减轻气道炎症反应,主要是通过抑制Th2、Th17 细胞及其细胞因子以及减少嗜酸性粒细胞等炎性细胞的浸润。另外,THC 的治疗效果与DEX 具有可比性,且其安全性更高,因此THC 作为防治过敏性哮喘的替代性急救药物值得进一步的临床试验和推广。

