基因组学挖掘肺癌生物标志物及治疗靶点研究进展
杨春辉 李秀华王琪
作者单位:116027 大连医科大学附属第二医院1检验科,2肿瘤内科,3呼吸内科
肺癌诊断标志物主要有神经元特异性烯醇化酶、癌胚抗原、鳞状细胞癌抗原和组织多肽抗原等。但是,这些标志物对早期肺癌的诊断敏感性不高,难以满足早期诊断要求及疾病发展的多样性,极大影响治疗效果,因此筛选并发现更具特异性的早期诊断标志物成为肺癌诊断的研究热点。基因组学等先进诊断检测技术的不断发展,给疾病诊断及治疗带来了新的机遇。从基因水平探索新型的肺癌早期诊断标志物及治疗靶点同样对提高肺癌早期诊断率及预后意义重大,同时也有望为靶向治疗提供可靠依据。目前研究认为,肺癌的发生与基因不稳定性及多基因异常改变密切相关[1]。其中的显著特征是高肿瘤突变负荷(tumor mutational burden,TMB)。现将利用基因组学探索TMB在肺癌早期诊断标志物筛选及靶向治疗中的作用及研究现状做以下总结。
1 基因组学检测TMB在肺癌早期诊断中的作用
肺癌的发生与多基因异常改变有关。TMB是指外显子区域上平均1 Mb碱基出现的体细胞突变(非同义突变)的数量[2],目前可利用二代测序(next generation sequencing,NGS)等方法进行检测。HU 等[3]研究专门针对不同阶段的癌前肺结节及肺癌标本进行多区域外显子测序,分别在单核苷酸位点水平、染色体水平以及亚克隆结构进行分析,首先利用多区域外显子测序技术对116例临床癌前病变患者及肺癌患者共46 007个体细胞单核苷酸变异体进行鉴定,包括不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)22 例、原位腺癌(adenocarcinoma in situ,AIS)27例、微浸润腺癌(minimally invasive adenocarcinoma,MIA)54例、浸润型腺癌(invasive adenocarcinoma,ADC)13例,结果发现患者TMB从AAH到AIS逐渐增加,且在MIA及ADC中显著增加。同时利用GISTIC分析发现,在染色体6p21.1,12p12.1及12q15区段发生增补,而在17p13.3及19p13.3区段发生缺失,认为这些部位的基因改变可能是与肺癌发生有关的主要基因调控区域,提示单核苷酸变异体及基因突变负荷的增加在早期肺结节形成及发展成为肺癌的调控中起着至关重要的作用(见图1)。也有研究报道在肺癌癌前病变中广泛存在着 EGFR[4]、KRAS[5]、RBM10[6]、TP53[7]等癌基因突变,以及 STK11[8]和CDKN2A[9]抑癌基因表达缺失;其中EGFR是突变率发生最广泛的基因,在AIS、MIA和ADC的突变率大依次约为40.7%、29.6%和46.2%,但是在22例AAH中并未发现EGFR突变[3]。也有研究报道EGFR突变在癌前病变中的发生率较低,而在AIS、MIA及ADC中发生率显著增高[10]。这些结果提示EGFR突变可能成为鉴别肺良性结节与原位腺癌及微小浸润性肺腺癌的早期基因检测分子标志物。此外,HU等[3]研究还发现包含STK11等抑癌基因的染色体片段缺失发生率从癌前病变到浸润性肺腺癌逐渐增高,在AAH、AIS、MIA和ADC中的发生率分别为10.0%、20.0%、35.7%和38.5%,提示STK11等抑癌基因的表达缺失可能在肺结节的发生及进展调控中具有重要作用,可能成为早期肺癌的诊断标志物及治疗靶点。
HU等[3]同时对吸烟者及非吸烟者进行基因比对,试图探索吸烟在肺癌发生发展中的作用及与其相关的基因改变。结果发现AAH、AIS、MIA及ADC四类中吸烟者TMB显著高于非吸烟者。但部分癌基因突变,如EGFR突变在吸烟与非吸烟患者中却无明显差异,相反在该研究中非吸烟患者(11/28)的EGFR突变率高于吸烟者(7/25),而在吸烟者TP53及CDKN2A的突变率相对非吸烟者更高,提示吸烟是肺癌发生的主要诱因之一。CHAPMAN等[11]研究同样证实了EGFR和ALK-EML4突变在非吸烟者的发生率较吸烟者更高,且一些大于30年吸烟史的患者中EGFR及KRAS的突变率明显减低。因此认为,通过基因组学分析评估肺癌的危险因素,对肺癌的发生也具有早期预警作用。
随着基因诊断技术的发展,TMB、循环肿瘤DNA(ctDNA)[12]以及 DNA 甲基化[13]检测等也逐渐成为肺癌早期诊断的重要手段。多项研究通过基因组学或多组学联合检测发现多种肺癌早期诊断较为特异性的血清或分子标志物,其中YANAGITA等[14]发现肺癌患者血清中细胞骨架相关蛋白4(CKAP4)表达显著高于健康者,且在肺癌早期血清中即能检测到,敏感性明显高于传统指标,可能成为肺癌早期诊断血清标志物。血液前表面活性蛋白B(pro-SFTPB)及二乙酰精胺(diacetylspermine)也已被发现可能成为肺癌的早期诊断标志物[15-16]。此外,越来越多的研究显示检测循环肿瘤细胞[19]、外泌体[18-19]、循环 RNA[20]以及循环 cDNA 等肿瘤相关标志物能显著提高对肺癌的早期诊断率。因此,利用基因组学或结合多组学研究探索肺癌早期诊断生物学标志物对肺癌早期诊断意义重大。
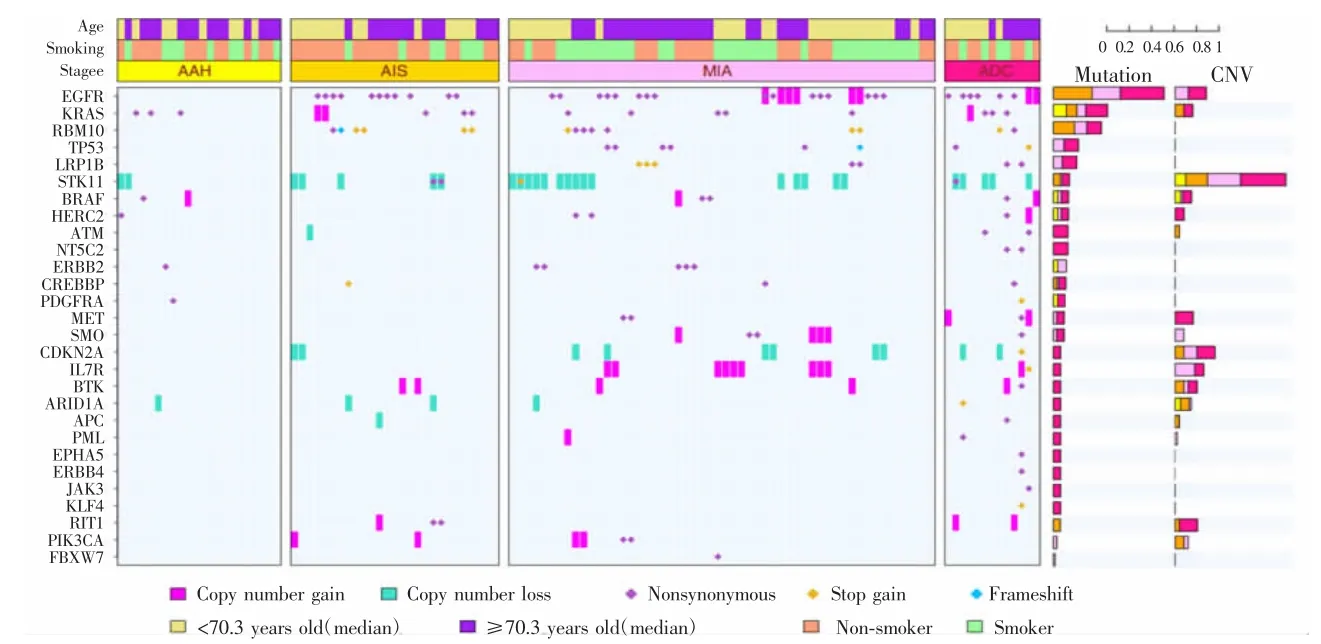
图1 基因组学分析AAH、AIS、MIA及ADC患者与相关基因异常的关系(引自参考文献[3])Fig.1 Cancer gene mutations were defined in AAH,AIS,MIA and ADC(quoted from reference[3])
2 基因组学检测TMB在肺癌预后预测中的作用
肿瘤基因突变负荷的改变及基因异常不仅在肺癌早期诊断中发挥重要作用,在预后评估及病情监测中也起到重要作用[21-22]。DEVARAKONDA 等[23]分析了908例早期非小细胞肺癌(non-small cell lung cancer,NSCLC)术后辅助化疗患者的二代测序和长期生存数据,使用靶基因panel评估单基因突变、DNA修复途径和TMB的预后及预测效应,结果发现908个样本中,1 515个基因发现了非同义突变,且非同义TMB与总生存期(OS),无病生存期(DFS)和肺癌特异性生存率(LCSS)显著相关,其中高非同义 TMB(>8 mutations/Mb)的术后患者预后较好,而低TMB组预后最差。该研究还发现TMB是LCSS预测因子,但不适用于DFS或OS,因此认为TMB可作为一种预后标志物,主要原因为其改变了肿瘤-宿主的免疫相互作用。除高TMB外,肺癌的另一个显著特征是染色体不稳定性。ABBOSH等[24]通过TRACERx前瞻性分析对100例肺癌患者进行全外显子测序,构建NSCLC的进化模式,结果发现高比例的亚克隆拷贝数变化与正在接受切除术患者的无复发生存率相关。这些结果表明,在核苷酸和(或)染色体水平对基因组不稳定性进行监测可能有助于预测肺癌患者预后,有望用于指导治疗。这些发现也突出体现了非同义TMB在临床试验中作为潜在分层变量的重要作用。
也有研究通过检测肺癌患者血液来源的肿瘤突变负荷(bTMB)验证其对免疫治疗药物疗效及预后的评价效能[25],且首次证实血浆中bTMB可准确重复测量及其对免疫治疗药物疗效预测的有效性。该研究进行大型队列回顾性分析PD-L1抑制剂Atezolizumab和Tecentriq治疗NSCLC患者后的血液样本,发现bTMB水平较高(bTMB>16 mutations/Mb)的患者对PD-1或PD-L1抑制剂治疗更加敏感,且预后更好。因此认为,NSCLC一线治疗中在使用PD-L1抑制剂治疗前应进行PD-L1表达检测。此外,WANG等[26]报道bTMB与PD-L1表达不相关,属于独立的预后因子。由此可见,鉴于临床上通常无法获取足量的肿瘤组织,因此bTMB较传统的TMB检测在肺癌患者预后评估中具有无法比拟的优势。
与肺癌发生发展密切相关的驱动基因(EGFR、TP53及KRAS等)的异常改变在肺癌预后监测中也起到了一定的指示作用[27-28]。JIAO 等[29]对 1 411个NSCLC标本进行生存分析,结果显示,TP53突变与进展性NSCLC的总生存期呈负相关,且此类患者常伴随EGFR突变。ARBOUR等[30]研究显示,KRAS突变的肺癌患者中多数伴TP53,STK11以及KEAP1/NFE2L2共同突变,且KRAS与KEAP1/NFE2L2突变是肺癌非独立的预后因素,提示多基因检测及TMB在肺癌预后评估中起着重要的作用。监测患者循环RNA对肺癌的疗效评价及预后评估也有重要作用[31-32]。XIE等[33]研究显示,肺癌患者组织或者血清中高表达长链非编码RNASOX2OT及ANRIL,且与患者的总生存率显著相关,其中SOX2OT是肺癌患者的独立预后因子。
由此可见,利用基因诊断技术对肺癌患者进行相关TMB、基因突变及基因拷贝数改变进行监测能够对患者预后及疗效进行评估,有利于提高患者生存率,改善预后。
3 基因组学检测TMB在肺癌免疫治疗及靶向治疗中的应用
肺癌的早期诊断及早期治疗对提高患者生存率至关重要。近年来研究显示,通过基因组学及相关检测技术对患者进行基因调控网络分析,探索可能的作用机制,可为制定更加合理精准的早期诊断及靶向治疗提供依据。总体而言,肿瘤细胞基因组中累积的突变数目越多,产生的突变相关新抗原(肿瘤免疫的靶点)也越多,从而可以激活更多的T细胞,产生更强大的免疫反应。因此TMB越高,肿瘤越有可能对免疫治疗有效,TMB也因此有望作为肺癌免疫治疗疗效的预测因子,也是目前正在不断研究的生物标志物。PD-L1表达和TMB已成为预测免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)治疗反应的重要生物标志物,且发现TMB与PD-L1表达是两个独立的生物标志物,两者的预测能力相当[34-36]。YARCHOAN 等[37]对9 887个临床样本的PD-L1表达和TMB进行评估,并分析其与ICI反应率的关系,发现PD-L1表达与TMB无明显相关性。因此认为,在临床上联合PD-L1表达和TMB预测ICI疗效的能力可能更强。
研究显示,通过基因组学分析EGFR及BRAF V600E突变,ALK及ROS1基因易位,同时检测PD-L1表达,可对患者进行精准靶向治疗[38-39]。ROBICHAUX等[40]研究利用基因组学检测了HER2基因突变在肺癌中的发生率及其与药物敏感性的关系,在HER2第20个外显子突变NSCLC的Ⅱ期临床试验中,利用选择性酪氨酸激酶抑制剂Poziotinib上调HER2表达并增强化疗药物T-DM1的活性,再通过联合治疗,结果肿瘤完全消退。此外,多项研究显示,探索肺癌中常见的表达异常或者突变的基因,能显著提高肺癌早期诊断率及靶向治疗疗效[41-43]。
SINGAL等[44]通过临床-基因组学真实世界研究数据证实了NSCLC患者的临床表型与基因组学特征的关系,有助于发现新的疾病相关标志物。该研究分析了2011年至2018年接受肿瘤治疗的4 064例NSCLC患者的数据,结果显示,不同致癌突变分布的人群具有不同特征,其中亚洲人群、女性以及无吸烟史的人群EGFR突变的比例更高,而ALK突变更多见于年轻患者以及无吸烟史人群,MET突变人群年龄更高。此外,还发现有吸烟史的患者TMB水平更高;存在EGFR、ALK、ROS1以及 RET等致癌突变的患者TMB水平更低,而存在PIK3CA与KRAS突变的患者TMB水平则更高。因此认为,患者的TMB水平及相关基因突变对肺癌免疫治疗具有较好的指向性,癌细胞TMB越高,可能产生的新抗原越多,肿瘤的抗原免疫原性越高,T细胞反应和抗肿瘤反应越强,也更加适合免疫治疗。近年来的一些研究也逐步证实,高TMB与ICIs的治疗效果呈正相关[45-48],因此监测TMB及基因拷贝数改变能指导临床肺癌ICIs的应用。研究发现,高TMB及低基因拷贝数改变患者对ICIs治疗更加敏感[49]。此外,也有些研究发现,高TMB患者对免疫治疗的反应不一致[50],其中有研究报道部分低TMB的患者对免疫治疗反应也较好[51]。为了进一步探索TMB对治疗反应的机制,ROSENTHAL等[52]对88例早期未治疗的NSCLC患者进行RNA测序分析,结果显示不同患者的免疫浸润程度存在异质性,肿瘤细胞所处的微环境也存在差异,致使肿瘤新抗原呈递功能多样化,最终导致患者对ICIs治疗效果的差异性。这更加突显了对患者免疫治疗及治疗靶点的早期筛选,以及对患者TMB进行监测的重要性。2019年美国国家综合癌症网络(NCCN)最新肺癌NCCN V.1指南也已经正式将TMB列入诊疗指南。通过基因组学分析TMB及相关驱动基因的异常改变,指导临床靶向药物治疗及免疫治疗,并评估患者药物耐受性及疗效,以及监测治疗过程中被免疫系统识别的T细胞新表位,从而增强T细胞反应性和抗肿瘤活性。尽管TMB研究仍存在有较多问题,但在预测肿瘤免疫治疗临床疗效和新抗原应用方面,TMB作为一个全新的标志物具有良好的临床应用前景。
4 小结
肺癌是多基因异常改变的恶性肿瘤,恶性程度高且预后差,因此早期诊断及早期治疗对提高患者生存率及治愈率尤为重要。利用基因组学分析探索肺癌早期诊断及治疗的生物学标志物,从而对疾病进行精准个体化诊疗,提高患者诊断率及预后越来越受到关注。目前基于基因组学分析肺部良性结节到浸润性肺腺癌不同阶段的基因异常改变及TMB研究中,共筛选出 EGFR、KRAS、RBM10、TP53、STK11、ALK、ROS1、RET以及CDKN2A等多种癌基因及抑癌基因异常,且认为这些基因在肺癌的发生发展、免疫治疗和靶向治疗中发挥重要的调控作用。未来通过基因蛋白等多组学及分子诊断学对其进一步研究,这些基因有望成为肺癌早期诊断及生物学标志物及治疗靶点。

