牛支原体贵州株表面膜蛋白p81基因生物信息学分析
谢晓东,李涛,袁海文,文明,3,周碧君,2,杨美,3,程振涛,3*
(1. 贵州大学动物科学学院,贵州 贵阳 550025;2. 贵州省动物疫病预防控制中心,贵州 贵阳 550008;3. 贵州省动物疫病与兽医公共卫生重点实验室,贵州 贵阳 550025 )
牛支原体(Mycoplasmabovis)是引起牛支原体肺炎的主要病原,M.bovis感染除引起牛支原体肺炎外,还会引起耳炎、结膜角膜炎、关节炎、生殖道炎症、乳腺炎、流产等症状,严重危害养牛业的发展[1]。牛支原体黏附素主要以膜蛋白形式存在于细胞表面,对牛支原体的致病性起重要作用。而在牛支原体膜表面蛋白众多研究热点当中,Vsp蛋白因为其抗原表位和大小都具有高频的变异性而研究资料较多[2-3]。Vsp 蛋白家族是一组与牛支原体黏附性密切相关的膜脂质蛋白,它能够协助牛支原体黏附在宿主细胞上,从而产生相关的致病性。此外,牛支原体还有pMB67、P26抗原、28 kD蛋白等其他黏附相关蛋白[4]。牛支原体膜表面蛋白的研究对揭示该病原致病与免疫机理有重要意义[5],p81蛋白为牛支原体的表面膜蛋白,研究资料认为其也是一种特异性抗原蛋白,p81蛋白有高度的保守性且种间差异较大[7],如牛支原体PG45株的p81蛋白与无乳支原体的p81蛋白的同源性只有64%。2009年,我国学者李媛等[6]选用p81基因设计引物,建立了牛支原体双重PCR方法。此方法特异性强、灵敏度高,因而牛支原体p81基因可以作为靶向基因用来诊断牛支原体。本文通过对牛支原体贵州株p81基因的克隆,测序及生物信息学分析,获取牛支原体贵州株p81基因分子特征,为基于p81蛋白致病性、免疫防控和诊断研究提供研究资料。
1 材料与方法
1.1 菌株
M.bovisGZ01、M.bovisGZ02由贵州省动物疫病与兽医公共卫生重点实验室分离并保存;M.bovis标准株PG45(ATCC25533)购自美国典型菌种保藏中心。
1.2 主要试剂
DNA提取试剂盒购自Biomiga公司,2×Taq PCR Master Mix、200 bpDNA Maker购自北京天根生化科技有限公司,pMD-19T载体购自TaKaRa公司,胶回收试剂盒及质粒提取试剂盒均购自Omega公司,DNA限制性内切酶购自Thermo公司。
1.3 目的基因扩增
根据NCBI公布牛支原体基因序列设计一对引物,上游引物p81-p1:5′-TTATTTAAGAATTTGACTTGAT-3′;下游引物p81-p2:5′-GAAAAATAAATTAATGATTGGGCTT-3′,预扩增片段长2 187 bp,由大连宝生物工程有限公司合成。提取2株牛支原体贵州分离株和牛支原体标准株PG45基因组,应用引物p81-p1/ p81-p2对目的基因进行扩增。
1.4 p81基因克隆及序列分析
将PCR扩增的目的基因胶回收与纯化,纯化的基因与pMD-19T载体连接转化入宿主菌,对重组载体进行PCR及酶切鉴定。阳性重组质粒由英潍捷基(上海)贸易有限公司测序。采用DNAStar 7.1和Mega 5.0软件对牛支原体贵州株p81基因进行氨基酸推导及进化关系分析。
1.5 p81基因生物信息学分析
采用在线软件ExPASy(http://web.expasy.org/compute PI/MW)和Protparam(http://web.expasy.org/protparam)分析预测编码蛋白质的性质及氨基酸组成;采用在线软件Protscale(http://web.expasy.org/cgi-bin/protscale/)分析蛋白疏水性与亲水性;采用在线软件SignalP 4.0(http://www.cbs.dtu.dk/services.SingnalP)和TMHMM 2.0 (http://www.cbs.dtu.dk/services/TMHMM/)分析蛋白信号肽以及预测蛋白质跨膜结构;采用在线软件NetNGlyc 1.0、NetPhos 2.0和NetPhosk 1.0(http://www.cbs.dtu.dk/services/)预测蛋白潜在N糖基化位点、潜在磷酸化位点以及保守的特异性蛋白激酶作用位点;采用在线软件PHD sec(http://www.predictprotein.org/)和(Immune Epitope Database,IEDB)(http://www.iedb.org/)预测蛋白质的二级结构和三级结构;利用DNAStar 7.1提供的蛋白质氨基酸序列抗原表位在线预测工具,进行B细胞抗原表位预测和分析。
2 结果与分析
2.1 p81基因PCR 扩增
以提取的牛支原体培养物DNA为模板,PCR扩增获得牛支原体贵州株p81基因,PCR产物电泳结果见图1。PCR扩增获得大小约为2 187 bp目的条带(图1),与预期扩增片段相符。

M.DL 2000 Marker;1、2. 牛支原体GZ01;3、4. 牛支原体GZ02;5、6. 牛支原体PG45;7.空白对照图1 p81基因片段PCR扩增结果
2.2 p81基因PCR 克隆及序列分析
2.2.1 阳性重组质粒筛选
牛支原体GZ01、牛支原体GZ02 p81目的基因经胶回收纯化、连接转化至感受态细胞,提取重组质粒后进行质粒PCR鉴定(图2),可见从重组质粒中扩增获得约为2 187 bp的目的条带,与目的基因大小一致。
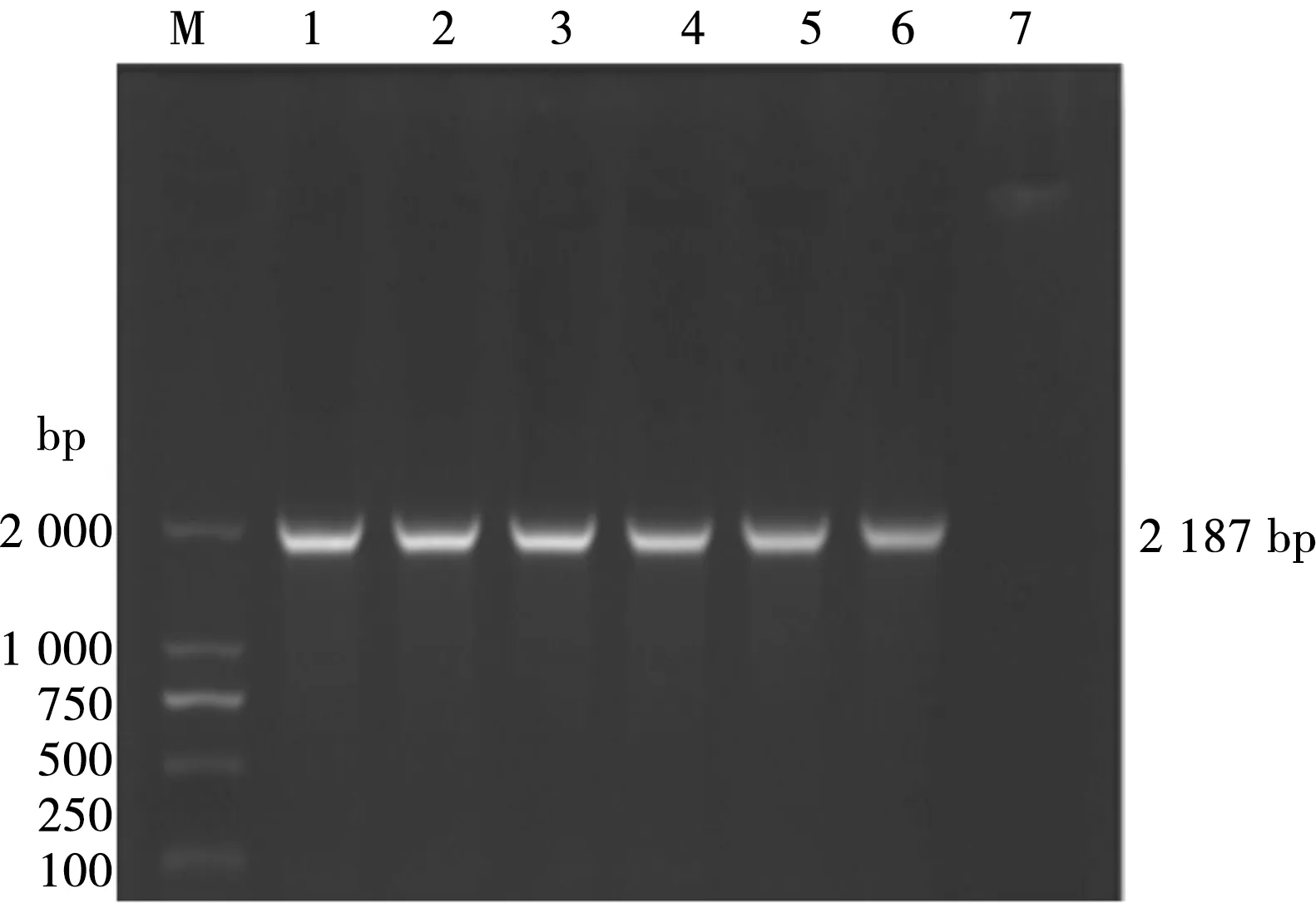
M.DL 2000 Marker;1、2、3. 牛支原体GZ01 p81基因重组质粒;4、5、6. 牛支原体GZ02 p81基因重组质粒;7.阴性对照图2 阳性重组质粒PCR鉴定
2.2.2 阳性重组质粒双酶切鉴定
提取重组质粒,用限制性内切酶KpnⅠ和SalⅠ对重组质粒进行双酶切鉴定,酶切产物电泳电泳结果见图3。重组质粒双酶切可见约2 187 bp的目的基因条带和2 962 bp的载体条带,结果证实,目的基因克隆成功。

M.DL 2000 Marker;1. 牛支原体GZ01 p81基因重组质粒;2. 牛支原体GZ02 p81基因重组质粒;2、4.阴性对照图3 阳性重组质粒双酶切鉴定
2.2.3p81基因推到氨基酸序列分析
经PCR和双酶切鉴定为阳性的重组质粒进行测序,对氨基酸序列进行推导分析。由图4可见,p81基因序列编码728个氨基酸,推导氨基酸55 位、230 位、485 位、558位密码子为TGA,可作为终止密码子,但对于牛支原体p81基因为色氨酸,如进行蛋白表达需进行位点突变。将2株M.bovis贵州株氨基酸序列与参考株PG45氨基酸序列进行比较显示, 2株分离自贵州省不地区的M.bovis贵州株氨基酸序列完全相同,但与PG45株p81蛋白氨基酸序列发生110位点突变。此结果表明,贵州省内M.bovis菌株p81蛋白保守,但相较于标准株PG45株已出现明显进化。

图4 牛支原体贵州株p81基因推导的氨基酸序列
2.3 p81蛋白理化性质的分析
应用ExPASy(Compute PI/MW)、Protparam在线分析软件预测编码蛋白质的理化性质及氨基酸组成。p81蛋白分子质量为 81.629 6 kD,分子结构式为C3643H5795N963O1133S13。理论等电点为9.15。其氨基酸组成中Lys(K)最多,占13.5%,含有1个Cys(C)(0.1%),碱性氨基酸有3种(Arg、His、Lys),共121个,占16.6%;推测p81为碱性蛋白。该蛋白溶液中不稳定指数为29.15,低于阈值40,在溶液中性质稳定。这些指数提示p81蛋白应具有较好的抗原性。
2.4 p81蛋白疏水性及亲水性的预测与分析
应用Protscale在线预测牛支原体贵州流行株p81氨基酸序列的亲疏水性,结果见图5。

图5 p81基因亲疏水性分析
图中纵坐标大于0的为疏水区,得分越高疏水性越强;反之,则为亲水区。p81基因编码的蛋白多肽链第18位具有最高分,为2.156(疏水性最强),在616位具有最低分,为-3.178(亲水性最强)。Scale分析得知,整个多肽链表现为亲水性,较好的亲水性也预示着较高的可溶性。
2.5 p81蛋白信号肽及跨膜区预测
应用在线软件SignalP 4.0和TMHMM 2.0分析此蛋白信号肽以及预测蛋白跨膜结构,结果见图6。牛支原体贵州株p81基因所编码氨基酸在24~25间具有分泌信号肽的特征,因此表达时建议该蛋白基因进行修饰。由图7可知,该蛋白不具有明显的跨膜螺旋结构,有利于提升p81基因表达效果。
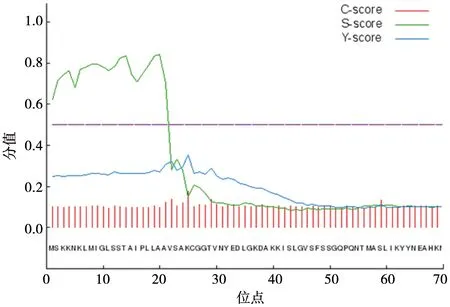
图6 p81信号肽分析

图7 p81跨膜区分析
2.6 p81蛋白修饰结构的预测
应用在线软件采用在线软件NetNGlyc1.0、NetPhos 2.0和NetPhosk1.0 预测蛋白潜在N糖基化位点、潜在磷酸化位点以及保守的特异性蛋白激酶作用位点。由图8可知,p81蛋白在第167,314,328,493和559个氨基酸处共存在5个N糖基化位点;p81蛋白有59个丝氨酸、29个苏氨酸及11个酪氨酸可能被磷酸化。上述磷酸化位点所对应的磷酸激酶预测结果显示,在p81蛋白上可能有PKC,UNSP,PKA,CKⅠ,DNAPK,RSK,INSR,CKⅡ,PKG,SRC,cdc2,ATM,EGFR共13种保守的特异性蛋白激酶的结合位点,其中在451处unsp得分最高为0.997。这些分析结果提示p81蛋白与牛支原体致病性存在相关关系。

图8 p81蛋白修饰结构预测
2.7 p81蛋白二级结构及三级结构预测
应用在线软件PHD sec和SWISSMODEL预测蛋白质的二级结构和三级结构。结果显示,Sec预测组p81蛋白多肽链二级结构的3种类型分别是α-螺旋(H)、β-折叠(S)和无规则卷曲(L),比率分别为27.61%、11.40%和60.99%,以无规则卷曲为主,β-折叠较少。利用SWISS-MODEL预测p81基因编码蛋白的三级结构,结果如图9所示,与二级结构预测结果相似。

图9 p81蛋白三级结构模型
2.8 p81蛋白B细胞抗原表位分析
采用Kyte-Doolittle、Karplus-Schulz、Jamson-Wolf以及Emini方法,分别对p81蛋白的表面可及性、抗原指数、亲水性、柔韧性进行预测。由图10可见,该蛋白存在丰富的亲水性区域,主要集中在27~168、312~546、645~716。p81蛋白有多个表面可及性程度高的肽段,分别是31~142、557~628。其他部分表面可及性较小,但均为正值。骨架区含有较多的柔韧性区域,且分布相对均匀。该蛋白整体抗原指数较高,120~168、428~484较大,其中25~169、196~292、426~628区域抗原优势明显,上述区域可作为蛋白表达选择的目标区域。

图10 p81蛋白B细胞抗原表位预测结果
3 讨论
牛支原体感染可造成养牛业巨大的经济损失,且其感染已呈现世界性分布[8],因此国内外均加强了牛支原体地方流行株的研究。牛支原体感染的主要症状为咳嗽、呼吸困难,从开始流清亮鼻液到后期转为黏性或者脓性鼻液,剖检可见胸腔积液、与肺部发生粘连、肺脏质地变硬并出现坏死灶[9-10]。目前对牛支原体诊断较为困难,常用方法主要为牛支原体病原分离鉴定和基因检测[11-12]。但在病原分离培养时,由于牛支原体对营养需求较高,耗时长,临床分离易受其他微生物污染,因此不能作为临床快速诊断手段[13];而针对牛支原体基因和血清抗体检测,因其高通量、高灵敏性和快速高效特性,常被应用于临床诊断技术,但此方法以特异性基因和抗原蛋白的选择为基础。因此,开展牛支原体相关功能蛋白基因的生物信息学分析,是有效选择靶标蛋白的手段,也是构建亚单位疫苗或基因工程疫苗的必备步骤。吴燕等[14]通过对绵羊支原体肺炎p113基因生物信息学分析,发现p113蛋白可能是潜在信号通路分子,也是一种良好的抗原结构蛋白;对猪支原体A1基因编码蛋白进行预测分析,发现该蛋白存在跨膜区域,具有良好抗原性[15]。因此,本研究选择牛支原体p81基因,开展目的基因的序列分析,推导分析氨基酸的特性,为基于牛支原体p81基因的表达、亚单位疫苗构建、诊断试剂和致病性研究提供可行性分析资料。
牛支原体不具有细胞壁,其细胞膜由脂质双分子层和膜蛋白组成,牛支原体主要通过支原体细胞膜成分发挥致病作用,包括支原体黏附、增殖、入侵宿主细胞、免疫应答等[16-18]。目前的研究资料认为,p81应为牛支原体膜蛋白[19],具有开展诊断试剂、基因工程疫苗、亚单位疫苗研究的可能性。本文通过对牛支原体贵州株p81基因扩增,并分别进行推导氨基酸编码蛋白的理化性质、跨膜结构、预测二级与三级结构以及B细胞抗原表位分析,结果均提示,p81蛋白具有作为抗原蛋白的优势。本研究还发现,55位、230位、485位、558位密码子为TGA,可作为终止密码子,但牛支原体p81基因为色氨酸,如进行蛋白表达需进行位点突变;高黎萍[20]在进行p25、p33蛋白表达时,为使基因能在在大肠杆菌中进行正确表达而将TGA突变为编码色氨酸的TGG,最终成功或获得p25、p33目的蛋白。针对抗原蛋白的体外表达,需要考虑表达量、表达蛋白区段抗原指数、信号肽区域、跨膜结构区域等因素选择合适的表达区段。本文对M.bovisp81蛋白的B细胞抗原表位、信号肽区域、跨膜结构区域分析显示,p81蛋白在24~25位氨基酸区域存在信号肽,不存在跨膜结构,其中25~169、196~292、426~628区域抗原优势明显,综上分析,认为对p81蛋白表达如选择N端区域,需考虑去除信号肽,并对可能存在TGA进行突变。而如选择包含426~628的C端进行表达,则需对存在的TGA进行突变。

