利用CHD基因鉴定鸽子性别的研究
王玲彩,董萌萌,王青,杭柏林,刘保国,胡建和,赵坤,徐彦召
(河南科技学院动物科技学院,河南 新乡 453003)
鸽子属于单态性鸟类,其性别(尤其是在幼鸟时期)在外貌行为上都很难做出判别。和其他鸟类或家禽相比,鸽子属于“一夫一妻”制的鸟类[1],在性成熟以后,会有选择性的寻找配偶,配对成功就不再接受其他异性。但这一特性在实际生产中也成为了一种制约,对产业化的饲养管理和繁殖育种是极为不利的。因此如何能快速鉴别出鸽子性别就显得尤为重要。以前,鉴别鸽子性别,多采用一些传统方法,如观察鸽子外形、叫声、腹腔镜检查、染色体分析、测定粪便中雌激素与睾酮的比例等方法[2~3]。以上方法虽然也能辨别出鸽子性别,但往往存在准确性不高、操作复杂、成本高昂、对动物伤害较大等缺点,目前应用最多的是利用分子手段对鸽子进行性别鉴定[4],为鸽子的产业化养殖奠定了技术基础。
许多研究表明,鸽子的性别是由Z染色体和W染色体决定的,其中ZZ为雄性,ZW为雌性[1,5]。目前,鉴别鸽子性别应用最多的是CHD基因,原因在于它的进化速率缓慢且保守[6]。CHD-Z和CHD-W为CHD基因在非平胸鸟类中的2个同源拷贝,其外显子在序列和大小上极其相似,而内含子的长度却相差很大[7],由此导致该基因在2条性染色体上的长度也不同,证明了利用CHD基因能够准确地对鸽子进行雌雄鉴定[8]。因此,根据内含子两侧的保守序列来设计特异性引物,对CHD基因片段进行特异性的扩增,即可实现对鸽子的性别鉴定。
本试验通过血液样本提取鸽子的基因组基因,利用2550F/2718R引物,对CHD基因的特异性片段进行扩增,并将PCR产物纯化后回收目的片段,回收片段与VecterPMD-19T相连接,然后转入感受态细胞,对转入后的菌液进行PCR鉴定,并将呈阳性的克隆进行序列测定,通过DNASTAR进行序列比对,从而获得了鸽子CHD基因的具体序列,增加了性别鉴定试验的准确性。
试验在对PCR程序的退火温度进行优化的过程中,发现雌性鸽子600 bp处条带易受PCR退火温度影响,而400 bp处条带稳定,或也可作为鸽子性别鉴定的一种方法。
1 材料与方法
1.1 血液样本与主要试剂
血液样本采自河南某鸽场。取已知性别的2羽雄鸽和2羽雌鸽,分别采集翅下静脉血100~200 μL;随机取23羽性别未知的健康雏鸽,分别采集翅下静脉血100~200 μL,用于性别鉴定。采集好的血液样本均用抗凝剂处理,-20 ℃冷冻保存。
血液基因组DNA提取试剂和抗凝剂为本实验室自制,PCR产物纯化回收试剂盒购自新乡智宝科仪仪器有限公司,2×TaqPCR Master Mix购自康为世纪生物科技有限公司,DL-2000 DNA Marker购自北京百泰克生物技术有限公司。
1.2 鸽子基因组DNA提取与质量检测
取鸽子全血,加入适量抗凝剂,获得鸽子抗凝血;将100 μL鸽子抗凝血加入250 μL裂解液中,用涡旋仪充分混匀,于58 ℃水浴锅中放置20~30 min,获得鸽子裂解血;将鸽子裂解血加入600 μL分离液中,涡旋混匀,于76 ℃水浴锅中放置20~30 min后,以4 000 r/min离心分离10~15 min,取200 μL上清液转移到另一干净EP管中,获得鸽子分离血;在鸽子分离血中加入400 μL析出液,以4 000 r/min离心分离1~2 min,留沉淀,加入600 μL洗涤液后涡旋混匀,获得鸽子初级DNA提取液;将鸽子初级DNA提取液于4 000 r/min离心机中离心分离1~2 min;小心弃上清,收集沉淀室温干燥,加入30~50 μL ddH2O溶解沉淀,即得鸽子DNA提取液。使用紫外分光光度计对DNA的浓度进行测定,并通过分析OD260/OD280比值来判断DNA的纯度。
1.3 设计与合成引物
根据文献报道,选择1对引物[6]。引物是由生工生物工程(上海)股份有限公司合成,上游引物为2550F:5′-GTTACTGATTCGTCTACGAGA-3′;下游引物为2718R:5′-ATTGAAATGATCCAGTGCTTG-3′。引物进行PCR扩增,扩增1条带为雄性,扩增2条带则为雌性。
1.4 已知性别鸽子的PCR扩增
用1.2所提取的DNA(已知鸽子性别)为模板,2550F、2718R为引物进行扩增。
PCR反应体系:体积为20 μL。2×TaqPCR Master Mix 10 μL,ddH2O 7 μL,上游引物1 μL,下游引物1 μL,待检菌液1 μL。
PCR反应程序:95 ℃预变性3 min;95 ℃变性30 s,51 ℃退火30 s,72 ℃延伸45 s,共39个循环;72 ℃终延伸8 min。取PCR产物5 μL进行1%琼脂糖凝胶电泳检测。
1.5 未知性别鸽子的PCR扩增
用1.2所提取的DNA(未知鸽子性别)为模板,2550F、2718R为引物进行扩增。PCR反应体系与程序如1.4,反应结束后取PCR产物5 μL,进行1%琼脂糖凝胶电泳检测。
1.6 不同退火温度对雌雄鸽子条带的影响
其他反应条件相同的情况下,将退火温度设为49~59 ℃进行梯度PCR反应。取5 μL PCR扩增产物用1%琼脂糖凝胶进行电泳检测,并进行结果分析。
1.7 性腺观察与PCR检测的比对分析
取1.5中进行PCR扩增的鸽子进行解剖并观察性腺,发现睾丸为雄性,发现卵巢、输卵管则为雌性;最后,将通过PCR进行性别鉴定的结果,与解剖后观察性腺得到的性别结果作比较,以此来验证采用PCR方法的准确性。
1.8 PCR产物克隆、测序及比对分析
分别取雌、雄鸽子的DNA各1条作为模板进行反应。PCR反应体系50 μL,包含2×TaqPCR Master Mix 25 μL,上下游引物各 1 μL,模板 1 μL,ddH2O 22 μL。PCR反应条件与1.4中相同。取扩增产物,经1%的琼脂糖凝胶电泳30 min,用凝胶成像仪进行拍照记录。将雌、雄鸽子PCR产物分别进行切胶,随后将目的片段用DNA纯化回收试剂盒进行纯化回收,用回收产物与VectoerPMD-19T相连接,然后转入E.coliK12感受态细胞,将转化后的菌液用三角涂布棒均匀的涂布在含有氨苄青霉素的LB固体培养基上,于37 ℃恒温培养箱中过夜培养;次日挑取单克隆于空白LB液体培养基中,37 ℃、180 r/min培养6 h,随后将培养的菌液进行PCR鉴定并将阳性克隆送往生工生物工程(上海)股份有限公司进行序列测定,并通过DNASTAR软件将所获序列在Blast中进行序列比对。
2 结果与分析
2.1 已知性别的鸽子PCR扩增
对已知性别的鸽子进行PCR扩增,结果见图1。鸽子血液样品进行PCR扩增后,雄性个体在600 bp左右出有1条亮带,而雌性个体有2条亮带,分别在约400 bp和约600 bp处。
2.2 未知性别的鸽子PCR扩增
对23羽未知性别鸽子进行PCR扩增,结果见图2。所有雄性个体均显示为1条带,而雌性个体均为2条带。
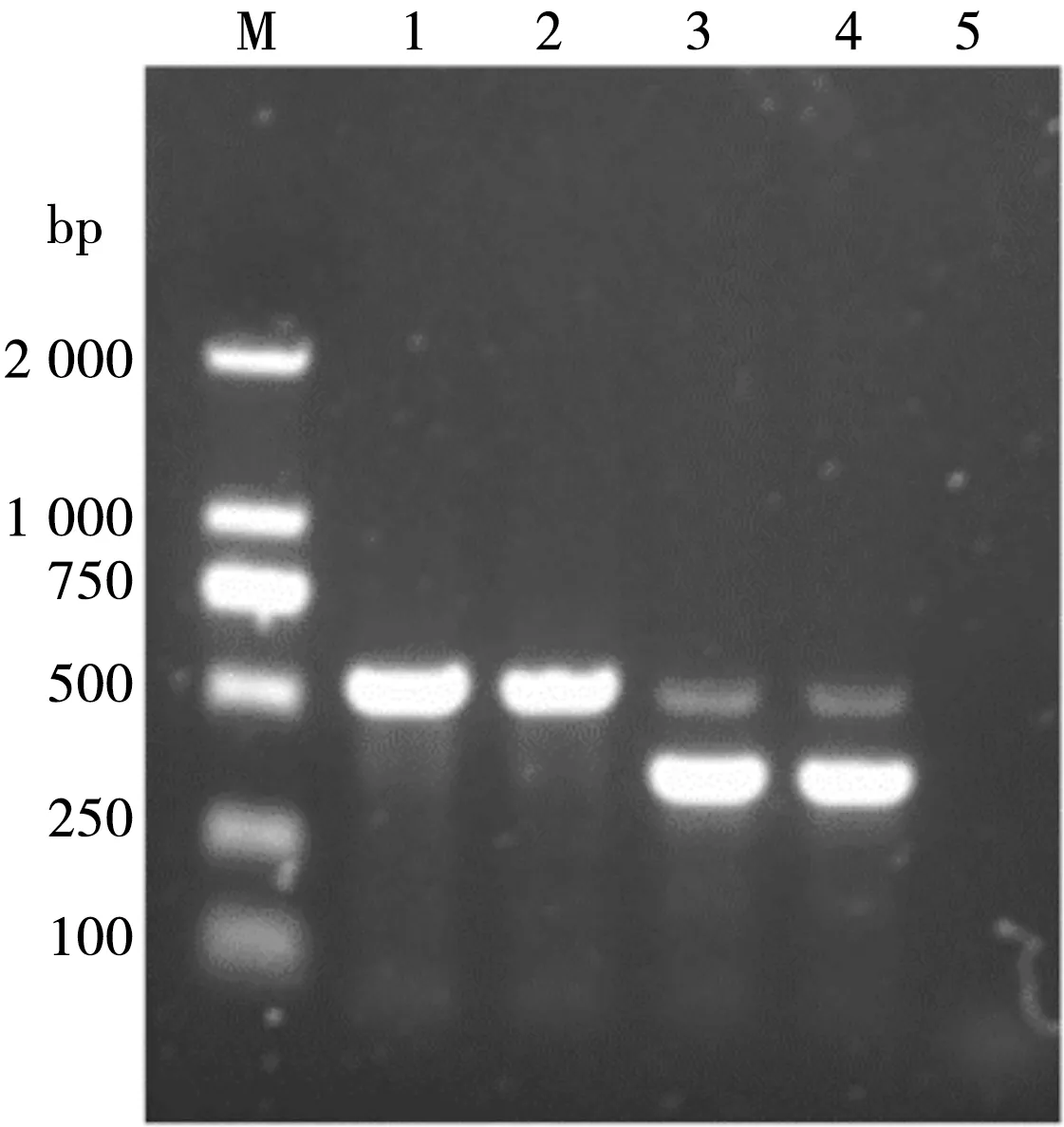
M.DL2000 Marker;1、2. 雄性鸽子DNA;3、4. 雌鸽子DNA;5. 空白对照图1 已知性别鸽子CHD基因的PCR扩增
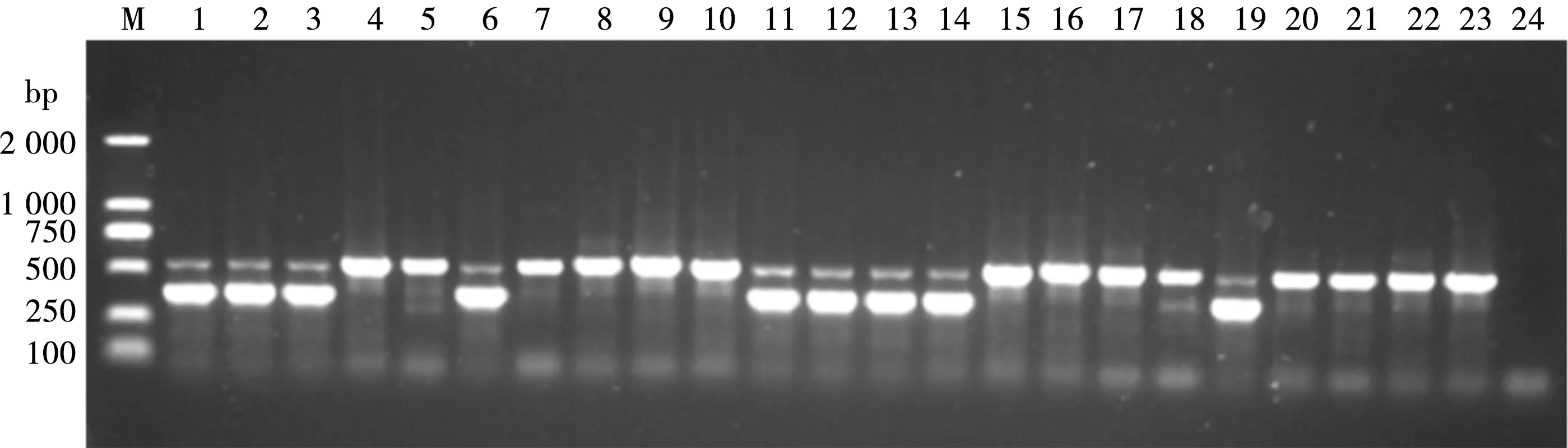
M.DL2000 Marker;1~23. 性别未知鸽子DNA;24. 空白对照;2条带者为雌鸽,1条带者为雄鸽图2 性别未知鸽子CHD基因的PCR扩增
2.3 不同退火温度对雌雄鸽子条带的影响
在对退火温度优化的过程中,发现在600 bp处,雌鸽子的条带较雄鸽子的条带更易受退火温度影响,而雌鸽400 bp处条带则未受影响,如图3所示。
2.4 性腺观察与PCR检测的比对分析
取经过PCR鉴定的23羽鸽子进行解剖,发现白色睾丸(图4右箭头所示)为雄性,发现卵巢、输卵管(图4左箭头所示)则为雌性;这23羽鸽子中,雄性为14羽,雌性为9羽。将解剖结果与PCR检测结果逐一对比,结果显示,通过PCR进行性别鉴定的结果与解剖后观察性腺得到的结果完全一致,其准确率100%。23羽鸽子性别PCR检测结果和解剖结果对比见表1,该对比结果与预测结果完全一致,达到早期判定鸽子性别的目的。

M.DL2000 Marker; 1~6. 依次为雌鸽在49~59 ℃时的扩增;7~12. 依次为雄性鸽子在49~59 ℃时的扩增图3 梯度PCR扩增

图4 雌雄鸽子解剖图
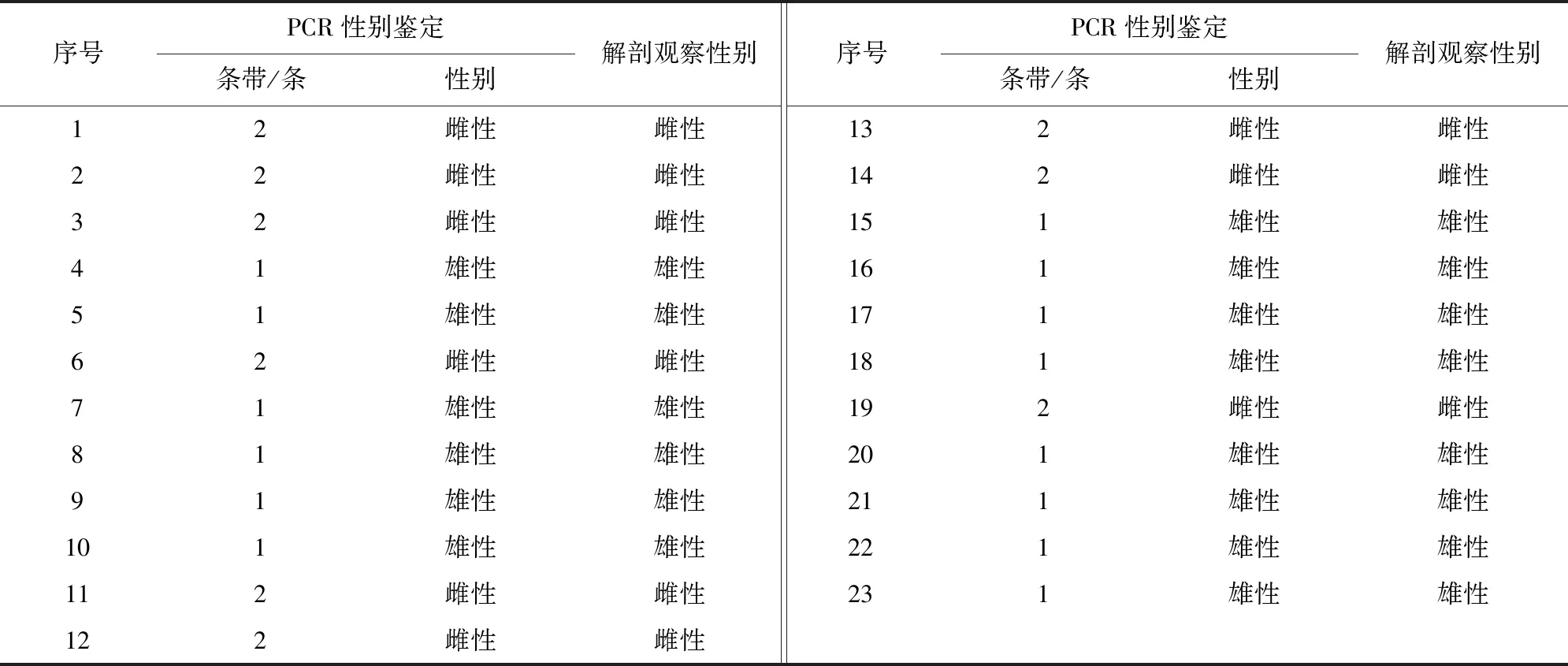
表1 23羽鸽性别PCR扩增结果和解剖检查结果的比较
2.5 PCR产物克隆、测序及比对分析
测序结果显示,雌、雄鸽子PCR扩增产物的回收片段,成功地与VectoerPMD-19T连接,测序峰如图5所示。将所测序列进行Blast,发现含有CHD-Z、CHD-W基因。通过去掉序列中的VectoerPMD-19T片段,分别获得雌、雄鸽子各个片段的具体序列,其中:雄鸽只有1条带,长度为657 bp;雌鸽为2条带,长度分别为449 bp和657 bp。

A.雄鸽600 bp片段;B.雌鸽400 bp片段;C.雌鸽600 bp片段图5 PCR产物测序峰图
3 讨论
鸽子是单态性鸟类,即雌雄同型,即使在性成熟后,也很难从外观上区别出雌雄。而一般家禽,如鸡、鸭、鹅等,出生即可以通过翻肛鉴定性别,且准确率高,已经在养禽业中广泛应用[9]。鸽子作为晚成鸟,不能像一般家禽那样进行性别鉴定,只能等到5月龄左右才可以鉴定性别,而在平常的养殖过程中,不同用途鸽子的饲养成本也是不同的。如果能尽早鉴定出性别,多余的雄鸽就可以作为乳鸽上市,可以很大程度上节约饲养成本,提高经济效益[10-11]。
由于鸟类血液中红细胞含有细胞核,血液中DNA的量比哺乳动物要多,因此国内大部分家禽分子研究多采用采血的方法[12]。本试验采用一种鸽子全血简便快速DNA提取方法,成功提取了鸽子基因组DNA,该方法不仅简便易操作,而且试验成本低廉,并且试验过程中没有使用氯仿、酚等有毒、有害的有机溶剂,与传统的苯酚-氯仿法提取DNA相比,更安全环保。
由于CHD基因进化速率慢,对于非平胸鸟类非常保守[6],随后此基因被广泛应用于非平胸鸟类性别的分子学鉴定。近年来,许多学者都利用CHD基因成功的对非平胸鸟类进行性别鉴定,不仅过程简便,而且结果可靠。本试验通过PCR技术,对CHD基因进行特异性扩增,成功的鉴定出鸽子性别,这与吕夕超等[1]和张莉等[11]的研究结果一致。在PCR扩增的基础上,对获取的PCR产物进行克隆、测序和序列比对,获得雌雄鸽子CHD基因各个片段的具体序列,进一步确证了性别分子鉴定方法的有效性和准确性。
本试验通过对PCR退火温度的优化,发现雌性鸽子600 bp处的条带易受退火温度影响,400 bp处的条带则较为稳定;雄性鸽子600 bp处的条带在一定范围内,退火温度对其并无影响。雌鸽子和雄鸽子在一定退火温度下,所扩增的条带存在差异性,不一定表现为雌鸽2条带、雄鸽1条带,也可均为1条带:400 bp处扩增出条带即为雌鸽,600 bp处扩增出条带即为雄鸽。研究结果为鸽子性别的分子学鉴定提供了一种新的参考。

