弓形虫MIC10基因的克隆与表达
张煊承,李航,谢素珠,赵少伟,王浩,张爽,贾立军
(东北寒区肉牛科技创新教育部工程研究中心,延边大学,吉林 延吉 133002)
刚地弓形虫(Toxoplasmagondii)是一种专性胞内机会性致病原虫,呈世界范围流行,广泛感染几乎所有的温血动物,能够引起严重的人畜共患传染病[1-2]。猫科动物既是其终末宿主,也是其中间宿主之一,科学家们发现弓形虫的中间宿主无选择性,涵盖了各种动物和人[3]。弓形虫基因型分类主要为Ⅰ、Ⅱ、Ⅲ型和非典型基因型,并且每种基因型之间差异较大[4]。Ⅰ型虫株的毒性最强,如RH株;Ⅱ、Ⅲ型的致病能力则较弱,如PLK株和PRU株[5-7]。弓形虫其生活史的各个阶段的抵抗力大不相同,滋养体的抵抗力最弱,卵囊的抵抗力则最强,但其每个阶段均具有感染性,对人类的生命健康和畜牧业的发展造成严重的威胁[8]。
微线体蛋白MIC可根据是否具有跨膜结构分为两类,其中微线体蛋白MIC10属于不具有跨膜结构的蛋白。TgMIC10异于其他的MIC蛋白,在虫体的速殖子期和缓殖子期都存在表达,在前者中的含量约为后者的3倍。成熟的MIC10的分子量为18 kD,它的前导肽序列十分长,由58个氨基酸构成,而成熟的诱导肽序列是由9个二谷氨酸重复和1个不完全的重复序列组成,且诱导肽不含有半胱氨酸[9]。针对重组MIC10制造的抗体可以识别天然MIC10,通过间接免疫荧光试验等对MIC10基因蛋白进行定量,可以帮助区分急性感染和慢性感染[10]。本试验对MIC10基因进行克隆和表达,以期为该基因及其转录蛋白的结构、功能分析及临床应用提供理论基础。
1 材料与方法
1.1 虫株与血清
Vero细胞、弓形虫RH株由延边大学预防兽医学实验室保存;小鼠抗弓形虫阳性血清、弓形虫阴性血清均由延边大学预防兽医学实验室制备、保存。
1.2 试剂
ExTaq DNA聚合酶、限制性内切酶、T4 DNA连接酶、DNA marker等均购自大连宝生物工程有限公司;质粒提取试剂盒和胶回收试剂盒购自Omega公司;BL21感受态购自于北京全式金生物技术有限公司;虫体DNA提取试剂盒购自南京诺唯赞生物科技有限公司;辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG购自上海碧云天生物技术有限公司。
1.3 引物的设计与合成
根据GenBank上登录的弓形虫基因序列(XM_002367312.2),使用Premier 5.0软件设计合成特异性引物,预期597 bp。2条引物5′端分别引入了BamHⅠ和XhoⅠ限制酶切位点。引物由上海英潍捷基有限公司合成。上游引物F1:5′-CGCGGATCC-ATGGCGCTTTCTTCTTTGAACA-3′;下游引物F2:5′-CCGCTCGAGCTACATCGATTTCCTGCGTCT-3′。
1.4 MIC10基因PCR扩增
将获得的弓形虫DNA作为模版,用于PCR反应。PCR反应体系25 μL:模板DNA 1.5 μL,dNTP 1 μL,上下游引物各1 μL,10×Buffer 2.5 μL,Taq酶0.3 μL,去离子水17.7 μL。PCR反应条件:95 ℃进行预变性5 min,94 ℃进行变性1 min,54 ℃退火90 s,30个循环,72 ℃延伸7 min后,4 ℃保存。PCR产物用1%的琼脂糖凝胶电泳进行鉴定。
1.5 MIC10基因重组克隆质粒的构建及测序
将PCR产物与pMD-18T载体连接后,转化到感受态细胞,提取重组质粒,进行PCR鉴定和XhoⅠ、BamHⅠ双酶切鉴定,并将鉴定正确的重组克隆质粒进行测序分析。
1.6 MIC10基因原核表达质粒构建
用XhoⅠ、BamHⅠ双酶切PGEX-4T-1原核表达载体,胶回收载体片段。将重组质粒的酶切胶回收产物与PGEX-4T-1载体的酶切胶回收的产物,连接16 ℃过夜。转化到感受态细胞,提取重组质粒并进行PCR鉴定和XhoⅠ、BamHⅠ双酶切鉴定,1%的琼脂糖凝胶电泳检测鉴定结果。
1.7 重组质粒在大肠杆菌中的表达分析
将鉴定正确的重组质粒转化到大肠杆菌BL21感受态细胞中,IPTG 37 ℃诱导表达。每隔2 h取菌液,离心沉淀,并裂解后,进行SDS-PAGE电泳分析表达产物。以小鼠抗弓形虫阳性血清作为一抗,以辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG作为二抗进行Western blot分析。
2 结果
2.1 弓形虫MIC10基因PCR扩增结果
以弓形虫的DNA为模板,PCR后得到MIC10基因的目的片段。将产物经过1%琼脂糖凝胶电泳后得到597 bp目的条带,扩增条带与预期大小相同。见图1所示。

M. DL 2000 DNA Marker;1、2. MIC10目的基因扩增片段;3. 阴性对照图1 MIC10基因片段PCR扩增结果
2.2 重组克隆质粒鉴定与测序分析
重组质粒pMD18-T-MIC10经PCR鉴定和酶切鉴定,PCR扩增出597 bp的目的片段,见图2所示。经XhoⅠ与BamHⅠ双酶切后,获得约597 bp的目的条带与2 692 bp的载体片段,见图3所示。序列测定分析的结果表明,获得的弓形虫MIC10基因序列与GenBank上弓形虫基因序列(XM_002367312.2)同源性为100%。

M. DL 2000 DNA Marker; 1、2. pMD18-T-MIC10 PCR产物; 3. 阴性对照图2 pMD18-T-MIC10 PCR鉴定

M. DL 5000 DNA Marker; 1、2. pMD18-T-MIC10酶切片段图3 pMD18-T-MIC10双酶切鉴定
2.3 重组表达质粒PGEX-4T-MIC10鉴定
对重组表达质粒PGEX-4T-MIC10进行PCR鉴定和酶切鉴定,PCR扩增出597 bp的目的片段,见图4所示。
M. DL 5000 DNA Marker; 1、2. PGEX-4T-1 PCR产物;3. 阴性对照图4 PGEX-4T-MIC10 PCR鉴定
经XhoⅠ与BamHⅠ双酶切后,获得约597 bp的目的条带和4 969 bp 的载体条带,见图5所示。
M. DL 5000 DNA Marker; 1、2. PGEX-4T-1双酶切片段图5 PGEX-4T-MIC10酶切鉴定
2.4 重组蛋白表达分析
分别取IPTG诱导前样品和诱导后每2 h的样品,进行SDS-PAGE,在约49 kD处出现MIC10基因与载体共同表达蛋白的目的条带,说明重组蛋白表达正确,见图6所示。Western blot分析表明,该蛋白能被小鼠抗弓形虫阳性血清所识别,具有较好的反应原性(图7)。

M.蛋白质 Marker; 1. 诱导前MIC10; 2. 诱导2 h MIC10; 3. 诱导4 h MIC10; 4. 诱导6 h MIC10; 5. 诱导8 h MIC10图6 重组MIC10蛋白SDS-PAGE电泳鉴定
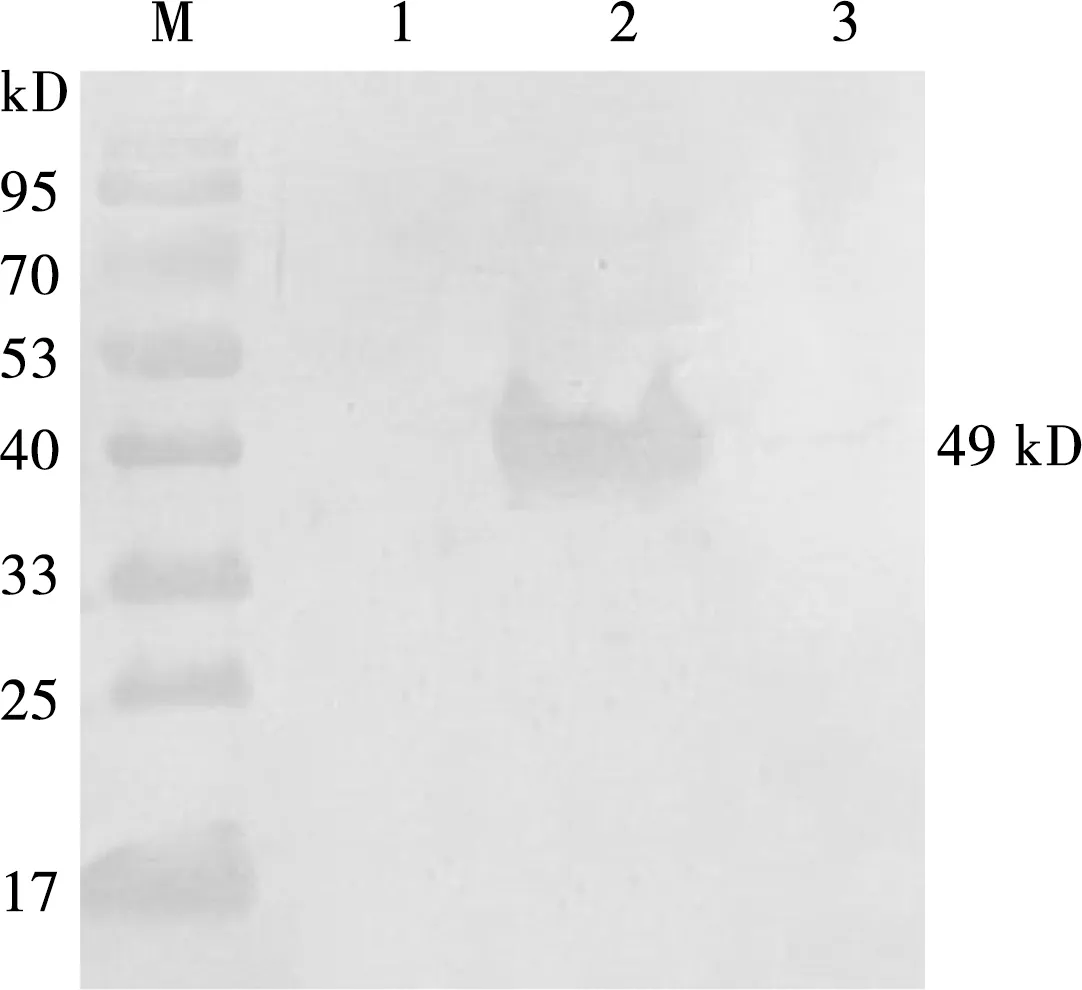
M. 蛋白质 Marker; 1. 诱导前MIC10; 2. 诱导后MIC10; 3. 阴性对照图7 重组MIC10蛋白Western blot分析
3 讨论
作为顶复体门寄生虫,弓形虫和肉孢子虫等一样为专性寄生虫,而且弓形虫为人兽共患病,严重危及人类的生命安全[1]。自弓形虫被发现以来,对它的研究从未中断过,随着分子生物学的发展,弓形虫的感染与致病机制逐渐被明确,但是如何在感染早期及时准确的发现机体被感染仍值得探讨。
弓形虫侵袭和附着宿主细胞靠它的3个主要细胞器产生的蛋白,即棒状体蛋白、致密颗粒蛋白和微粒体蛋白。虫体侵袭过程中最先产生微线体并黏附宿主细胞,随即棒状体释放内容物形成纳虫泡,最后致密颗粒蛋白进入纳虫泡形成纳虫泡膜,完成整个侵袭过程。研究较多的微线体蛋白主要有MIC2和MIC5,MIC2的主要功能是帮助虫体黏附宿主细胞,MIC5则不具有黏附结构,已证实MIC5具有诊断价值,而且与急性弓形虫病患者血中分离到的诊断抗原H4序列相同。
MIC10是微线体蛋白中发现较晚的,但是查阅EST数据库可以发现,MIC10出现频率较高[9]。MIC10的全长序列为198个氨基酸,二级结构主要为α-螺旋,由于缺乏跨膜域,MIC10与宿主细胞受体绑定,因此MIC10可以从感染部位扩散形成循环抗原,而用于弓形虫病的诊断。在速殖子快速增殖的急性感染期MIC10大量表达,蛋白水平远高于其他阶段,因此MIC10可以作为区别急性和慢性感染的主要指标。为了进一步探讨MIC10的功能,制备能够稳定且高效表达MIC10蛋白的表达载体是研究的关键。本试验从NCBI上查阅到弓形虫MIC10基因的碱基序列,用Primer 5.0设计MIC10基因的特异性引物,并在Blast上做了验证,确保了试验所用引物的可靠性。本试验成功扩增了大小为597 bp的MIC10基因片段,构建pMD18-T-MIC10克隆质粒和PGEX-4T-MIC10原核表达载体,经PCR鉴定和双酶切鉴定正确,并在大肠杆菌中成功表达,表达蛋白的分子量约为49 kD。本试验为弓形虫MIC10基因功能的后续研究奠定了基础。

