一种无标记且实时检测CD19 CAR-T细胞杀伤功能的方法
徐溪悦,刘庶慈,汤安群,马 文,郑骏年,刘 丹,施 明
0 引 言
靶向CD19的嵌合抗原受体T细胞(chimeric antigen receptor T-cell, CAR-T)疗法是治疗B细胞恶性肿瘤的一项重大突破[1-2]。2017年,美国FDA批准了两个靶向CD19 的CAR-T产品 (Yescarta和Kyriah)上市[3-4]。研究表明,接受CD19 CAR-T细胞治疗的儿童和成人复发/难治性B细胞白血病患者可达到70%~90%的完全缓解(complete remission, CR)[5]。目前,有多个CD19 CAR-T产品在进行临床研究和临床试验[6]。体外检测CD19 CAR-T细胞对靶细胞的杀伤效应是CD19 CAR-T产品质量控制的关键环节。目前使用的方法主要包括放射性同位素51Cr 释放检测、乳酸脱氢酶释放检测等[7]。这些方法均需要对靶细胞进行标记,操作繁琐这些方法操作繁琐,可重复性低,稳定性差,且均为终点检测法,无法实现对杀伤效应的实时监测。
实时细胞分析(Real Time Cellular Analysis, RTCA)系统是基于电阻抗传感器原理的细胞检测技术。RTCA培养板底部设计有金属微电子感应器,细胞在培养板底部贴壁生长可造成电阻改变。感应器监测这些信号,从而实现对细胞活力、增殖和迁移等动态生物学过程的实时监测[8-10]。目前,RTCA系统已被用于药物疗效评价等领域的研究[11-13]。但是,受限于RTCA的设计原理,其只适用于检测贴壁生长的细胞。而CD19 CAR-T细胞的靶细胞为表达CD19的血液肿瘤细胞,为悬浮生长细胞,无法应用RTCA系统进行检测。
CD19 CAR-T细胞在识别杀伤肿瘤细胞时,通过其细胞外结合域(通常由衍生自特异性靶向CD19的单克隆抗体的单链可变区组成)与表达在肿瘤细胞表面的靶抗原CD19相互接触[14],激活CD19 CAR-T细胞发挥杀伤功能。因此,在本研究中,我们建立了稳定过表达CD19且具有贴壁生长特性的肿瘤细胞株。以该细胞株为靶细胞,能在很大程度上反映CD19 CAR-T细胞对表达CD19的血液肿瘤细胞的杀伤效应,并应用RTCA系统实现了对CD19 CAR-T细胞体外杀伤功能的无标记和实时检测。
1 材料与方法
1.1 材料人乳腺癌细胞株MDA-MB-231、SKBR3购自美国ATCC生物标准品资源中心,DMEM培养基购于美国Hyclone公司;胎牛血清购于北京全式金生物技术有限公司;PE标记的抗人CD19抗体购于天津三箭生物技术股份有限公司;嘌呤霉素购于微科曼得生物工程有限公司;慢病毒LV-CD19-GFP购于上海吉凯基因科技有限公司;Polybrene购于美国Sigma公司;主要仪器包括xCELLigence RTCA DPlus实时无标记细胞分析仪及E-Plate 16 PET为安捷伦生物有限公司产品、倒置荧光显微镜为日本奥林巴斯公司产品、二氧化碳孵育箱为力康生物医疗科技控股有限公司产品、流式细胞仪(FACSCanto II)及流式细胞分选仪(FACSAria III)为美国BD公司产品。
1.2方法
1.2.1 细胞培养人乳腺癌细胞株MDA-MB-231、SKBR3接种于含10%胎牛血清(FBS)的 DMEM培养基中,37 ℃、5% CO2恒温孵箱中培养,取对数生长期细胞进行实验;CD19 CAR-T细胞和BCMA CAR-T细胞由本实验室制备[15-17]。
1.2.2应用慢病毒载体构建过表达CD19的贴壁生长肿瘤细胞分别将人乳腺癌细胞MDA-MB-231和SKBR3接种于6孔板中。接种细胞量为7.5×105细胞/孔。待细胞贴壁后,应用过表达CD19的慢病毒(LV-CD19-GFP)感染MDA-MB-231和SKBR3细胞,复感染指数(multiplicity of infection, MOI)分别为10和17。同时加入感染增强剂Polybrene,以增加慢病毒感染效率。慢病毒感染细胞24 h后,加入嘌呤霉素(Puromycin)至终浓度为2 μg/mL,药物加压筛选感染阳性的细胞。本研究中使用的过表达CD19的慢病毒载体为双顺反子系统,可同时独立表达CD19和绿色荧光蛋白(Green fluorescent protein, GFP)。因此,病毒感染细胞72 h后,用荧光成像观察GFP阳性细胞比例,以评估慢病毒感染效率。荧光显微镜观察时,未感染LV-CD19-GFP的细胞作为阴性对照细胞,明场成像作为荧光成像的对照,可反映慢病毒的感染效率。
1.2.3流式细胞术检测肿瘤细胞株过表达CD19的效果应用PE标记的抗人CD19抗体对嘌呤霉素加压筛选后的细胞进行染色,以母本细胞作为对照细胞。取1×106个细胞,PBS缓冲液洗涤2次。用100 μL PBS重悬细胞,加入PE标记的抗人CD19抗体,冰上孵育30min。细胞经PBS洗涤2次后上BD FACSCanto II流式细胞仪检测,应用Novoexpress软件分析实验结果。
1.2.4流式细胞分选法建立稳定过表达CD19的单克隆细胞株将过表达CD19的SKBR3细胞用PE标记的抗人CD19抗体进行染色,使用BD FACSAria III 流式细胞仪分选CD19阳性细胞,按照1细胞/孔接种至96孔板。单克隆细胞扩大培养后,应用流式细胞术检测各个细胞克隆的CD19表达水平。选取高表达CD19的细胞株保种,命名为SKBR3/CD19,将该细胞用于后续RTCA检测实验。
1.2.5RTCA检测CD19 CAR-T细胞的体外杀伤功能向RTCA检测板(E-Plate 16 PET)中加入50 μL培养基并测定背景阻抗值。收集对数生长期的SKBR3、SKBR3/CD19、MDA-MB-231、MDA-MB-231/CD19细胞并计数,调整细胞悬液浓度至4×105个/mL。E-Plate每孔中加入50 μL的细胞悬液,即每孔2×104个细胞,超净台内放置30 min。将E-Plate放置于仪器的检测台上,检测条件37 ℃、5% CO2,进行实时检测。以CD19 CAR-T细胞为效应细胞,以BCMA CAR-T细胞为对照效应细胞,效靶比(E:T)设定为5∶1、1∶1和1∶5。20 h后,按照不同效靶比,分别向各培养孔中加入CD19 CAR-T细胞/BCMA CAR-T细胞,继续进行实时检测。因CAR-T细胞为悬浮细胞,RTCA无法记录其信号,RTCA记录的校正细胞指数(Normalized Cell Index, NCI)反映贴壁生长的靶细胞的信号,NCI降低表明靶细胞被杀伤。因此,应用RTCA记录的NCI可反映CAR-T细胞对靶细胞的杀伤效应。
2 结 果
2.1构建过表达CD19的MDA-MB-231细胞荧光成像结果显示,大部分的细胞呈现GFP阳性,提示慢病毒感染效率高,见图1。流式细胞术检测结果显示,经嘌呤霉素加压筛选后,99.03%的MDA-MB-231/CD19细胞为CD19阳性表达,而母本MDA-MB-231细胞为CD19阴性表达,见图2。
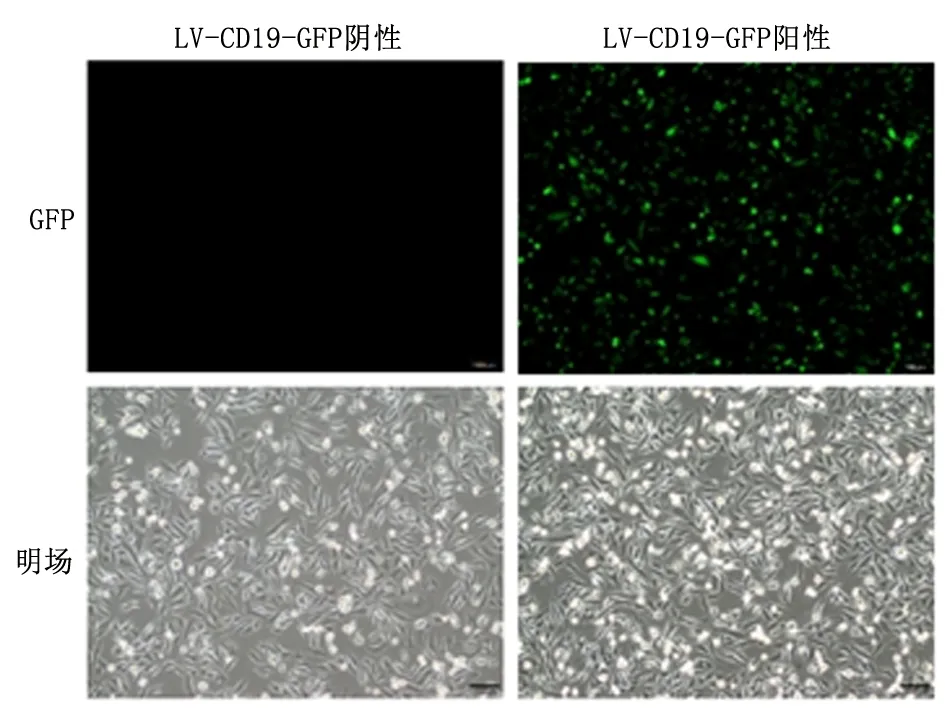
图 1 荧光成像检测慢病毒感染MDA-MB-231细胞的效率(100 μm)
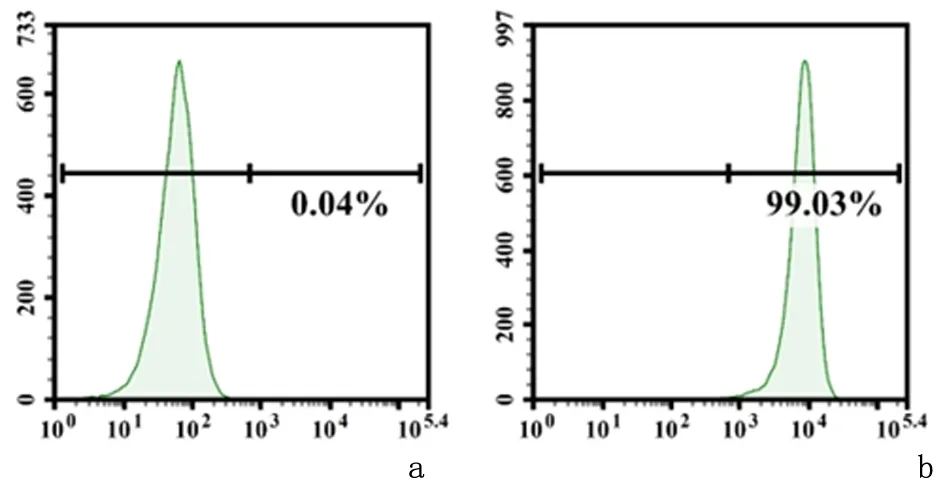
a:MDA-MB-231; b:MDA-MB-231/CD19
2.2构建过表达CD19的SKBR3细胞株荧光成像结果显示,大部分的细胞呈现GFP阳性,提示慢病毒感染效率高,见图3。经嘌呤霉素加压筛选后,SKBR3/CD19细胞中CD19阳性细胞为83.10%,存在17%左右的CD19阴性细胞。流式细胞术检测结果显示,单克隆细胞株CD19阳性细胞为98.91%左右,而母本SKBR3细胞为CD19阴性表达,见图4。
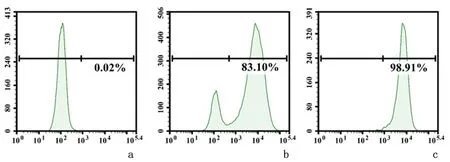
a:SKBR3; b:SKBR3/CD19; c:单克隆细胞株CD19
2.3CD19 CAR-T细胞杀伤功能检测以MDA-MB-231和MDA-MB-231/CD19细胞为靶细胞时,在效靶比为5∶1、1∶1和1∶5的情况下,CD19 CAR-T细胞可有效杀伤MDA-MB-231/CD19细胞,但对MDA-MB-231细胞无明显杀伤作用。BCMA是B细胞成熟抗原,MDA-MB-231或SKBR3均不表达BCMA。BCMA CAR-T细胞对MDA-MB-231/CD19或MDA-MB-231均无明显杀伤作用。以SKBR3和SKBR3/CD19为靶细胞,在效靶比为5∶1和1∶1时,CD19 CAR-T细胞可显著杀伤SKBR3/CD19细胞,而BCMA CAR-T细胞对SKBR3/CD19细胞无显著的杀伤效应。在效靶比为1∶5时,CD19 CAR-T细胞对SKBR3/CD19细胞无明显的杀伤效应。见图5。将MDA-MB-231/CD19作为靶细胞,CD19 CAR-T作为效应细胞的数据单独分析,在靶细胞数量一致的情况下,RTCA检测到的杀伤效应随CD19 CAR-T细胞的数量增加而增加。
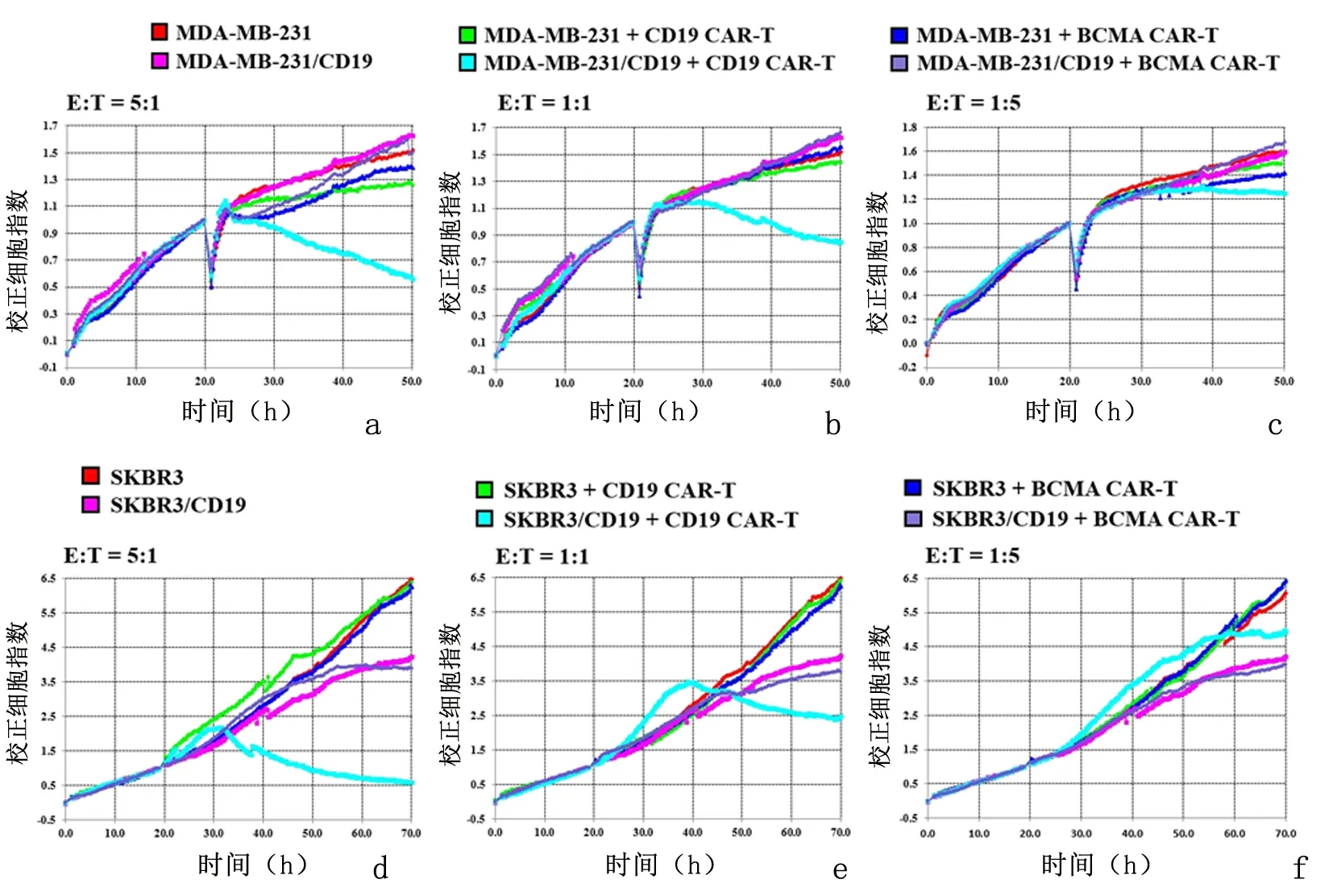
a-c:分别为效应靶比为5∶1、1∶1和1∶5时,MDA-MB-231或MDA-MB-231/CD19细胞NCI的变化情况;d-f:分别为效应靶比为5∶1、1∶1和1∶5时,SKBR3或SKBR3/CD19细胞NCI的变化情况
将SKBR3/CD19作为靶细胞,CD19 CAR-T作为效应细胞的数据单独分析,在靶细胞数量一致的情况下,RTCA检测到的杀伤效应随CAR-T细胞的数量增加而增加,见图6。
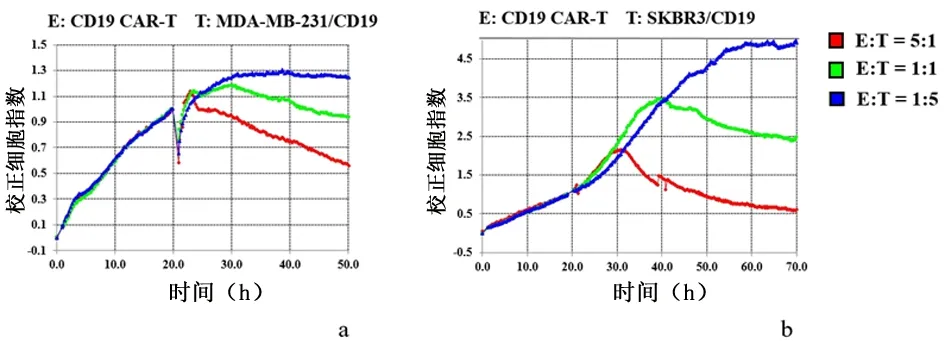
a:MDA-MB-231/CD19细胞作为靶细胞,CD19 CAR-T细胞作为效应细胞;b:SKBR3/CD19细胞作为靶细胞,CD19 CAR-T细胞作为效应细胞
3 讨 论
CAR-T细胞是一种体外制备的免疫细胞治疗产品,存在T细胞来源的个体差异大、制备工艺不成熟以及生物学效力评价复杂等问题[18]。因此,质量评估研究对于保障CAR-T细胞产品的安全、有效性具有重要意义。与目前的药品制剂质量评价方式不同,CAR-T细胞产品作为一种活细胞“药物”,需对细胞纯度、活细胞比率、微生物安全性以及生物学效力等进行评估[19],其中CAR-T细胞对靶细胞杀伤活性的评价与其疗效密切相关,是CAR-T细胞产品质量控制的关键环节。
目前,检测免疫细胞体外杀伤效率的方法主要包括核素法、酶释放法和化学发光法等。核素法,如同位素51Cr 释放检测法,是评价免疫细胞杀伤功能的经典方法[20]。用51Cr标记靶细胞,检测靶细胞受损或死亡时释放到细胞外的51Cr放射活性即可计算出效应细胞对靶细胞的杀伤效率。但标记后的靶细胞可自发释放51Cr,且51Cr半衰期短。此外,51Cr是放射性物质,操作存在安全隐患。酶释放法,如乳酸脱氢酶释放法,其检测原理与核素法相似。此法虽无需标记,避免了同位素检测法的放射性污染问题,但其可重复性低,稳定性较差。而且,效应细胞也能释放乳酸脱氢酶,干扰结果。化学发光法包括荧光素酶生物发光检测法等。建立稳定表达荧光素酶的靶细胞系,通过测定荧光信号值的高低即可代表存活靶细胞的数目,从而计算出效应细胞的杀伤效率。但是,该方法需要裂解靶细胞释放荧光素酶或添加底物检测存活靶细胞中荧光素酶的活性等繁琐步骤,检测费时费力。更为重要的是,上述3种方法检测CAR-T细胞杀伤功能时,仅能评估单一时间点的杀伤效应。检测CAR-T细胞杀伤靶细胞的动态变化过程,需要检测多个时间点,使工作量大大增加。
RTCA系统可用于评价CAR-T细胞对贴壁肿瘤细胞的杀伤效应。而表达CD19的血液肿瘤细胞均为悬浮生长细胞,如果用这些细胞作为靶细胞,无法使用RTCA系统检测CD19 CAR-T细胞的杀伤活性。
在本研究中,我们构建了贴壁生长且稳定过表达CD19的肿瘤细胞,以其作为靶细胞,结合RTCA系统建立了一种体外检测CD19 CAR-T细胞杀伤活性的方法。该方法与核素法相比,避免了自发释放及同位素的安全隐患问题;与酶释放法相比,避免了效应细胞的干扰问题,可重复性好、灵敏度高;与化学发光法相比,操作简便,稳定性和准确性高。并且使用RTCA系统,可通过一次实验对CD19 CAR-T细胞杀伤靶细胞的全部过程进行动态实时监测,无需对靶细胞进行标记,省时省力。该方法的实验结果以动态杀伤曲线的形式展示,简洁明了,可实现对CD19 CAR-T细胞的体外杀伤生物学效力评价。本研究建立的实验方法未来可能应用于CD19 CAR-T细胞产品的质量评估。

