H2O2诱导人滋养细胞HTR-8/SVneo焦亡模型的建立
杨美娟,虞天一,乔东艳,张建琼,于 红
0 引 言
子痫前期指妊娠20周后孕妇新发高血压和蛋白尿的一种系统性疾病,发病率为2%~8%,严重危害母儿健康[1]。研究表明,胎盘因素在子痫前期的发病中占重要地位,发病机制倾向于胎盘血管重塑障碍引发的胎盘源性疾病[2]。胚胎在4细胞时期开始建立极性,形成具有上皮样极性的滋养外胚层以及被滋养外胚层包裹的内细胞团[3],其中,绒毛外滋养细胞是由胚胎外滋养层中细胞滋养细胞分化发育而来,具有增殖与侵袭能力,对母体子宫内膜的黏附及侵入是胎盘形成的前提,向子宫内膜局部侵袭,参与胎盘血管重塑。
细胞焦亡是不同于细胞凋亡和坏死的一种由GSDMD(gasdermin D)分子介导的程序性细胞死亡,光镜下可见细胞肿胀、碎裂及质膜气泡形成等典型改变[4]。经典途径的激活包括2个中心环节:炎性小体的激活及GSDMD分子穿孔活性的释放。NLRP3炎性小体是氧敏感性炎性小体,过氧化氢(H2O2)是一种很强的氧化剂,诱导机体氧化应激产生大量的活性氧(reactive oxygen species, ROS),ROS激活核苷酸结合寡聚化结构域样受体蛋白 3(nucleotide-binding oligomerization domain-like receptor protein 3, NLRP3)炎性小体,进一步参与细胞焦亡通路的激活[5]。 NLRP3炎性小体的激活需要“启动”和“激活”2个信号通路[6]。细胞焦亡是机体先天免疫的重要机制,参与多种疾病的发生发展,如心血管系统疾病动脉粥样硬化[7]、神经系统疾病阿尔兹海默病[8]、呼吸系统急性损伤[9]等,且发挥重要作用。已有研究表明,NLRP3炎性小体及焦亡通路的激活与子痫前期发病具有相关性[10-11]。且本课题组前期研究发现,与对照组相比,早发型子痫前期组孕妇血清中IL-1β的表达量明显升高[12]。因此,本研究旨在构建H2O2诱导滋养细胞焦亡模型, 体外模拟氧化应激反应诱导滋养细胞发生焦亡损伤的病生理过程,为后续相关实验提供一定的实验基础。
1 材料与方法
1.1 主要试剂与抗体人滋养细胞HTR-8/SVneo购买于北纳创联生物科技有限公司,1640培养基及胎牛血清购买于美国Gibco公司,Trizol购买于美国Sigma公司,逆转录试剂盒、SYBR qPCR Master Mix购买于南京诺唯赞生物科技有限公司,caspase-1、cleaved caspase-1抗体购买于美国Abcam公司,GSDMD抗体、IL-1β抗体购买于美国Santa Cruz,GAPDH抗体购买于南京迅贝公司,蛋白定量试剂盒(BCA Protein Assay kit)购买于美国Pierce公司。
1.2 方法
1.2.1 细胞总蛋白提取及蛋白印迹实验人滋养细胞HTR-8/SVneo培养于1640+10%胎牛血清+1%抗生素中。5% CO2及37 ℃恒温培养箱中培养,每24小时换液1次。取对数生长期细胞,2.5×105个接种于6 cm的培养皿里,培养箱中培养12 h后,给予H2O2(100、150、200、250 μmol/L)处理细胞(2、4、6、12 h),诱导人滋养细胞HTR-8/SVneo焦亡模型;对照为1640+10%胎牛血清+1%抗生素正常培养细胞。提取细胞总蛋白,按照BCA试剂盒使用说明操作,测定待测样本蛋白质浓度。将待测蛋白质样品经SDS-PAGE凝胶电泳分离,转膜后用5%脱脂奶粉常温封闭2 h。加入一抗(稀释倍数严格按照说明书)后置于4 ℃冰箱过夜,弃一抗,1×TBST溶液清洗,加入辣根过氧化物酶偶联的二抗(1∶10 000),室温1 h,1×TBST溶液清洗,依次进行曝光、显影、定影处理。
1.2.2RT-qPCR检测细胞中mRNA水平按TRizol方法提取细胞中总RNA,按照逆转录试剂盒进行逆转录,按照SYBR试剂盒进行PCR扩增,每份样品均做3个复孔,重复3次。相关引物如下,NLRP3:Forward primer (5′-3′) GAGGAAAAGGAAGGCCGACA,Reverse primer (5′-3′) TGGCTGTTCACCAATCCATGA;Caspase-1:Forward primer (5′-3′) TTTCCGCAAGGTTCGATTTTCA,Reverse primer (5′-3′) GGCATCTGCGCTCTACCATC;IL-1β:Forward primer (5′-3′) AGCTACGAATCTCCGACCAC,Reverse primer (5′-3′) CGTTATCCCATGTGTCGAAGAA;IL-18:Forward primer (5′-3′) ACTGTAGAGATAATGCACCCCG,Reverse primer (5′-3′) AGTTACAGCCATACCTCTAGGC;GSDMD:Forward primer (5′-3′) GAGTGTGGCCTAGAGCTGG,Reverse primer (5′-3′) GGCTCAGTCCTGATAGCAGTG;GAPDH:Forward primer (5′-3′) CGTGGAAGGACTCATGACCA,Reverse primer (5′-3′) GGCAGGGATGATGTTCTGGA。
1.2.3 倒置相差显微镜观察细胞形态学改变对数生长期细胞,以2.5×105个接种于6 cm的培养皿里,培养箱中培养12 h后,给予H2O2处理,设立对照(正常培养细胞),倒置显微镜下,以倍数(×20)观察细胞形态改变并拍照。

2 结 果
2.1 H2O2诱导滋养细胞焦亡模型的最佳浓度当H2O2浓度为150 μmol/L时,作用于滋养细胞(2、4、6、12 h),caspase-1的蛋白水平较对照明显升高,且可检测出相应的剪切片段Cleaved caspase1;随着H2O2浓度的增加,细胞焦亡经典通路中关键分子切割片段Cleaved caspase-1的蛋白水平的表达被抑制,见图1。上述结果提示,H2O2诱导滋养细胞焦亡模型的最佳浓度为150 μmol/L。

1-4:分别为100、150、200、250 μmol/L;5:control
2.2 H2O2诱导滋养细胞焦亡模型的最适时间当H2O2为150 μmol/L,处理滋养细胞4h时,焦亡相关分子NLRP3、caspase1、切割片段Cleaved caspase1、GSDMD及IL-1β的蛋白水平明显高于对照,且随着作用时间的延长,蛋白质表达水平被抑制,见图2。结果提示H2O2诱导滋养细胞焦亡模型的最佳作用时间为4 h。
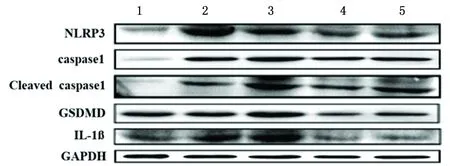
1:对照;2-5:分别为150 μmol/L H2O2作用2、4、6、12 h
2.3 H2O2诱导NLRP3炎性小体活化的“启动”和“激活”信号当H2O2为150 μmol/L,作用时间为2 h时,细胞焦亡经典通路中上游关键部分NLRP3炎性小体“ 启动” 信号相关分子NLRP3及IL-1β的mRNA水平较对照明显上调(P<0.0001),同时,NLRP3炎性小体“ 激活” 信号刺激下,细胞焦亡经典通路中上游关键分子caspase1 的mRNA水平亦较对照组明显升高(P<0.0001);4 h时,细胞焦亡经典通路中的关键分子GSDMD的mRNA水平及下游炎症因子IL-18的mRNA 水平明显高于对照组(P<0.05)。通过焦亡相关分子mRNA水平的逆向验证,H2O2诱导滋养细胞焦亡模型最佳条件是150 μmol/L和4 h,见图3。

*P<0.05,**P<0.01,***P<0.001
2.4 滋养细胞系HTR-8/SVneo焦亡模型的典型形态学改变光镜下可明显观察到,滋养细胞呈多边形,紧密排列、边界清晰可见,核浆比例明显。设置H2O2浓度为150 μmol/L,作用于滋养细胞HTR-8/SVneo 4 h,光镜下可明显看到细胞肿胀、碎裂及质膜气泡形成等细胞焦亡典型改变。另外,随着H2O2浓度的增加及作用时间的延长,几乎所有的滋养细胞出现质膜气泡并聚集在一起呈“葡萄状”。见图4。

a:对照; b-d:150 μmol/L 4 h时红框部分分别出现细胞肿胀、破碎、质膜气泡; e:250 μmol/L 12 h时细胞呈“葡萄状”
3 讨 论
子痫前期发病机制的两阶段学说:第 1 阶段为病理生理变化形成过程,滋养细胞侵袭不足引起妊娠早期母体子宫螺旋动脉重塑障碍,胎盘灌注不足、缺血缺氧,发生氧化应激,释放多种胎盘因子,参与子痫前期的发生发展;第 2 阶段为胎盘因子进入母体血液循环引起器官受损及相关临床症状[13]。氧化应激是指机体受到刺激时引起的氧化系统与抗氧化系统失衡的一种状态,滋养细胞侵袭不足引起妊娠早期母体子宫螺旋动脉重塑障碍,胎盘灌注不足、缺血缺氧,最终发生氧化应激,引起ROS的积聚,参与子痫前期的发生发展[14]。
氧化应激产物ROS可激活NLRP3炎症小体并参与细胞焦亡途径[15-16]。本研究通过对临床标本进行焦亡相关分子检测,发现子痫前期患者体内存在滋养细胞焦亡通路的激活,提出假设,滋养细胞侵袭不足,子宫螺旋动脉重塑障碍,胎盘灌注不足,胎盘界面缺血-再灌注损伤,胎盘界面滋养细胞发生氧化应激反应,ROS积聚, 诱导滋养细胞焦亡,释放炎症因子,参与子痫前期发生发展,引起相关临床症状。H2O2是研究细胞氧化应激损伤的一种重要的活性氧,极易透过细胞膜形成高活性的自由基,是构建滋养细胞HTR-8/ SVneo发生氧化应激损伤模型中常用工具[17-18]。HTR-8/SVneo滋养细胞系是第一个绒毛外细胞滋养层细胞系,常用于研究滋养细胞侵袭、增殖及调节功能[19-20]。侵袭表型的绒毛外滋养细胞在对母体子宫蜕膜及浅肌层侵袭过程中可分化为间质表型绒毛外滋养细胞,HTR-8/ SVneo细胞系含有上皮细胞和间充质细胞,可解释上皮-间质转化现象[21],为验证上述假设,本研究选择H2O2诱导HTR-8/ SVneo滋养细胞焦亡模型,为后续探究子痫前期的发病机制提供实验基础。
在细胞焦亡经典途径中, NLRs为PRRs的一种,在病原微生物的刺激下,NLRP3受体通过接头蛋白凋亡相关斑点样蛋白(ASC)与 caspase-1前体相连形成焦亡小体[22],caspase-1/4/5/11裂解后特异性切割细胞中的 GSDMD 蛋白释放其穿孔活性,GSDMD-N功能区域汇聚在细胞膜上形成12~14nm的微小孔洞,细胞内外离子梯度形成,水分内流,细胞肿胀,导致细胞渗透性裂解及成熟型炎性因子IL-1β和IL-18释放到细胞外液中,最终引起炎症反应[23-24]。NLRP3炎性小体的活化包括“启动”跟“激活”2个信号[25],①启动信号:NLRP3受体识别危险信号如ROS后通过NF- κB途径对 NLRP3 和pro-IL-1β蛋白的转录水平进行调控;②激活信号:NLRP3受体激活后引起焦亡小体的构象改变重新组装。caspase-1的特异性裂解,Cleaved caspase-1对胞内促炎因子前体进行加工修饰并使其成熟;同时Cleaved caspase-1对效应分子GSDMD分子进行剪切,释放其穿孔活性,最终导致成熟型促炎因子由胞内借由膜上孔洞分泌到胞外进而诱发炎症反应的过程[26-27]。
根据本研究细胞焦亡经典通路中关键分子的蛋白及mRNA水平,H2O2诱导滋养细胞焦亡模型的最佳条件是4h和150μmol/L,在该条件下,NLRP3焦亡小体的“启动”跟“激活”2个信号通路都相继诱导成功;焦亡经典通路中上游“启动”信号关键分子NLRP3及IL-1β的mRNA水平明显上调(P<0.0001),焦亡经典通路中关键分子GSDMD及下游炎症因子IL-18的mRNA水平也明显高于对照组;同时,焦亡相关分子NLRP3、caspase1、Cleaved caspase1、GSDMD及IL-1β的蛋白水平明显高于对照组,且随着作用时间的延长,相应分子的蛋白质表达水平被抑制;在光镜下明显观察到细胞肿胀、碎裂及质膜气泡形成等细胞焦亡典型改变。该模型从宏观到微观都检测到相应的细胞焦亡改变,H2O2诱导滋养细胞焦亡模型建立成功,体外模拟氧化应激反应诱导滋养细胞发生焦亡损伤的病生理过程,为后续相关实验提供一定的实验基础。
综上所述,本研究显示在子痫前期发生发展中,滋养细胞侵袭不足引起氧化应激反应,氧化应激产物ROS的积聚活化了NLRP3炎性小体,参与滋养细胞焦亡通路的激活,炎性因子释放,引起炎症相关临床综合征。本研究为更深入地了解子痫前期发病机制提供新的研究方向。目前实验数据还未完善, 需要后续的动物模型进一步验证,在氧化与抗氧化状态下,体内验证胎盘界面氧化应激反应、滋养细胞焦亡及子痫前期发病机制之间的相关性,有利于我们对子痫前期发病机制及其病理生理过程更好的理解,从其作用机制通路中关键环节上进行干预将为子痫前期的诊治及新药的研发提供新的思路和方向。

