顺铂联合培美曲塞治疗表皮生长因子受体突变晚期非小细胞肺腺癌的临床疗效
陈东堂,冉秀荣
1商丘市第三人民医院药剂科,河南 商丘 476000
2商丘市第一人民医院全科医学科,河南 商丘 476000
肺癌是最常见的恶性肿瘤,非小细胞肺癌(nonsmall cell lung cancer,NSCLC)占所有肺癌的70%~85%[1]。肺癌起病隐匿,多数患者诊断时已为晚期,失去手术的机会[2],在无任何治疗干预情况下患者的中位生存期仅5~10个月[3]。表皮生长因子受体(epidermal growth factor receptor,EGFR)突变与肿瘤细胞的增殖、分化、侵袭、转移和血管生成密切相关[4]。研究显示,与含铂两药联合化疗方案相比,携带EGFR敏感突变的晚期NSCLC患者小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)的疗效更好且不良反应更低,已成为EGFR突变晚期NSCLC的一线化疗选择[6-7],但EGFR基因敏感突变的NSCLC患者的一线治疗方案尚未确定。本研究比较顺铂+培美曲塞与顺铂+吉西他滨治疗的EGFR突变晚期NSCLC的疗效和安全性,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月至2018年7月商丘市第三人民医院收治的EGFR突变晚期NSCLC患者。纳入标准:①均经病理学检查确诊为NSCLC;②TNM分期为Ⅲb或Ⅳ期;③生存期>3个月;④美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况评分(performance status,PS)为0~2分。排除标准:①有EGFR-TKI类药物治疗史;②肝肾功能及血常规异常;③病灶不能客观测量。依据纳入和排除标准,本研究共纳入112例EGFR突变晚期NSCLC患者,根据治疗方案分为观察组(n=57)和对照组(n=55),对照组患者接受顺铂+吉西他滨治疗,观察组患者接受顺铂+培美曲塞治疗。对照组中男30例,女25例;平均年龄为(59.80±9.11)岁;ECOG PS评分:0~1分32例,2分23例;TNM分期:Ⅲb期36例,Ⅳ期19例。观察组中男35例,女22例;平均年龄为(60.14±8.45)岁;ECOG PS评分:0~1分30例,2分27例;TNM分期:Ⅲb期32例,Ⅳ期25例。两组患者性别、年龄和TNM分期等临床特征比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
对照组患者接受顺铂+吉西他滨方案化疗:第1天,顺铂25 mg/m2加入500 ml生理盐水中,静脉滴注;第3天,吉西他滨1000 mg/m2加入100 ml生理盐水中,静脉滴注;观察组患者接受顺铂+培美曲塞方案化疗:第1天,顺铂25 mg/m2加入500 ml生理盐水中,静脉滴注;第3天,培美曲塞500 mg/m2加入150 ml生理盐水中,至少10 min静脉滴注;培美曲塞使用前1周开始补充维生素B12和叶酸;用药期间口服4 mg地塞米松,每天2次。两组患者均每3周重复,均至少完成2个疗程。化疗前后应用5-HT3抑制剂,必要时使用重组人粒细胞集落刺激因子防止白细胞下降。
1.3 随访方法
治疗期间记录所有可能与治疗相关的不良反应及合并用药情况,直至患者疾病进展或出现不可耐受的不良反应,每治疗2个周期进行1次疗效评价。治疗结束后或化疗3个周期完成后,采用电话或定期医院复查的方式随访,随访时间8.2~14.3个月,中位随访时间11.5个月,截止至2019年3月。
1.4 观察指标和评估标准
治疗2个周期后,依据实体瘤疗效评价标准(response evaluation criteria in solid tumour,RECIST)[9]评估两组患者的临床疗效,包括完全缓解、部分缓解、病情稳定和疾病进展。总有效率=(完全缓解+部分缓解)例数/总例数×100%,疾病控制率=(完全缓解+部分缓解+病情稳定)例数/总例数×100%,比较两组患者的无进展生存时间(progression-free survival,PFS)和总生存时间(overall survival,OS)。
治疗前和治疗3个月后,采用酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)检测两组患者血清肿瘤标志物,包括癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原125(carbohydrate antigen 125,CA125)、血管内皮生长因子(vascular endothelial growth factor,VEGF)水平,操作步骤严格按照说明书进行。
依据美国国立癌症研究所常见毒性分级标准3.0版(National Cancer Institute common toxicity criteria version 3.0,NCI-CTC v3.0)比较两组患者的不良反应,分为0~4级。
1.5 统计学方法
采用SPSS 22.0软件对所有数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用两独立样本t检验,组内比较采用配对样本t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;等级资料的比较采用秩和检验;采用Kaplan-Meier法绘制生存曲线,生存率的比较采用Log-rank检验;以P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效的比较
入组的112例晚期NSCLC患者均可进行疗效评价,中位随访时间为11.5个月(8.2~14.3个月)。观察组患者的临床疗效优于对照组患者,差异有统计学意义(Z=2.098,P=0.036)。观察组患者的疾病控制率为73.68%(42/57),高于对照组患者的54.55%(30/55),差异有统计学意义(χ2=4.466,P=0.035)。观察组患者的总有效率为43.86%(25/57),高于对照组患者的29.09%(16/55),差异无统计学意义(χ2=2.631,P=0.105)。(表1)
2.2 肿瘤标志物水平比较
治疗前和治疗后3个月,两组患者CEA、CA125和VEGF水平比较,差异均无统计学意义(P>0.05)。治疗后3个月,两组患者CEA、CA125和VEGF水平均低于本组治疗前,差异均有统计学意义(P<0.05)。(表2)

表1 两组患者的临床疗效[n(%)]*
表2 治疗前和治疗后3个月两组患者血清肿瘤标志物水平的比较(±s)
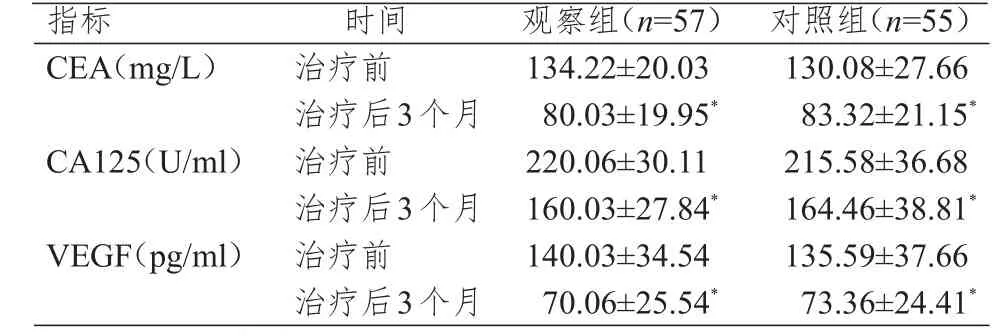
表2 治疗前和治疗后3个月两组患者血清肿瘤标志物水平的比较(±s)
注:*与本组治疗前比较,P<0.05
指标C E A(m g/L)C A 1 2 5(U/m l)V E G F(p g/m l)治疗前治疗后3个月治疗前治疗后3个月治疗前治疗后3个月1 3 4.2 2±2 0.0 3 8 0.0 3±1 9.9 5*2 2 0.0 6±3 0.1 1 1 6 0.0 3±2 7.8 4*1 4 0.0 3±3 4.5 4 7 0.0 6±2 5.5 4*1 3 0.0 8±2 7.6 6 8 3.3 2±2 1.1 5*2 1 5.5 8±3 6.6 8 1 6 4.4 6±3 8.8 1*1 3 5.5 9±3 7.6 6 7 3.3 6±2 4.4 1*时间观察组(n=5 7)对照组(n=5 5)
2.3 生存情况的比较
观察组患者的中位PFS为15.00个月(95% CI:12.80~17.15个月),长于对照组患者的12.00个月(95% CI:10.08~14.10个月),差异有统计学意义(χ2=19.734,P<0.05)。观察组患者中位 OS为22.00个月(95% CI:20.03~23.64个月),长于对照组的17.00个月(95% CI:15.50~19.55个月),差异有统计学意义(χ2=19.459,P<0.05)。(图1、图2)

图1 观察组(n=57)和对照组(n=55)EGFR突变晚期NSCLC患者的无进展生存曲线

图2 观察组(n=57)和对照组(n=55)EGFR突变晚期NSCLC患者的总生存曲线
2.4 不良反应情况的比较
两组患者的不良反应主要表现为血液毒性、消化道反应和肝肾功能损伤,胃肠道反应主要表现为恶心、呕吐,均为1~2级。观察组患者中性粒细胞减少的发生率最高,其次为贫血;对照组患者血小板减少发生率最高,其次为中性粒细胞减少。两组患者中性粒细胞减少、贫血、血小板减少、胃肠道反应和肝肾功能损害发生率的比较,差异均无统计学意义(P>0.05)。(表3)

表3 两组患者的不良反应情况[n(%)]
3 讨论
肺癌发病率和病死率均均全球首位,且中国肺癌的发病率仍呈逐年上升趋势。以铂类药物为基础的两药联合化疗是晚期NSCLC患者的主要治疗手段之一,常见的一线标准化疗方案包括顺铂+紫杉醇、顺铂+吉西他滨、顺铂+培美曲塞等[8],这些化疗方案的总体疗效类似,但针对不同人群化疗方案的优选仍是当前临床治疗中亟待解决的问题。
EGFR是细胞膜表面的糖蛋白受体,属于络氨酸激酶受体家族成员,NSCLC细胞膜表面阳性表达率达40%~80%[9],EGFR通过与其受体结合介导下游信号通路,主要包括磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)和大鼠肉瘤癌基因(rat sarcoma oncogene,RAS)/促分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK)通路活化,诱导EGFR自身酪氨酸的磷酸化,从而促进肿瘤细胞的生长、增生、转移。EGFR突变多见于del19缺失突变、L858R替换突变和G719X替换突变等,这些突变因未存在相应的配体而使激酶本身的活性强化,打破激酶的激活和非激活平衡,使非激活状态的EGFR向激活状态转化,使肿瘤增殖分化状态更剧烈,因此,与EGFR突变NSCLC患者相比,EGFR突变的NSCLC患者的预后效果更差。寻找抑制肿瘤细胞周期进程,增加耐受性降低不良反应的化疗药物至关重要。
培美曲塞是一种含吡咯嘧啶集团的抗叶酸剂,进入细胞通过多谷氨酸合成酶的作用将其转化成多谷氨酸的形式,通过破坏肿瘤细胞内叶酸依赖性的代谢过程,抑制细胞复制,发挥抗肿瘤作用。培美曲塞代谢物在肿瘤细胞中半衰期较长,间接增加了培美曲塞在肿瘤细胞中的作用时间,增强了药效,降低了剂量相关性不良反应的发生程度[10]。体外研究显示[11],培美曲塞广泛应用于结肠癌、乳腺癌、白血病、胰腺癌、肺癌、胃癌等多种恶性肿瘤中,且具有较好的抗肿瘤活性。美国食品药物管理局(FDA)于2008年9月30日批准叶酸酯类似物代谢抑制剂培美曲塞的适应证,并将其与顺铂的联用作为伴有非鳞状组织学特征特性的局部晚期和远处转移的NSCLC患者的一线治疗方案[12]。一项大型随机Ⅲ期临床研究比较培美曲塞和多西他赛类药物在晚期NSCLC治疗中的效果和毒性分析,结果发现,二者具有相似的有效率和生存率,但培美曲塞骨髓抑制的发生率及严重程度明显低于多西他赛[13],表明培美曲塞与铂类药物联用较其他铂联合方案具有相似疗效但毒性反应发生率明显较低。本研究结果显示,与顺铂+吉西他滨相比,顺铂+培美曲塞的近期有效率更好,中位无进展生存时间、总生存时间较长,与既往研究报道一致[14]。李远航和白维君[15]回顾性分析了100例晚期非鳞状NSCLC患者的临床资料,给予培美曲塞联合铂衍生物治疗,结果显示,无进展生存期和总生存期均较高,分别为127天和191天,效果优于其他含铂联合方案的治疗效果相比,中位总生存期也明显长于其他含铂联合方案(781天vs360天)。本研究结果显示,两种化疗方案不良反应发生率无明显差异,这与Manegold等[16]研究报道并不一致,可能与样本量和研究对象的选择差异有关。
此外,本研究未发现两种治疗方案对肿瘤标志物血清CEA、CA125、VEGF水平无明显影响,二者在抗肿瘤细胞的增殖、侵袭和新血管生成等方面并无明显差别,与既往研究报道并不一致[17-18]。尚需扩大样本进行多中心随机对照实验以确定顺铂+培美曲塞对肿瘤标志物水平的影响。
综上所述,顺铂联合培美曲塞治疗EGFR突变晚期NSCLC疗效较好,值得临床使用。

