奶牛妊娠相关糖蛋白BoPAG7和BoPAG8的表达及其结构与功能预测
杨亚军,何金科,宋胜男,杨宁宁,陈创夫,3*,王震,3*
(1. 石河子大学生命科学学院,新疆 石河子 832000;2. 石河子大学动物科技学院,新疆 石河子 832000;3. 石河子大学西部地区高发人兽共患传染性疾病防治协同创新中心,新疆 石河子 832000)
妊娠相关糖蛋白(PAGs)是反刍动物滋养细胞产生的一大类分泌型蛋白[1]。PAGs形成了一个大的糖蛋白多态性家族,在牛滋养细胞中表达了超过20个PAG(BoPAGs)成员。第一个分离牛胎盘的BoPAG称BoPAG1,因蛋白分子量是 67 kD,所以又称BoPAG 67 kD[2]。PAGs属于脊椎动物天冬氨酸蛋白酶家族,因此它们与胃蛋白酶、凝乳酶、组织蛋白酶D或肾素等多种酶直接相关[3]。基于这一关系,许多研究分析了一些PAGs中的蛋白水解酶活性[4-6]。它们被怀疑在胎盘-子宫界面潜在生长因子的生化处理中起作用[7]。另一方面,由于催化位点周围的氨基酸置换,所以牛PAGs没有酶活性[8-9]。但PAGs仍被认为具有免疫调节和黄体生成作用[10]。尽管PAG被称为与怀孕相关,但是PAG在维持妊娠和发挥的具体功能目前尚不清楚[11]。根据序列的系统发育分析,PAG可以分为两类:“古代” PAG和“现代” PAG[12]。“现代”PAG的表达通常仅限于双核滋养细胞(BNC),而古代PAG主要在单核滋养细胞(UNC)中表达[1]。BoPAG7属于“现代”,而BoPAG8属于“古代”。现代PAGs组的成员可以用作牛血或牛奶中的生化妊娠标记[13]。PAGs着床后立即在怀孕初期分泌出来,在牛受精的第19天,进入母体循环并作为怀孕检测的特定标记[14]。它们被认为是用于怀孕检测的首选分子,因为它们在评估胎儿的生存能力和早期胚胎死亡率方面具有其他用途。母体血液中PAGs的水平下降,并在早期胚胎死亡期间逐渐消失,因此成为胚胎存活的独特生物标记[15]。研究表明,BoPAG7在妊娠早期在胎盘组织中比其他妊娠相关糖蛋白更丰富[11]。通过实施定量检测发现,妊娠早期胎盘组织中BoPAG8有较高转录水平[16],表明BoPAG7和BoPAG8蛋白在妊娠期发挥着重要的作用。本试验旨在采取原核表达的方法制备荷斯坦奶牛BoPAG7和BoPAG8蛋白,并对其进行生物信息学分析,为该种蛋白的结构功能提供理论基础。
1 材料与方法
1.1 主要试剂
限制性内切酶HindⅢ、BamHⅠ、XhoⅠ,2×TaqMaster Mix,30% Acrylamide,Tris-HCl,SDS,超纯RNA提取试剂盒、反转录试剂盒、琼脂糖凝胶DNA回收试剂盒、质粒提取试剂盒等。
1.2 生物信息学分析
通过SignalP 4.1 Server在线软件预测蛋白信号肽,通过TMHMM Server v.2.0 在线软件分别预测蛋白的跨膜结构,通过NetNGIyc 1.0 Server在线软件对蛋白进行糖基化修饰位点进行预测,通过SOPMA在线软件预测蛋白的二级结构,通过phyre2在线软件分别预测蛋白三级结构,通过IEDB在线软件预测分析蛋白质线性B细胞抗原表位,通过STRING在线软件预测不同蛋白之间的相互作用
1.3 目的基因的获取
登陆NCBI数据库分别查找BoPAG7(登录号:BC133469.1)和BoPAG8(登录号:NM_176619.3)的DNA序列,通过引物设计软件Primer5.0进行引物设计,引物前面两个斜体的核苷酸为保护性碱基、下划线部分为引物的酶切位点,引物序列详见表1。通过超纯RNA提取试剂盒提取胎盘组织RNA,并通过反转录试剂盒反转录成cDNA为模版,PCR扩增BoPAG7和BoPAG8基因,PCR反应体系为:12.5 μL Taq Master Mix(2×),上下游引物(10 μmol/L)各0.4/μL,cDNA 2/μL,加ddH20至25/μL。反应条件为:95 ℃ 预变性5 min,94 ℃ 变性40 s,退火30 s,72 ℃延伸75 s,30个循环,72 ℃延伸10 min,PCR扩增的目的基因与pMDTM19-T克隆载体连接,转化至大肠杆菌DH5α中,通过菌液PCR验证,验证结果正确后测序。
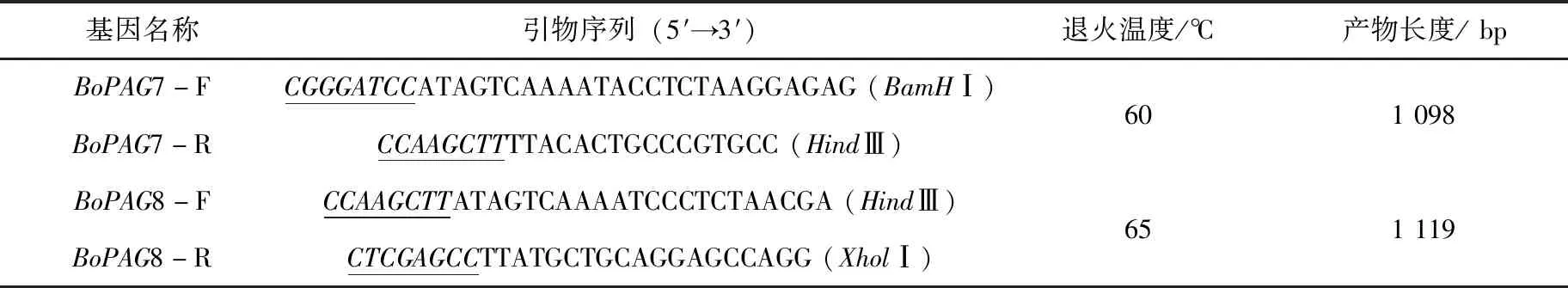
表1 目的基因扩增所需引物
1.4 表达载体和表达菌株的构建
将测序准确的目的基因与表达载体分别用pET-28a和pET-30a双酶切后链接,将链接产物转化至DH5α大肠杆菌中,通过菌液PCR验证后通过双酶切验证,双酶切反应体系为:质粒10 μL,10×QuickCut Buffer 2 μL,上下游酶如表1所示,各1 μL,加ddH2O至20 μL,将鉴定成功后的BoPAG7-30a和BoPAG8-28a重组质粒转入大肠杆菌感受态细胞BL21(DE3)内,再次经过菌液PCR验证成功后,进行蛋白的原核表达及纯化。
1.5 目的蛋白的诱导表达
取BoPAG7-30a和BoPAG8-28a表达菌株接种至LB 液体培养基中,置于摇床(37 ℃、230 r/min)震荡培养至对数生长期(OD600约为0.4~0.6),加入异丙基硫代乳苷(IPTG)诱导表达,分别取TPTG诱导0、2、4、6、8 h后的菌液各1 mL,8 000 r/min离心5 min收集菌体,加入80 μL去离子水重悬菌体和20 μL蛋白上样缓冲液(5×SDS-PAGE Loding Buffer),震荡混匀后金属浴100 ℃作用10 min,经12% 十二烷基磺酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)后对凝胶进行考马斯亮蓝染液染色、脱色并观察结果。
1.6 Western Blot检测
通过半干式转膜仪转将SDS-PAGE凝胶上的蛋白样品用转移至NC膜上,使用脱脂奶粉封闭NC膜。洗涤缓冲液(tris buffered saline tween,TBST)洗涤3次,加入Anti His-Tag Mouse Monoclonal Antibody作为一抗,37 ℃ 作用1 h。使用TBST洗涤3次。加入二抗山羊抗鼠IgG-HRP,37 ℃ 作用1 h;TBST洗涤缓冲液洗涤3次。加显色液显色。
2 结果
2.1 BoPAG7和BoPAG8蛋白的生物信息学分析
通过SignalP 4.1 Server预测蛋白信号肽如图1所示,BoPAG7和BoPAG8 N端前15个氨基酸序列为信号肽,通过TMHMM Server v.2.0在线软件,分别预测并分析蛋白的跨膜结构。结果显示,2个蛋白都无跨膜结构域(图2)。故该2种蛋白都为可分泌型蛋白。
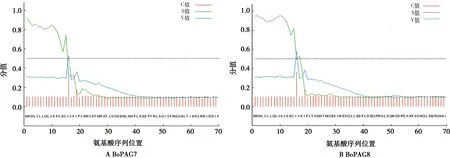
图1 蛋白信号肽预测
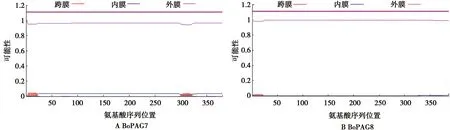
图2 蛋白跨膜区预测
通过NetNGIyc 1.0 Server在线软件对蛋白进行糖基化修饰位点进行预测,2个蛋白均发生糖基化修饰,其中BoPAG7在Asp57、Asp74、Asp103、Asp125、Asp1825个位点发生N连接糖基化修饰,BoPAG8在Asp218位点处发生N连接糖基化修饰,结果如图3所示。
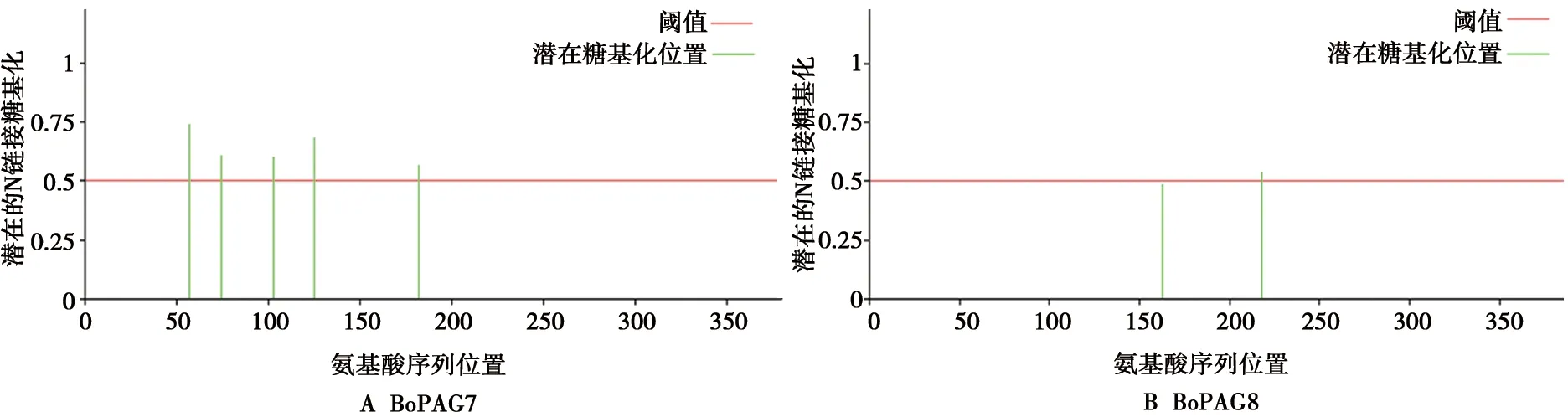
图3 蛋白糖基化预测
通过SOPMA在线软件预测蛋白的二级结构,结果如图4所示。所有蛋白主要以α-螺旋、无规则卷曲和延伸链组成,所占比例如表2所示。通过phyre2在线软件分别预测2个蛋白的三级结构,为蛋白的可视化分析提供理论基础。
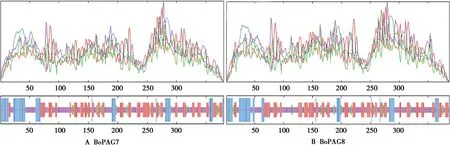
图4 蛋白二级结构预测

表2 蛋白二级结构所占比例
使用IEDB在线软件预测分析蛋白质线性B细胞抗原表位,结果如图6。分析结果显示,BoPAG7和BoPAG8蛋白具有丰富的抗原表位,抗原表位序列见表3和表4所示。
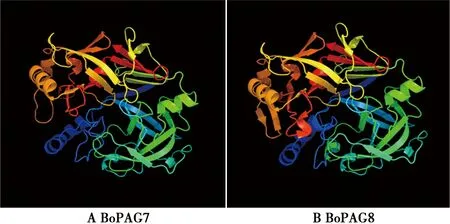
图5 蛋白三级结构预测

图6 2种蛋白B细胞抗原表位预测

表3 BoPAG7线性B细胞抗原表位多肽

表4 BoPAG8线性B细胞抗原表位多肽
通过STRING在线软件预测BoPAG7和BoPAG8蛋白的相互作用,结果如图7和表5所示。与BoPAG7互作的蛋白包括THSD4、PRP1、PRSS37和CAPZA3,与BoPAG8互作的蛋白为PRP3和BCL7A。

表5 BoPAG7和BoPAG8蛋白相互作用的功能蛋白、途径和蛋白结构域
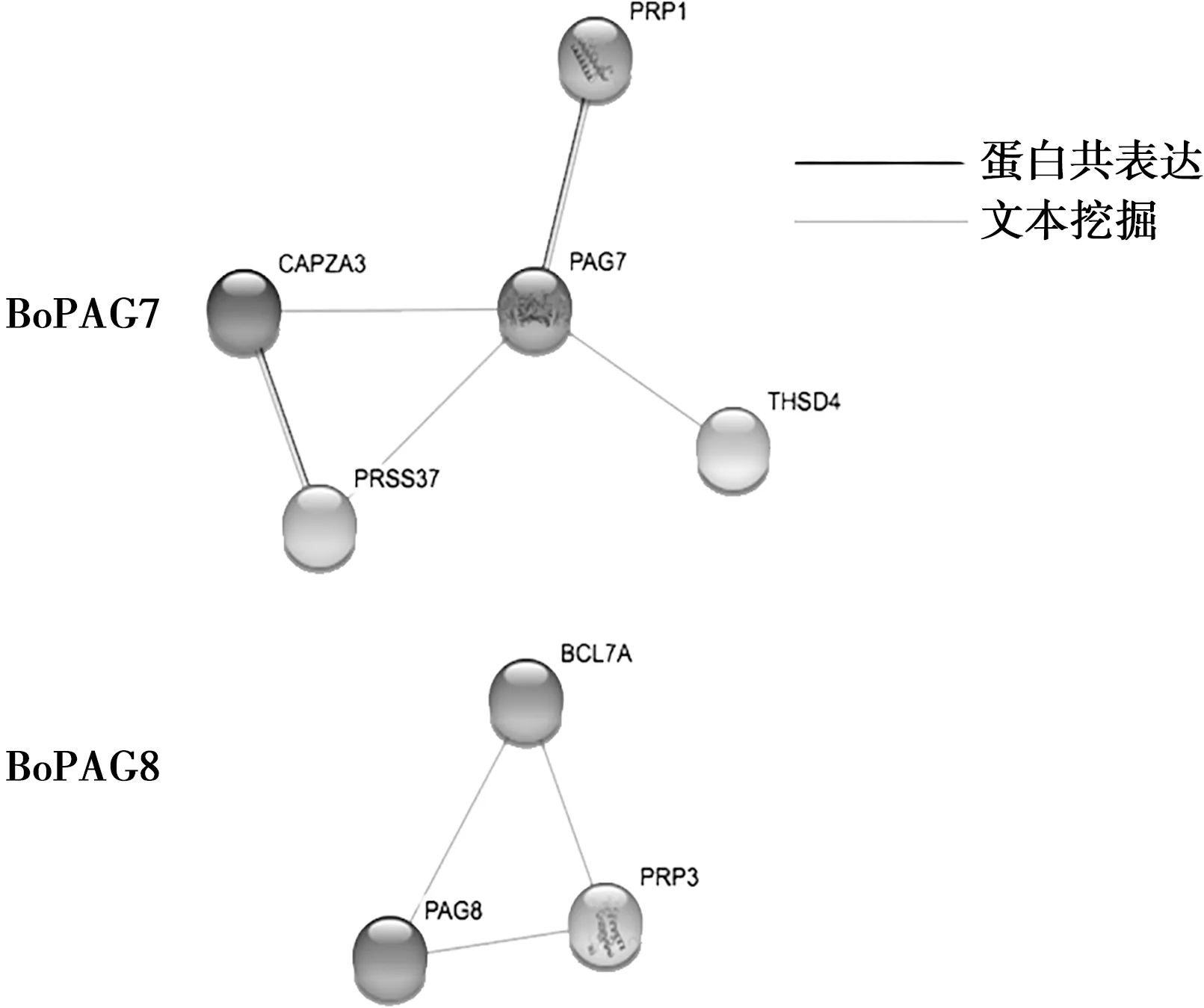
图7 BoPAG7和BoPAG8的蛋白质相互作用
2.2 目的基因的克隆
PCR扩增BoPAG7和BoPAG8基因,大小分别为1 098 bp和1 119 bp(图8),经PCR和双酶切鉴定的阳性菌送公司测序。结果表明,扩增出的BoPAG7和BoPAG8基因与GenBank上发表的碱基序列同源性一致。

M. DNA Marker; A 1~4. BoPAG7基因;B 1~4. BoPAG8基因图8 基因PCR扩增
2.3 表达载体双酶切验证
将表达载体BoPAG7-30a和BoPAG8-28a通过双酶切,结果如图9所示,酶切下的基因片段大小与理论值大小相符,表明已成功构建原核表达载体。

M. DNA Marker; A 1. 阴性对照;2、3. BoPAG7-30a双酶切;B 1. 阴性对照;B 2、3. BoPAG8-28a双酶切图9 表达载体双酶切验证
2.4 蛋白的诱导表达与纯化
将成功构建的表达载体转入到表达菌株DE3(BL21)感受态细胞中,经IPTG诱导0、2、4、6、8 h后,将表达菌液经12%的SDS-PAGE分析,分别得到大小约为45 kD的BoPAG7蛋白和约46 kD的BoPAG8蛋白,与预期蛋白分子量大小一致。并通过镍柱亲和层析法纯化得到较纯的目的蛋白,结果如图10所示。
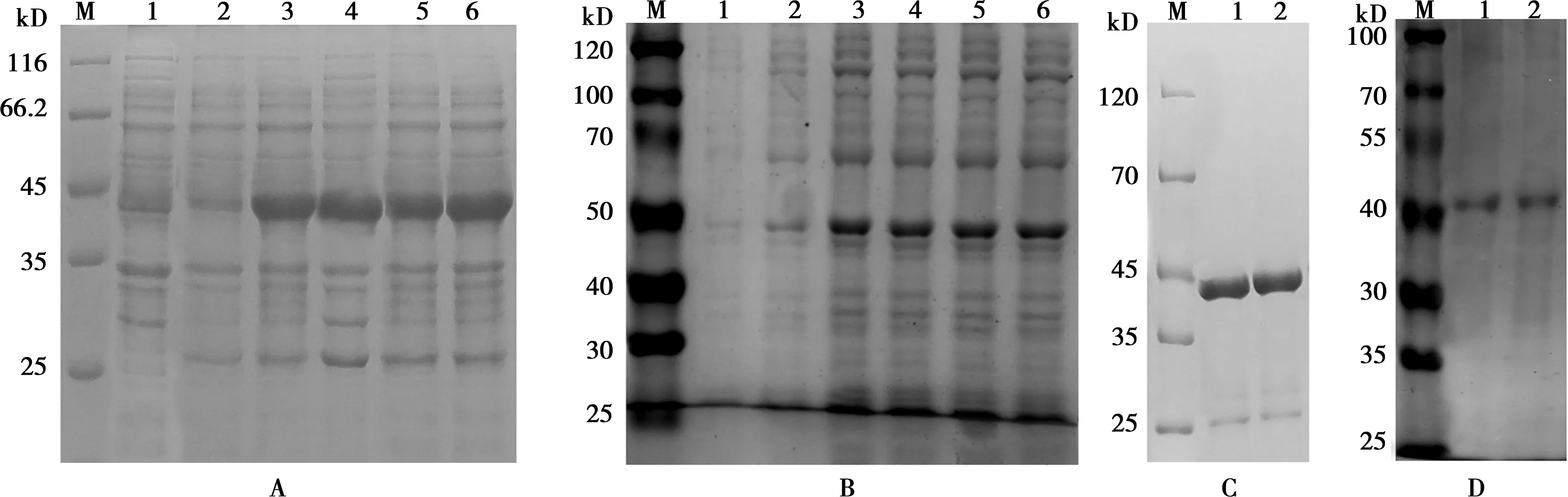
M.蛋白Marker;A 1. BoPAG7-30a; B 1.BoPAG8-28a DE3空载体;A、B 2~6. 0、2、4、6、8 h诱导菌体;C 1、2. BoPAG7-30a;D 1、2.BoPAG8-28a蛋白纯化图10 蛋白诱导表达与纯化
2.5 纯化蛋白的验证
通过 Western blot 分析,对纯化蛋白进行验证。结果显示,BoPAG7蛋白在约45 kD处、BoPAG8蛋白在约46 kD处均有明显的条带,与理论分析值相符(图11)。
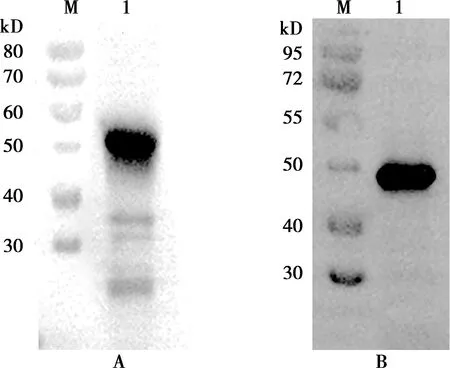
M.蛋白Marker;A.BoPAG7蛋白、B.BoPAG8蛋白图11 蛋白纯化后Western blot分析
3 讨论
PAGs又称为妊娠特异性蛋白B(PSPB),是一个大家族的糖蛋白,在反刍动物胎盘上皮细胞层(绒毛膜/滋养外胚层)特异表达[17]。PAG蛋白的确切功能可能主要体现在胎盘发生、胚胎保护、母体排斥反应、母体识别和妊娠维持等方面[18]。本研究预测分析了BoPAG7和BoPAG8蛋白二级结构和蛋白三级结构,2个蛋白主要以无规卷曲和延伸链为主,对BoPAG7和BoPAG8蛋白进行蛋白互作分析,结果显示,与BoPAG7互作的蛋白有4个,与BoPAG8互作的蛋白有2个,其中BoPAG7和BoPAG8与催乳素相关蛋白(PRPs)有互作作用,催乳素相关蛋白是牛的非经典催乳素(PRL)生长激素家族的成员,但是,其功能仍然未知[19]。PRP蛋白在妊娠20 d后可在胎盘滋养层双核细胞中检测到,据报道bPRP1可能是滋养细胞分化的优良标志物,也是妊娠诊断的候选者[20]。预测到BoPAG8可与BCL7A相互作用,BCL7A缺乏会改变了小脑浦肯野树突细胞的高度分枝,并损害了运动技能,然而BCL7A的普遍缺失会导致围产期致死[21]。丝氨酸蛋白酶在消化、凝血、凋亡和免疫系统中发挥着重要的作用,其中,PRSS37是在塑形期精子中出现而在成熟精子中消失的一种功能未知的丝氨酸蛋白酶[22]。但BoPAG7和BoPAG8的具体的生物学功能仍需深入研究。滋养层双核细胞(BNCS)在胞质颗粒中储存多种糖蛋白,并具有特定的糖基化模式[17]。糖基化确实在PAGs的抗原性中起作用,并且在怀孕期间也可能起作用[23]。本研究成功预测到BoPAG7有5个位点发生N连接糖基化修饰,分别是Asp57、Asp74、Asp103、Asp125和Asp182,BoPAG8在Asp218位点处发生N连接糖基化修饰。信号肽预测分析显示,BoPAG7和BoPAG8 N端前15个氨基酸序列为信号肽,且无跨膜结构,表明这该蛋白为可分泌型蛋白。对BoPAG7和BoPAG8蛋白进行B细胞抗原表位预测分析,结果显示,BoPAG2含有多个线性表位,这表明其作为抗原能引起良好的免疫应答。
综上,本研究通过生物信息学预测分析,预测到BoPAG7和BoPAG8蛋白分别有5个和1个N链接糖基化,同时对其蛋白的结构和B细胞抗原表位进行预测分析,并且对不同蛋白间互作进行预测分析。通过原核表达并纯化获得了BoPAG7和BoPAG8蛋白,为BoPAG7和BoPAG8蛋白抗体的制备和功能的研究提供了基础。

