猪圆环病毒3型ORF2基因的截短表达及间接ELISA抗体检测方法的建立
何博,王勤,欧云文
(1. 达州职业技术学院,四川 达州 635001;2. 开江县动物疫病预防控制中心,四川 达州 636250;3. 中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,甘肃 兰州 730046)
猪圆环病毒(porcine circovirus,PCV)属于圆环病毒科(Circoviridae)圆环病毒属(Circovirus)。目前已知的PCV分为3种基因型,即PCV1、PCV2和PCV3。PCV1致病性弱,一般不引起细胞病变;PCV2在猪群中普遍存在,致病性较强;PCV3是一种新发现的猪圆环病毒,2016年在美国首次发现[1]。近年来我国的山东、湖北、广西等多个省市猪群中也陆续检测出PCV3[2-4]。研究表明,感染PCV3可能引起猪皮炎肾病综合征、母猪繁殖障碍、多系统炎症、仔猪先天性震颤等多种疫病,是当前威胁养猪业健康发展的一个潜在致病原[5-6]。PCV3基因组结构与PCV2相似,为单链环状DNA病毒,基因组全长约为2 000 bp,主要有3个开放阅读框(ORF1、ORF2和ORF3),其中ORF1基因编码含有296个氨基酸的复制酶(Rep蛋白),ORF2基因编码含有214个氨基酸的衣壳蛋白(Cap蛋白),ORF3基因编码含有230个氨基酸的蛋白(目前该蛋白功能未知)[7-8]。ORF2基因编码的Cap蛋白是PCV-3的唯一结构蛋白,存在病毒主要抗原决定簇,可诱导机体产生中和抗体,且PCV3与PCV1和PCV2ORF2基因不具有共同的线性抗原表位[9-10]。以ORF2基因编码的Cap蛋白作为诊断抗原可实现PCV3与PCV1、PCV2特异性抗体的鉴别检测。鉴于此,本研究进行了PCV3ORF2基因的截短表达,并以重组蛋白为包被抗原,建立了检测PCV3抗体的间接ELISA方法。同时将其初步应用于四川地区猪场的临床样品检测,旨在掌握PCV3在四川地区的阳性感染率,为PCV3的临床鉴别诊断和血清学监测提供了一种敏感性强、特异性高、适合大规模样品检测的方法。
1 材料与方法
1.1 病毒与抗体
PCV3阳性病料、PCV2、猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪细小病毒(PPV)、猪伪狂犬病毒(PRV)、乙型脑炎病毒(JEV)、猪流行性腹泻病毒(PEDV)和猪传染性胃肠炎病毒(TGEV)等病毒阳性血清均由本校动物传染病实验室保存。PCV3阳性血清采集于临床感染PCV3的发病猪血清,PCV3阴性血清采集于临床未感染致病原、未吃初乳的新生仔猪血清。
1.2 试剂与试剂盒
原核表达载体pET-32a(+)、Premix Taq酶、BamHⅠ和HindⅢ内切酶、T4 DNA连接酶、大肠杆菌DH5α和BL21(DE3)感受态细胞、核酸提取试剂盒、胶回收试剂盒、质粒提取试剂盒均购自宝生物工程(大连)有限公司;HRP标记兔抗猪IgG购自美国Solarbio公司;DAB与TMB底物显色液均购自天根生化科技(北京)有限公司;Ni-NTA蛋白纯化试剂盒购自南京金斯瑞公司。
1.3 引物设计
参照GenBank中PCV3基因组序列(GenBank登陆号为MF069115)设计1对扩增引物,片段大小为348 bp并包含ORF2基因主要抗原表位,上游引物F:5′-ATAGGATCCTTCCGCATAAGG-3′;下游引物R:5′-ATTCAAGCTTCCAAGGAGACGACGAC-3′,引物序列中阴影部分分别为BamHⅠ和HindⅢ酶切位点序列。
1.4 ORF2基因PCR扩增
利用核酸提取试剂盒提取PCV3阳性病料的核酸DNA,利用合成的引物进行ORF2基因主要抗原区域的PCR扩增。PCR扩增反应体系为:2×Premix Taq 25 μL、核酸DNA 5 μL、上游引物F 0.5 μL、下游引物R 0.5 μL、水18 μL。PCR扩增反应程序为:95 ℃ 3 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min。
1.5 pET-32a-ORF2载体的构建与鉴定
利用BamHⅠ和HindⅢ,分别对ORF2基因PCR扩增产物与原核表达载体pET-32a进行双酶切。酶切产物经胶回收试剂盒回收纯化后,利用T4 DNA连接酶于4 ℃过夜连接,次日转化DH5α感受态细胞。质粒提取试剂盒提取重组质粒,经BamHⅠ和HindⅢ双酶切鉴定正确后命名为pET-32a-ORF2,并送生工生物工程(上海)股份有限公司进行测序分析,验证阅读框架是否正确。
1.6 重组蛋白的表达与纯化
将测序分析正确的重组质粒pET-32a-ORF2转入BL21(DE3)感受态细胞,利用IPTG进行诱导表达。将表达菌体利用超声波裂解,离心裂解产物,12 000 r/min离心10 min。分别采集离心后的上清和沉淀进行SDS-PAGE,鉴定重组蛋白的表达形式。对以包涵体形式表达的重组蛋白,利用Ni-NTA蛋白纯化试剂盒对重组蛋白进行纯化,纯化蛋白经SDS-PAGE检测纯化效果。
1.7 重组蛋白的Western blot鉴定
重组蛋白和pET-32a空载体蛋白经SDS-PAGE后转印至硝酸纤维素膜,将硝酸纤维素膜用5%脱脂奶粉封闭2 h。洗涤后加入40倍稀释的PCV3阳性血清,37 ℃感作45 min,洗涤后加入3 000倍稀释的HRP标记兔抗猪IgG,37 ℃感作30 min,洗涤后加入DAB显色液感作5 min。
1.8 间接ELISA检测方法的建立
1.8.1 间接ELISA操作方法
将重组蛋白适当稀释后,4 ℃过夜包被ELISA反应板,洗涤后加入适当稀释的血清样品(一抗),37 ℃感作适当时间,洗涤后加入适当稀释的HRP标记兔抗猪IgG(二抗),37 ℃感作适当时间,洗涤后加入TMB底物显色液,37 ℃感作适当时间,2 mol/L H2SO4终止反应,在波长450 nm处测定OD值。
1.8.2 间接ELISA最佳反应条件的确定
抗原最佳包被量和一抗最佳稀释度的确定:将重组蛋白稀释至终浓度分别为0.5、1.0、2.0、4.0、8.0、10 μg/mL,将一抗分别进行1∶20、1∶40、1∶80、1∶160、1∶320倍稀释,采用方阵滴定法确定抗原的最佳包被量和一抗最佳稀释度。
最佳封闭液和最佳封闭时间的确定:分别选择5%脱脂奶粉、10%脱脂奶粉、1% BSA、3% BSA作为封闭液,封闭液作用时间分别为30、60、90 min,采用方阵滴定法确定最佳封闭液和最佳封闭时间。
二抗最佳稀释度和最佳作用时间的确定:将HRP标记兔抗猪IgG分别进行1∶3 000、1∶4 000、1∶5 000倍稀释,HRP标记兔抗猪IgG作用时间分别为30、60、90 min,采用方阵滴定法确定二抗最佳稀释度和最佳作用时间。
一抗最佳作用时间的确定:在相同试验条件下,将一抗分别作用30、60、90 min,根据阳性血清和阴性血清比值(P/N值),确定一抗最佳作用时间。
底物最佳作用时间的确定:在相同试验条件下,将TMB底物分别作用5、10、15 min,根据阳性血清和阴性血清比值(P/N值),确定底物最佳作用时间。
1.8.3 间接ELISA临界值的确定

1.9 间接ELISA敏感性试验
将PCV3阳性血清分别进行1∶20、1∶40、1∶80、1∶160、1∶320、1∶640、1∶1 280、1∶2 560、1∶5 120、1∶10 240、1∶20 480、1∶40 960倍系列稀释,以各稀释度作为一抗进行ELISA检测,确定对PCV3阳性血清的最低检出效价。
1.10 间接ELISA特异性试验
分别选取已知的PCV3阳性血清和阴性血清、PCV2、PRRSV、CSFV、PPV、PRV、JEV、PEDV和TGEV等病毒阳性血清,利用间接ELISA方法依次进行检测,确定方法的特异性。
1.11 间接ELISA重复性试验
批内重复性试验:用同一批次制备的纯化蛋白包被ELISA板,分别在4个不同时间点对6份PCV3抗体水平不同的血清样品进行检测,统计检测结果并计算变异系数,确定间接ELISA方法的批内重复性。
批间重复性试验:用不同批次制备的4批纯化抗原分别包被ELISA反应板,并分别在4个不同时间点对6份PCV3抗体水平不同的血清样品进行检测,统计检测结果并计算变异系数,确定间接ELISA方法的批间重复性。。
1.12 间接ELISA临床样品检测试验
2018年至2019年,在四川地区的32个猪场采集了533份不同饲养阶段和用途的临床猪血清样品。应用间接ELISA方法进行检测,评估当前四川地区的PCV3感染情况,确定间接ELISA方法的临床适用性。
2 结果与分析
2.1 ORF2基因PCR扩增结果
如图1所示,利用合成的针对ORF2基因引物,可以对PCV3阳性病料核酸DNA扩增出1条特异性条带,大小为348 bp,与试验预期的扩增片段大小相符。

M. DL 2000 DNA Marker;1. PCV3阳性病料;2. 水对照图1 PCR扩增结果
2.2 pET-32a-ORF2载体的构建与鉴定结果
如图2所示,pET-32a-ORF2重组质粒通过BamHⅠ和HindⅢ双酶切后,可分别获得2条特异性条带,大小约为5 900 bp和348 bp。对该重组质粒的测序结果表明,其阅读框架完全正确。

M. DL 15000 DNA Marker;1. 重组质粒的BamHⅠ/HindⅢ双酶切产物图2 重组质粒双酶切鉴定结果
2.3 重组蛋白的表达与纯化
如图3所示,重组质粒pET-32a-ORF2转入BL21(DE3)感受态细胞后,利用IPTG诱导获得了以非可溶蛋白形式大量表达的重组蛋白,并经Ni-NTA蛋白纯化试剂盒纯化后获得了高纯度的纯化蛋白。
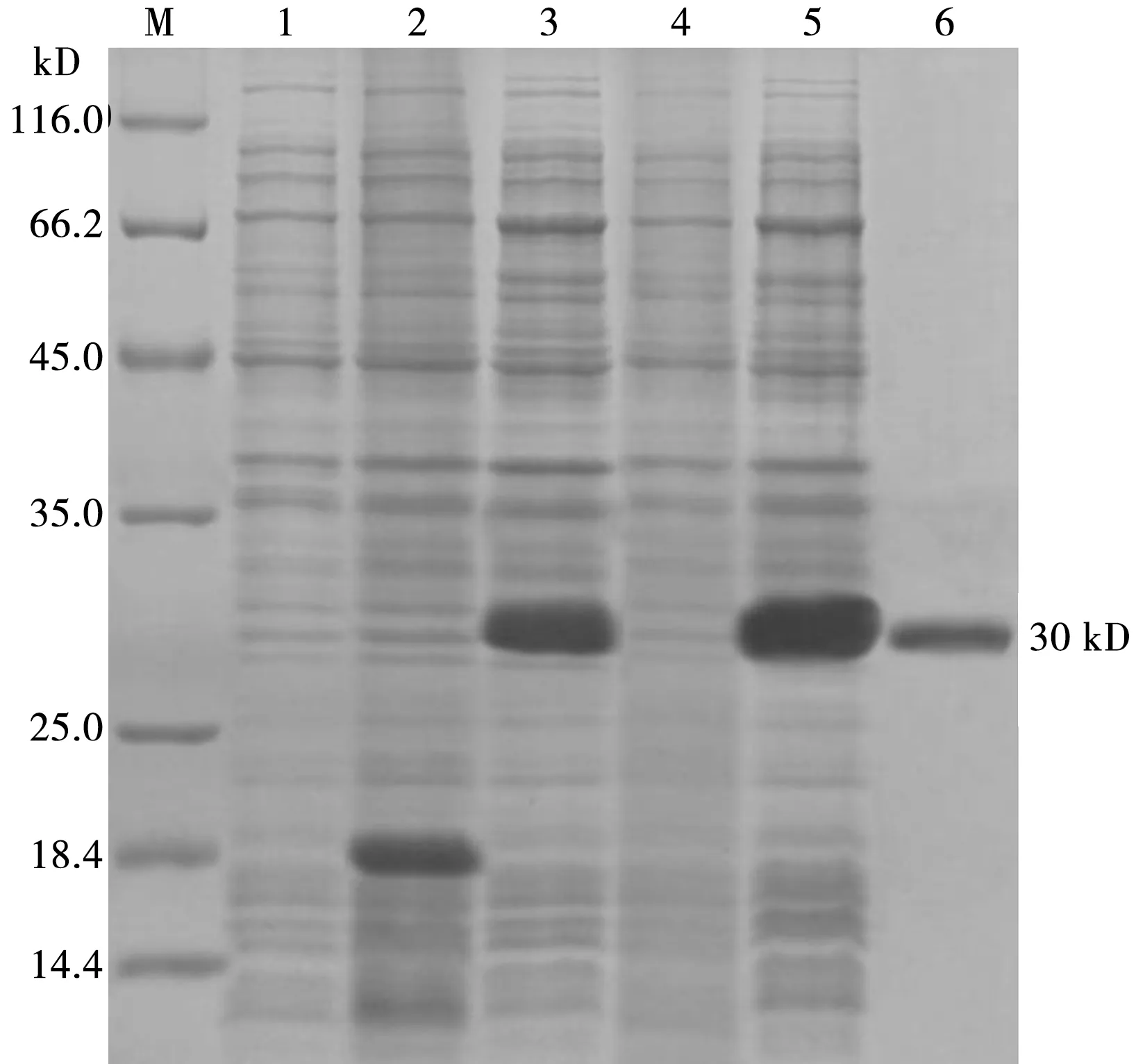
M. 蛋白Marker;1. pET-32a-ORF2未诱导菌;2. pET-32a载体诱导菌;3. pET-32a-ORF2诱导菌;4. 上清;5. 沉淀;6. 纯化后蛋白图3 重组蛋白表达与纯化的SDS-PAGE
2.4 重组蛋白的Western blot鉴定
如图4所示,重组蛋白可与PCV3阳性血清发生特异性结合反应,说明重组蛋白具有良好的反应原性。

M. 预染蛋白Marker;1. 纯化蛋白与PCV3阳性血清反应;2. pET-32a载体诱导菌与PCV3阳性血清反应图4 Western blot鉴定结果
2.5 间接ELISA最佳反应条件的确定
2.5.1 抗原最佳包被量和一抗最佳稀释度的确定
当抗原包被量为0.8 μg/mL,一抗稀释度为1∶40时,P/N值最大,且阳性血清OD450值接近1.0。经方阵滴定法确定抗原的最佳包被量为0.8 μg/mL,一抗最佳稀释度为1∶40。
2.5.2 最佳封闭液和最佳封闭时间的确定
当封闭液为1% BSA和封闭时间为60 min时,P/N值最大,且阳性血清OD450值接近1.0。经方阵滴定法确定最佳封闭液为1% BSA,最佳封闭时间为60 min。
2.5.3 二抗最佳稀释度和最佳作用时间的确定
当HRP标记兔抗猪IgG稀释倍数为1∶4 000,作用时间为30 min时,P/N值最大,且阳性血清OD450值接近1.0。经方阵滴定法确定二抗最佳稀释度为1∶4 000,二抗最佳作用时间为30 min。
2.5.4 一抗最佳作用时间的确定
在相同试验条件下,当一抗作用60 min时,P/N值最大,且阳性血清OD450值接近1.0,故确定一抗最佳作用时间为60 min。
2.5.5 底物最佳作用时间的确定
在相同试验条件下,当TMB底物作用10 min,P/N值最大,且阳性血清OD450值接近1.0,故确定底物最佳作用时间为10 min。
2.6 间接ELISA临界值的确定
2.7 间接ELISA敏感性试验
如表1所示,当PCV3阳性血清进行1∶20 480倍稀释时,间接ELISA检测其OD450值为0.356,呈阳性反应。间接ELISA对PCV3阳性血清的最低检出效价可达1∶20 480。

表1 间接ELISA敏感性试验结果
2.8 间接ELISA特异性试验
如表2所示,间接ELISA检测PCV3阳性血清为阳性,而检测PCV2、PRRSV、CSFV、PPV、PRV、JEV、PEDV和TGEV等病原的阳性血清均为阴性。可见,间接ELISA方法具有很好的特异性。

表2 间接ELISA特异性试验结果
2.9 间接ELISA重复性试验
2.9.1 批内重复性试验
6份血清样品经过同一批次纯化蛋白,在4个不同时间点检测,变异系数最低为2.52%,最高为3.75%,见表3。试验结果说明,间接ELISA方法具有良好的批内重复性。
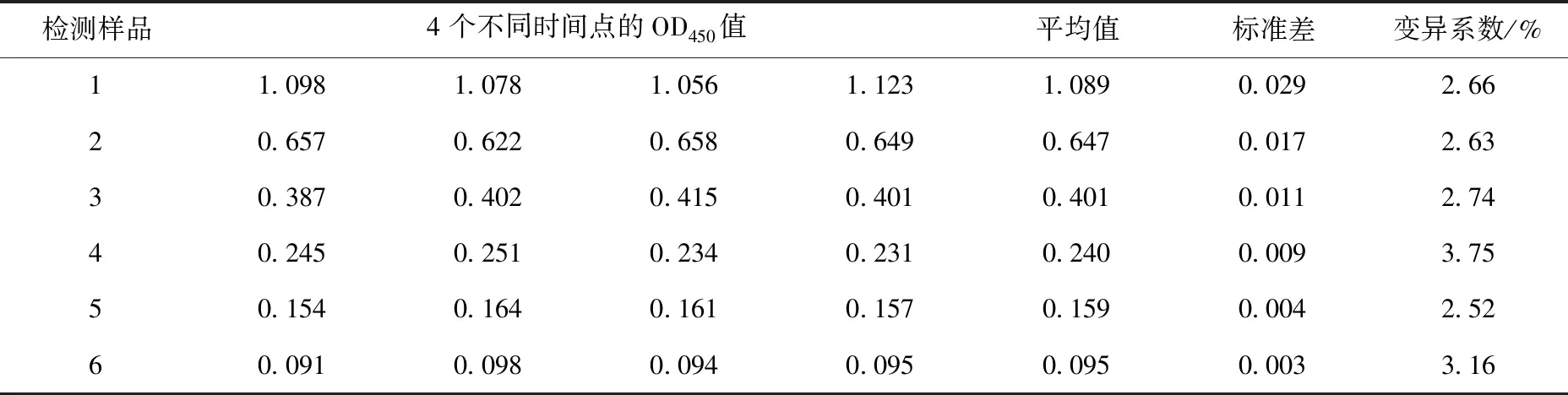
表3 批内重复性试验结果
2.9.2 批间重复性试验
6份血清样品经过4批次纯化蛋白,在4个不同时间点进行检测,变异系数最低为3.52%,最高为4.18%,见表4。试验结果说明,间接ELISA方法具有良好的批间重复性。
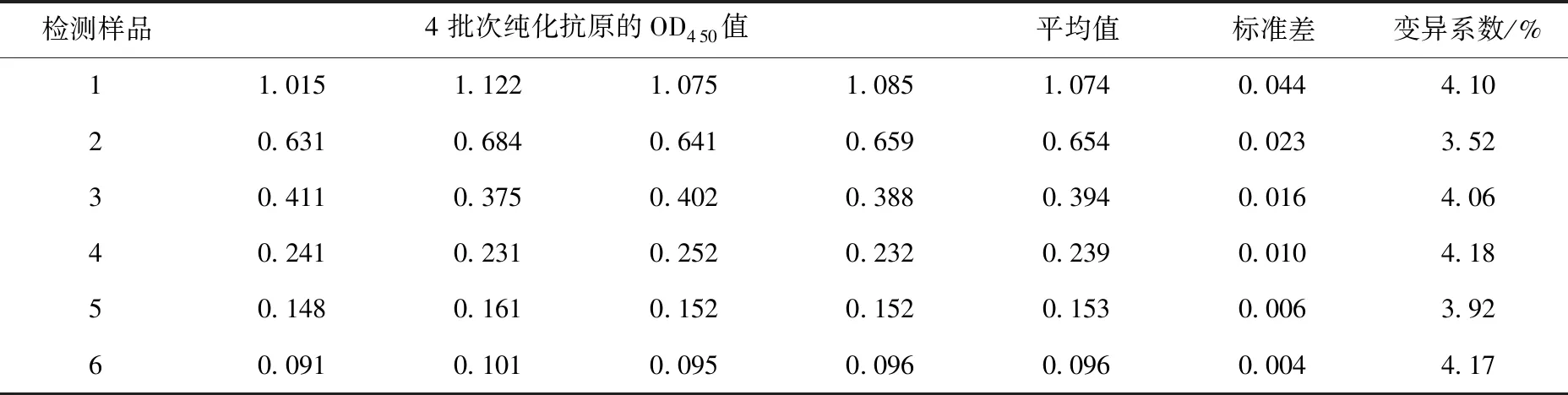
表4 批间重复性试验结果
2.10 间接ELISA临床样品检测试验结果
应用间接ELISA方法对533份临床猪血清样品进行PCV3抗体检测,共检测出PCV3抗体阳性的样品79份,PCV3阳性感染率达14.82%,其中种猪、仔猪、育肥猪的阳性感染率分别为29.22%、8.11%、9.79%,见表5。表明当前四川地区存在一定程度的PCV3感染,尤其是种猪中PCV3的感染情况较严重。

表5 临床检测结果
3 讨论
目前针对PCV3的研究处于起步阶段,尚无病毒成功分离报道,加强对PCV3感染的诊断和流行病学监测对其综合防控至关重要。由于PCV3与PCV2引起的临床症状极其相似,故对于PCV3的诊断应依靠实验室鉴别诊断方法。当前,对于PCV3的实验室鉴别诊断方法主要有分子生物学诊断方法和血清学诊断方法,其中PCR[11]、套式PCR[12]、荧光定量PCR[13]、环介导等温扩增技术(LAMP)等分子生物学方法能够检测到PCV3特定的核苷酸序列,具有敏感性高、特异性强、准确性好等特点,在猪场进行PCV3和PCV2感染的临床鉴别诊断中得到了广泛应用,并取得了良好的应用效果[14]。但分子生物学方法检测成本高,检测一次的数量有限,仅适合发病猪场的实验室确诊,不适合大批量样品或大面积范围的流行病学监测。而ELISA等血清学诊断方法操作简单、检测周期短、检测成本低、通量高,特别适合大批量样品或大面积范围的血清学监测。由于PCV3的全病毒抗原制备过程繁琐,且存在非常高的生物安全危险性,故利用基因工程技术体外制备人工抗原成为研究的热点,为新型血清学诊断试剂的研发提供了方向。在体外制备人工抗原中,表达系统的合理选择至关重要,由于原核表达系统具有成本低、试验周期短、表达量大、重组蛋白易于纯化等优势,其一直是异源蛋白体外表达的首选系统。本研究选择大肠杆菌原核表达系统,对PCV3中OPR2基因编码的Cap蛋白,也是PCV3的唯一衣壳蛋白进行了体外表达,后续试验结果证实,截短表达的Cap蛋白表达量较大,易于纯化,且具有良好的反应活性,以其作为包被抗原建立的间接ELISA检测方法,对PCV3阳性血清的最低检出效价可达1∶20 480,检测PCV2、PRRSV、CSFV、PPV、PRV、JEV、PEDV、TGEV等8种猪病病毒阳性血清均为阴性,批内和批间重复性试验的变异系数均小于5%,显示出了良好的敏感性、特异性和重复性。
鉴于过去PCV2对我国养猪业造成的巨大危害,PCV3一开始流行就引起了我国研究者的高度重视。为确定PCV3在我国不同地区的感染情况,近年来研究人员陆续对国内不同地区PCV3感染情况进行了流行病学监测。何长生等[15]采用荧光定量PCR方法对采集于安徽省3个地区12个猪场的239份样品进行了PCV3检测,PCV3阳性感染率为14.6%;赵宇等[16]采用PCR方法对河南不同地区猪场的152份临床样品进行PCV3检测,PCV3阳性感染率为30.26%;刘相聪等[17]利用PCR技术对广东、广西、海南、福建、江西、湖南177家规模化猪场的1 078份样品进行检测PCV3阳性感染率为29.04%。本研究利用间接ELISA方法,对2018至2019年四川地区32个猪场采集的533份临床猪血清样品进行PCV3抗体检测,共检测出PCV3抗体阳性样品79份,PCV3阳性感染率达14.82%,显著低于赵宇等[16]、刘相聪等[17]的检测结果,与何长生等[15]的检测结果基本相同,表明当前四川地区存在一定的PCV3感染,但相对于国内其他地区仍然较低,这与四川省多年来一直重视加强生物安全防控措施密不可分。鉴于PCV3的流行态势,进一步加强对PCV3感染的综合防控仍刻不容缓。何长生等[15]研究表明,保育猪、育肥猪、后备母猪、能繁母猪、种公猪PCV3阳性感染率分别为0%、2.9%、44.4%、51.9%和25.0%。本研究中发现种猪、仔猪、育肥猪的阳性感染率分别为29.22%、8.11%、9.79%,该结果与何长生等[15]的调查结果基本一致。上述研究结果说明,不同猪群均存在PCV3感染,以种猪最易感,该情况需引起足够重视,对于PCV3的防控应重点加强对种猪的控制。
综上,本研究利用大肠杆菌原核表达系统截短表达的OPR2基因主要抗原区域,具有良好的反应活性,以其作为包被抗原建立的间接ELISA检测方法具有良好的敏感性、特异性、重复性和临床适用性,显示出了良好的临床应用前景。

