高糖诱导的视网膜新生血管形成中NLRP3炎症小体与自噬的关系研究△
姚国敏 李蓉 闫红林 王莉 蔡天志 周凌霄 邓颖
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病常见的微血管并发症之一,是工作年龄人群致盲的首位病因。临床上,DR分为早期即非增生型DR(non-proliferative diabetic retinopathy,NPDR)和晚期即增生型DR(proliferative diabetic retinopathy,PDR)。早期视网膜血管通透性增加和毛细血管阻塞,导致视网膜微动脉瘤、出血和硬性渗出,晚期主要病变是视网膜新生血管形成,导致玻璃体积血或牵拉性视网膜脱离,严重影响患者视力[1]。DR的发生机制十分复杂,在视网膜微血管损害的病理过程中,高血糖发挥了关键作用,随着研究的深入,其他因素在DR中的作用也不可忽视。
炎症小体是由细胞内的模式识别受体、适配器蛋白质和半胱天冬酶(Caspase)组成的大型细胞质蛋白复合物,导致前炎性细胞因子IL-1β和IL-18的释放。其中,核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体是最为典型的受体蛋白,它由 NLRP3、Caspase招募结构域的凋亡相关颗粒样蛋白(apoptosis-associated speck like protein,ASC)和Caspase-1组成[2]。近年来研究发现,NLRP3炎症小体与DR,尤其是PDR中视网膜新生血管的形成密切相关[3-4]。自噬是将细胞浆内蛋白和功能失调的细胞器转移到溶酶体进行降解的过程,被认为是一个发生在基础水平上的代谢过程,其功能主要是在蛋白质和细胞器更新过程中维持自身的稳态。大量研究证实,自噬在人类健康和多种疾病中起着极其重要的作用[5],自噬信号通路也参与了DR的病理生理过程[6]。
新近研究发现,NLRP3炎症小体与自噬在一些疾病中相互调控,共同参与疾病的发生发展,如在糖尿病动物模型中发现,激活自噬可以抑制NLRP3炎症小体表达,从而减轻其心肌缺血-再灌注损伤[7],而NLRP3炎症小体可负向调控糖尿病肾病的足细胞自噬[8]。然而,二者在不同疾病中的相互关系存在较大差异[9-10],且目前关于二者在DR中的关系研究仍较少。鉴于此,本研究利用高糖诱导的人视网膜微血管内皮细胞(human retinal microvascular endothelial cells,HRMEC)为疾病模型,观察NLRP3炎症小体与自噬在DR视网膜新生血管形成中的关系。
1 材料与方法
1.1 材料HRMEC(上海中乔新舟生物科技有限公司);M199培养基、胎牛血清及2.5 g·L-1胰蛋白酶(美国Gibco公司);青、链霉素(索莱宝公司);3-甲基腺嘌呤(3-methyladenine,3-MA)(S2767)、CY-09(S5774)(美国Selleck公司); MTT(美国Sigma公司);二甲基亚砜(DMSO)(美国Amresco公司);Transwell小室、Matrigel(美国BD公司);兔多抗NLRP3(相对分子质量为118 000,NBP2-12446,美国Novus公司);兔单抗ASC(相对分子质量为22 000,ab155970)、兔单抗pro Caspase-1 + p10 + p12(相对分子质量为35 000/45 000,ab179515)、兔单抗Beclin-1(相对分子质量为52 000,ab207612)(英国Abcam公司);兔多抗LC3-II/LC3-I(相对分子质量为14 000/16 000,AF5402,美国Affinity公司);辣根过氧化酶标记羊抗兔二抗(BA1054,武汉博士德生物工程有限公司);兔多抗GAPDH(AB-P-R 001,杭州贤至生物有限公司);Ad-mCherry-GFP-LC3B (碧云天公司,C3011-1mL)。CO2恒温培养箱(日本Sanyo公司,型号MCO-15AC);全自动酶标仪(美国Thermo scientific公司,型号Multiskan MK3);倒置显微镜(日本Olympus公司,型号IX51);激光共聚焦显微镜(日本Nikon公司,型号C2)。
1.2 方法
1.2.1 细胞分组及处理将冻存的HRMEC解冻后离心收集,用含体积分数10%胎牛血清、100 U·mL-1青霉素和100 mg·L-1链霉素的M199培养基悬浮细胞,接种至培养皿中,在37 ℃、含体积分数5%CO2孵箱中培养。2.5 g·L-1胰蛋白酶消化后收集细胞,用培养基制成单细胞悬液,传代培养。取生长状态良好的细胞制备单细胞悬液,计数后按照每孔500×103个接种于6孔板,贴壁后将细胞分为高糖组、3-MA+高糖组及CY-09+高糖组,其中高糖组在M199培养基中加入30 mmol·L-1葡萄糖溶液处理48 h;3-MA+高糖组细胞先用5 mmol·L-1的 3-MA 处理2 h,然后更换为含30 mmol·L-1葡萄糖溶液的培养基处理48 h;CY-09+高糖组细胞先用10 mmol·L-1的CY-09处理2 h,然后更换为含30 mmol·L-1葡萄糖溶液的培养基处理48 h。
1.2.2 MTT法检测细胞活力取生长状态良好的HRMEC制备单细胞悬液,调整细胞密度至50×103个·mL-1,将细胞悬液接种至96孔板,按1.2.1分组处理细胞,每组设置3个复孔,每孔100 μL,并设置空白孔,然后每孔加入10 μL MTT,37 ℃孵育4 h,弃去上清液,每孔加入150 μL DMSO,低速振荡10 min;酶标仪测定各孔在568 nm处的光密度(D)值。计算细胞活力:细胞活力(%)= (D实验组-D对照组)/(D对照组-D空白组)×100%。其中,空白组仅含有培养基而没有接种细胞,对照组为用M199培养基常规培养的HRMEC。
1.2.3 Transwell检测细胞的迁移能力取生长状态良好的细胞,按1.2.1分组处理后,2.5 g·L-1胰蛋白酶消化后收集细胞,离心,用无血清培养基重悬细胞,将细胞浓度调整至200×103个·mL-1。在24孔板中加入800 μL含体积分数10%胎牛血清、100 U·mL-1青霉素和100 mg·L-1链霉素的M199培养基,然后放入Transwell小室,每组设置3个复孔,在上室加入200 μL各组细胞悬液,继续培养48 h。PBS清洗小室,然后用体积分数70%冰乙醇溶液固定细胞1 h,5 g·L-1结晶紫染液染色20 min,清洗后擦去未穿膜的上室内细胞,封片后在显微镜下拍照,随机选择 3 个放大200倍视野拍照,计数平均迁移细胞数。
1.2.4 Matrigel检测细胞的管腔形成能力4 ℃条件下融化Matrigel,用预冷的移液器枪头按每孔200 μL加至预冷的24孔板,37 ℃孵育30 min。按1.2.1分组处理细胞后,以每孔200×103个·mL-1接种于铺好胶的24孔板内,37 ℃、体积分数5%CO2条件下培养,当管腔形成时(6~8 h,≥3个细胞/分支)立即在显微镜下拍照,随机选取3 个放大 100 倍的视野,用 Image J软件计数平均管腔形成数。
1.2.5 Western blot检测各种蛋白表达收集各组细胞,裂解后离心提取总蛋白,BCA法测定蛋白浓度。取40 μg总蛋白上样,在SDS-PAGE凝胶上电泳,转至PVDF膜,用含50 g·L-1脱脂奶粉的TBST溶液室温浸泡PVDF膜,摇床上封闭2 h。滴加相应一抗(NLRP3、ASC、Caspase-1、LC3及GAPDH稀释比例均为11000,Beclin-1稀释比例为12000),4 ℃孵育过夜。TBST溶液充分洗膜后加入辣根过氧化酶标记羊抗兔二抗(150 000),37 ℃孵育2 h,ECL显色,曝光后扫描胶片,BandScan软件分析胶片灰度值,以GAPDH为内参照,计算NLRP3、ASC、Caspase-1、LC3-II/LC3-I比值及Beclin-1蛋白相对表达量,每组重复测量3次,取平均值。
1.2.6 转染Ad-mCherry-GFP-LC3B双荧光标记腺病毒检测细胞中自噬流的情况Ad-mCherry-GFP-LC3B是一种可以表达mCherry-GFP-LC3B融合蛋白的腺病毒,感染后能够在靶细胞中有效表达红色荧光蛋白mCherry、绿色荧光蛋白(GFP)和LC3B的融合蛋白,呈现明亮的红色和绿色荧光,可以非常有效地追踪自噬过程。无菌镊子从体积分数75%酒精中取出单张细胞爬片,于酒精灯火焰上过火,酒精蒸发完全后放入12孔板中;分别加入按照1.2.1分组处理后的细胞,同时每孔加入50 μL Ad-mCherry-GFP-LC3B(滴度100×106pfu)腺病毒,培养48 h后在激光共聚焦显微镜下观察自噬流的情况。

2 结果
2.1 各组细胞活力比较MTT检测结果显示,高糖组、3-MA+高糖组和CY-09+高糖组细胞活力分别为(153.56±1.46)%、(115.33±3.26)%和(116.10±1.66)%,各组总体比较差异有统计学意义(F=276.63,P<0.01)。与高糖组比较,3-MA+高糖组和CY-09+高糖组的细胞活力均明显降低(均为P<0.001),3-MA+高糖组与CY-09+高糖组细胞活力相比差异无统计学意义(P>0.05)。
2.2 各组细胞迁移数比较Transwell检测结果显示,高糖组、3-MA+高糖组和CY-09+高糖组细胞迁移数分别为(117.33±7.23)个、(70.00±2.00)个和(71.67±2.52)个,各组总体比较差异有统计学意义(F=103.61,P<0.01)。与高糖组比较,3-MA+高糖组和CY-09+高糖组细胞迁移数均明显减少(均为P<0.001),3-MA+高糖组与CY-09+高糖组细胞迁移数相比差异无统计学意义(P>0.05)。见图1。

图1 倒置显微镜下各组细胞迁移情况 A:高糖组;B:3-MA+高糖组;C:CY-09+高糖组
2.3 各组细胞管腔形成数比较在基质胶中培养 6~8 h,各组细胞均有明显的管腔样结构形成,其中,高糖组、3-MA+高糖组和CY-09+高糖组细胞管腔形成数分别为(88.33±2.08)个、(61.33±1.53)个和(62.00±3.00)个,各组总体比较差异有统计学意义(F=136.23,P<0.01)。与高糖组比较,3-MA+高糖组和CY-09+高糖组细胞的管腔形成数均明显减少(均为P<0.001),3-MA+高糖组与CY-09+高糖组细胞管腔形成数相比差异无统计学意义(P>0.05)。见图2。
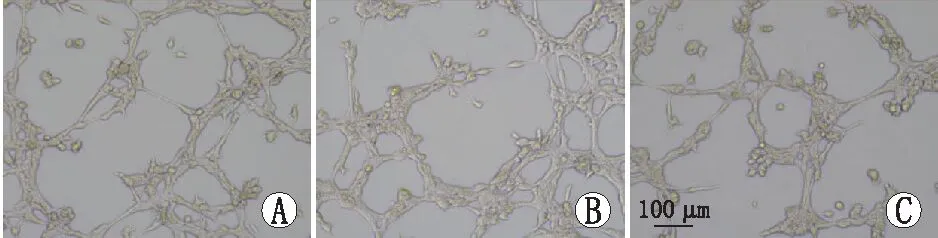
图2 倒置显微镜下各组细胞管腔形成情况 A:高糖组;B:3-MA+高糖组;C:CY-09+高糖组
2.4 各组细胞中各蛋白相对表达量Western blot检测结果显示,与高糖组比较,3-MA+高糖组和CY-09+高糖组细胞中NLRP3炎症小体及自噬信号通路均受到明显抑制,NLRP3、ASC、Caspase-1、Beclin-1蛋白相对表达量和LC3-II/LC3-I比值均显著降低(均为P<0.05)。与3-MA+高糖组相比,CY-09+高糖组中NLRP3、ASC和Caspase-1蛋白相对表达量均显著减少,而LC3-II/LC3-I比值和Beclin-1的蛋白相对表达量均显著增多(均为P<0.05)。见图3和表1。
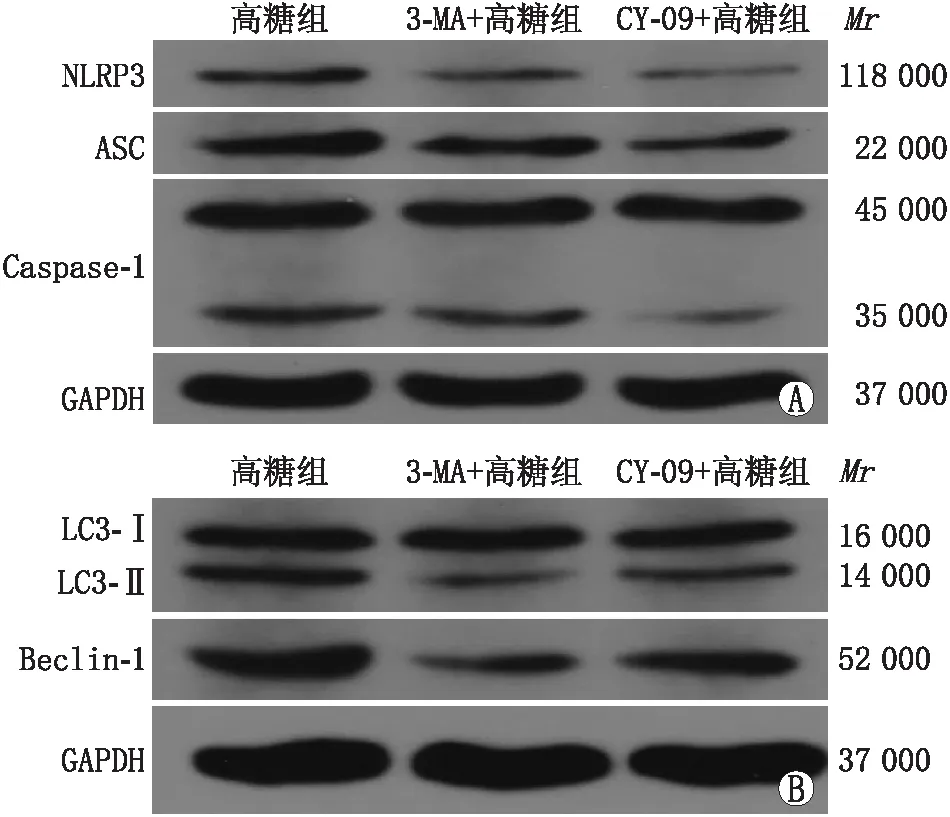
图3 各组细胞不同蛋白表达情况 A:NLRP3、ASC、Caspase-1蛋白表达;B:LC3-I、LC3-II、Beclin-1蛋白表达
表1 各组HRMEC中炎症小体和自噬蛋白相对表达量
2.5 各组细胞中自噬流的比较自噬流是检测自噬活力的可靠指标,在非自噬的情况下,mCherry-GFP-LC3B以弥散的黄色荧光(mCherry和GFP的综合效果)形式存在于细胞质中;而在自噬的情况下,mCherry-GFP-LC3B则聚集在自噬体膜上,以黄色斑点的形式表现出来;当自噬体与溶酶体融合后,因GFP荧光的部分淬灭而以红色斑点的形式表现出来。与高糖组相比,3-MA+高糖组及CY-09+高糖组细胞内黄色(自噬小体)和红色荧光小点(自噬溶酶体)均明显减少,以红色荧光小点减少最为显著(图4)。
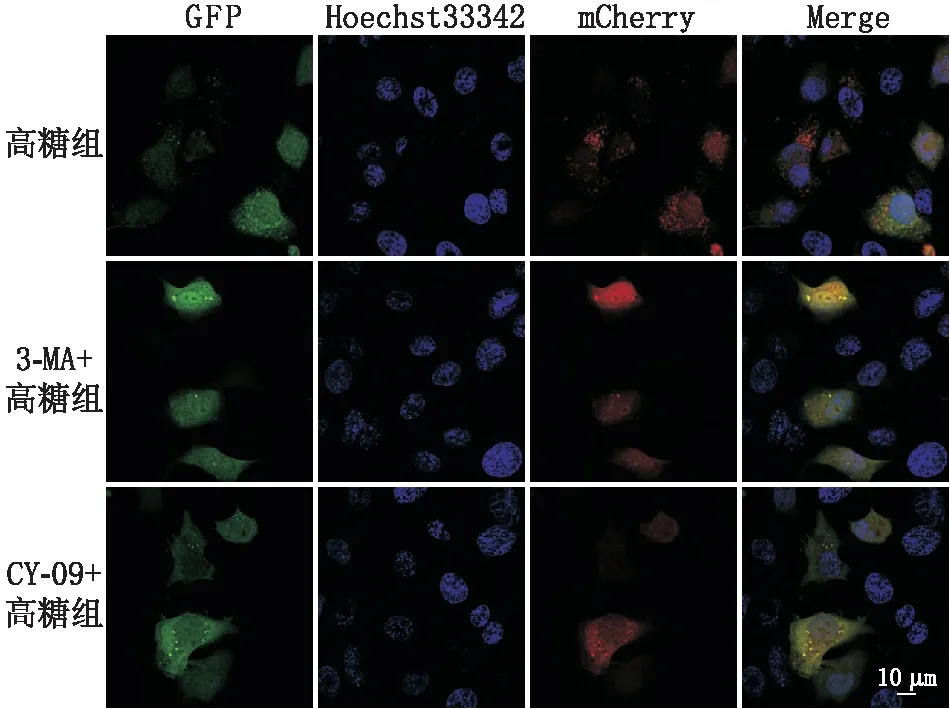
图4 各组细胞自噬流情况对比 GFP:绿色荧光;Hoechst33342:核;mCherry:红色荧光;Merge:融合
3 讨论
高血糖在糖尿病的微血管损害中发挥重要作用。现有研究已证实,高血糖引起的血管损伤涉及多种代谢途径,包括多元醇途径、晚期糖基化终末产物积累、蛋白激酶C途径和己糖胺途径等[11]。在DR的病理过程中,高糖首先带来视网膜血管扩张和血流改变[12],随后引发周细胞、内皮细胞凋亡和基底膜增厚。周细胞为毛细血管提供重要的结构支持,它们的缺失致使毛细血管壁局部外突,即形成视网膜微动脉瘤;内皮细胞凋亡和基底膜增厚导致血-视网膜屏障的损害[13-14],周细胞和内皮细胞丢失导致毛细血管闭塞和缺血,从而带来缺氧诱导因子1(HIF-1)/血管内皮生长因子(VEGF)信号通路的激活,最终导致内皮细胞增殖,引起视网膜新生血管形成[15]。本研究在体外利用广泛采用的高糖浓度模拟DR的病理环境,观察了与DR密切关联的NLRP3炎症小体与自噬在HRMEC活性、迁移和管腔形成过程中的作用。与既往研究结果一致,高糖条件下,HRMEC具有较强的血管形成能力[16-17]。
大量研究已证实,炎症在DR的病理机制中也扮演重要角色。在糖尿病动物模型和不同分期DR患者中均广泛发现有慢性低度炎症存在,如患者血浆和眼内液中的多种炎性因子和趋化因子明显增多[18-19]。NLRP3是在2002年发现的一种前炎症信号复合体,除了病原体和其他细胞外的威胁外,它们还可被各种内源性危险信号激活,参与多种疾病的发生,因此,近年来作为重要的治疗靶点备受关注[20-21]。在细胞和DR的动物模型中发现,NLRP3炎症小体信号通路的关键分子NLRP3、ASC、Caspase-1及IL-1β与细胞凋亡、血管通透性增加、视网膜厚度和功能降低有关[3,22],进而在临床患者中发现,DR患者外周血单核细胞的NLRP3、ASC和Caspase-1 mRNA和蛋白表达均明显高于正常人,PDR患眼的视网膜纤维血管膜中NLRP3、ASC的表达也明显高于正常人[23]。DR患者玻璃体内存在NLRP3炎症小体,在PDR患眼中,Caspase-1 和 IL-18伴随VEGF均明显增多;与未发生视网膜脱离的患者相比,伴有牵拉性视网膜脱离的PDR患眼内NLRP3的水平更高,故认为NLRP3炎症小体参与了PDR的病理过程[4]。与这些研究相符,本研究也发现,高糖条件下HRMEC表达较高水平的NLRP3炎症小体,即NLRP3、ASC、Caspase-1的蛋白相对表达量较高。
自噬是从酵母到人体内的一种细胞遗传性的程序化机制,在维持细胞存活、更新、物质再利用和内环境稳定等机体生理过程中发挥重要作用[24]。自噬是目前生物医学领域研究的热点之一,广泛参与各种生理和病理过程。LC3是酵母自噬关键蛋白ATG8在哺乳动物中的同源蛋白,LC3蛋白家族包括LC3A、LC3B、LC3C和GABARAP等亚家族,其中LC3B被认为是细胞自噬信号通路最为关键的标志性蛋白。LC3有两种亚型,当自噬激活时,位于细胞质内的LC3-Ⅰ转变为自噬体膜上的LC3-Ⅱ,通过检测LC3-Ⅱ/ LC3-Ⅰ比值,并配合自噬抑制剂(如3-MA)干预可以判断自噬活性[25]。Beclin-1是第一个被鉴定的哺乳动物自噬蛋白,对自噬过程至关重要[26]。mCherry-GFP-LC3B串联荧光蛋白腺病毒通过瞬时高效感染细胞,可以对自噬流进行实时监测[27]。大量研究已证实,高糖能激活自噬,自噬功能障碍参与了DR及视网膜新生血管的发病机制[6,16,28]。自噬是一个高度动态的多步骤过程,需要结合多种方法准确检测自噬体和整个自噬流的过程来判断自噬的变化。本研究利用Western blot检测LC3-Ⅱ/Ⅰ比值、Beclin-1的蛋白表达以及mCherry-GFP-LC3B腺病毒转染HRMEC,发现同既往研究结果一致,高糖条件下细胞自噬处于较高水平[17]。
由于多因素疾病的复杂性,任何致病因素与DR之间的联系都值得怀疑。因此,本研究探讨了NLRP3炎症小体与自噬在DR发病机制中的相互作用。结果发现,高糖条件下3-MA和CY-09预处理均可显著降低HRMEC细胞活力,抑制细胞迁移和管腔形成,提示激活NLRP3炎症小体与自噬均可促进DR的视网膜新生血管形成;给予自噬抑制剂3-MA处理后,HRMEC的NLRP3、ASC、Caspase-1蛋白表达均明显降低,给予NLRP3炎症小体抑制剂CY-09处理时,自噬标志蛋白LC3-Ⅱ/ LC3-Ⅰ比值和Beclin-1的蛋白表达均明显降低,同时自噬流也有不同程度的抑制,提示NLRP3炎症小体与自噬在高糖条件下互相正向调控。在动物模型和人糖尿病肾病活检组织中均发现,激活的NLRP3炎症小体负向调控足细胞自噬,抑制高糖条件下的NLRP3可以减少细胞损伤[8]。在糖尿病大鼠的研究中发现,激活自噬可以抑制NLRP3炎症小体,从而减轻其心肌缺血-再灌注损伤[7]。以往许多研究表明,自噬可以抑制NLRP3炎症小体,但近年来的研究发现,自噬在某些情况下也可以促进NLRP3炎症小体激活[29],而NLRP3炎症小体反过来又会影响自噬[30]。本研究结果与以上这些研究发现存在异同,可能是由于NLRP3炎症小体与自噬之间的双向关系非常复杂,由于不同疾病条件的变化,它们之间可能会产生完全相反的影响。
总之,本研究结果初步提示NLRP3炎症小体与自噬相互调控,共同参与了DR的视网膜新生血管形成,但二者之间互相影响的调控机制仍需进一步研究。此外,细胞模型不能完全代表体内的真实病理情况,在后续研究中需要采用DR动物模型及患者组织标本对二者的关系进行深入探讨。

