纳米银溶胶催化氧化-分光光度法快速测定水中汞
操江飞,韦寿莲,廖根成
(肇庆学院 环境与化学工程学院,肇庆 526061)
随着冶炼、电镀等工业生产的不断发展,所需汞及含汞化合物的用量也日趋增加,随之含汞废水的排放也愈加严重,含汞废水现已成为世界上危害较大的工业废水之一。汞中毒以消化系统和神经系统症状为主,表现为口腔黏膜溃烂、头痛、记忆力减退、语言失常,严重者有各种精神障碍,加之无机汞在自然界中难以降解,因此汞常被称为人类健康的隐形杀手[1]。基于汞的监测显得尤为重要,目前汞的测定方法主要有双硫腙分光光度法、冷原子吸收光谱法(HJ 597-2011《水质 总汞的测定 冷原子吸收分光光度法》)、冷原子荧光光谱法和原子荧光光谱法[2]。双硫腙分光光度法对测定要求严格,操作较繁琐,其他方法需昂贵的仪器,成本高。近年来,比色传感分析由于方法简单、快速、灵敏度高、测定方便等优点,受到广泛关注。文献[3-4]报道了功能化的纳米金比色法测定Hg2+。文献[5]报道了基于银-聚乙烯醇薄膜制作了测定汞、Hg(Ⅰ)和Hg(Ⅱ)的通用传感器。文献[6]报道了在水溶液中通过绿色生物法合成纳米银采用比色法测定Hg2+。这些比色传感方法能直观地从颜色变化来测定Hg2+,但是还存在选择性、灵敏度不高,探针材料复杂、昂贵,不适合现场测定等缺点。文献[7]报道了金纳米电化学方法测定Hg2+,灵敏度高,但电化学方法抗干扰能力弱,重现性差,限制了此类方法的实际应用。文献[8-9]报道了利用荧光探针测定Hg2+,但探针材料合成复杂,溶剂为有机溶剂,会造成二次污染。因此,需要寻找一种灵敏度高、选择性高,且能够适用于普通实验室测定Hg2+的方法。
本工作通过柠檬酸三钠还原硝酸银法[10-11]合成纳米银(AgNPs)溶胶,在纳米银的合成过程中引入表面活性剂聚乙烯吡咯烷酮(PVP)[12-13]优化AgNPs的粒径大小。AgNPs催化溶液中溶解氧氧化3,3′,5,5′-四甲基联苯胺(TMB)生成蓝色的TMB氧化物(oxTMB),同时利用AgNPs将Hg2+还原为汞,以汞壳形式吸附在AgNPs的表面[14],使AgNPs中毒,减弱其催化氧化作用,使颜色发生变化[15],从而开发一种Hg2+比色传感器。Hg2+测定原理示意图见图1。
本工作采用纳米银溶胶催化氧化-分光光度法快速测定水中汞的含量,同时探究了传感器的选择性、灵敏度、稳定性以及实际应用等。本方法灵敏度高、选择性好、应用价值大。
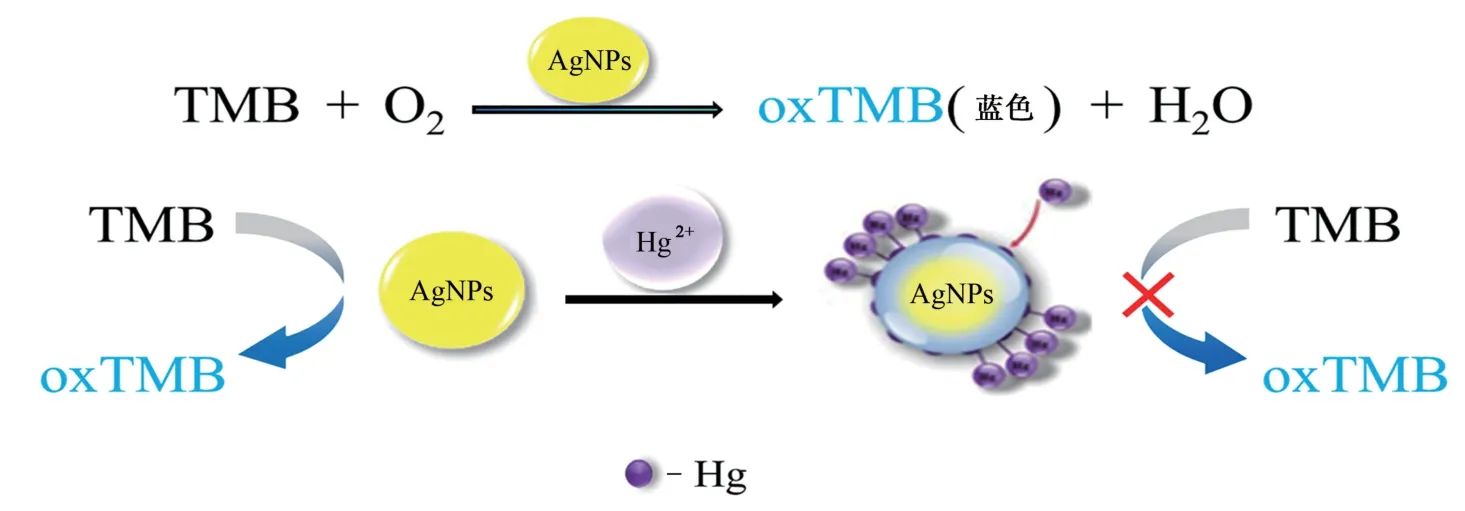
图1 Hg2+测定原理示意图Fig.1 Diagrammatic sketch of principle of Hg2+determination
1 试验部分
1.1 仪器与试剂
HH-S2型系列恒温水浴锅;149A0279 型超声波清洗器;ADP310C 型真空干燥箱;DHG-9075AD型电热恒温鼓风干燥箱;UV-2600型紫外-可见分光光度计。
汞标准储备溶液:100 mg·L-1。
硝酸银的纯度为99.8%;其余试剂均为分析纯;试验用水为蒸馏水。
1.2 试验方法
1.2.1 不同粒径AgNPs溶胶的制备
采用液相还原法[16]合成AgNPs溶胶。称取0.017 0 g硝酸银置于250 mL 锥形瓶中,加入80 mL水摇匀、溶解,再加入0.029 4 g二水合柠檬酸三钠(配制7份),然后分别加入0,0.1,0.3,0.5,0.7,0.9,1.0 g PVP,再加入20 mL 水,超声至完全溶解。将上述锥形瓶敞口置于沸水浴中约8 min,至溶液颜色变黄,快速用胶头滴管取少量反应溶液加入至少量盐酸当中,无浑浊产生,即制得7种不同粒径的AgNPs溶胶,低温避光保存。按照PVP 加入量由低到高分别标记7种AgNPs溶胶为A、B、C、D、E、F、G。
1.2.2 AgNPs溶胶催化氧化TMB
移取4 mL水和200μL 的2 g·L-1TMB 溶液,摇匀,加入300μL AgNPs溶胶D(PVP加入量为0.5 g),在20 ℃水浴反应2 min后,得到蓝色溶液,在波长652 nm 处测量其吸光度。
1.2.3 样品前处理
在某油墨厂污水排水口5 m 处采集水样,采集某学院池水的水样。由于油墨污水的色度直接影响测定结果的准确性,因此需要对样品进行前处理。取25 mL油墨污水样品,用0.25μm 一次性过滤器过滤,加入3.0 mL 硝酸和1.0 mL 的30%(质量分数)过氧化氢溶液,加热蒸发至溶液呈无色澄清或微黄色,最后用5%(体积分数)硝酸溶液定容至25.0 mL[17-18],作为样品溶液备用。
1.2.4 Hg2+的测定
分别取4 mL 水样或Hg2+标准溶液,加入200μL的2 g·L-1TMB溶液,摇匀,再加入300μL AgNPs溶胶D,在20 ℃水浴下反应2 min后,得到蓝色深浅不同的体系,并测量其在波长652 nm 处的吸光度。与空白样品比较,含Hg2+样品体系蓝色较浅,表明可以裸眼观测样品中有无Hg2+,确定检出限。在一定含量范围内,测量Hg2+标准溶液系列的吸光度,绘制标准曲线,可测定Hg2+。
2 结果与讨论
2.1 不同粒径AgNPs溶胶的吸收光谱
AgNPs溶胶A~G 的显色情况如下:当PVP加入量高于0.5 g时,体系颜色越来越浅,最终为无色;AgNPs溶胶A 为灰绿色浊液,AgNPs溶胶B为黄色浊液,AgNPs溶胶C为黄褐色浊液,AgNPs溶胶D 呈黄色透明,AgNPs 溶胶E 呈灰色透明,AgNPs溶胶F呈近乎无色透明,AgNPs溶胶G 呈无色透明。
在波长350~550 nm 内对Ag NPs溶胶A~G进行扫描,所得吸收光谱见图2。
由图2可知:AgNPs特征峰的吸光度由A~G逐渐减小。AgNPs的吸光度增大是AgNPs溶胶浑浊程度加大、AgNPs尺寸不均匀且粒径普遍较大的表现。由A 至E,随着PVP用量的增加,AgNPs溶胶在波长430 nm 处吸收峰强度下降且蓝移,表明了PVP在AgNPs形成过程中阻止了金属纳米粒子不断生长,具有保护和稳定AgNPs 的作用。当PVP用量为0.9 g(对应AgNPs溶胶F)时,没有特征吸收峰、近乎无色的AgNPs溶胶,结构为络合状态,由于有大量的PVP分子的包覆,使纳米粒子难以生长,其粒径大多分布在2~5 nm[19],进一步说明随着PVP用量的增加,AgNPs的粒径会降低。

图2 不同粒径AgNPs溶胶的吸收光谱Fig.2 Absorption spectra of AgNPs sols with different particle size
2.2 不同粒径AgNPs溶胶的催化性能
取4 支试管,分别加入4 mL 水及100μL 的2 g·L-1TMB溶液,摇匀后分别加入Ag NPs溶胶A、B、D、G 各200μL,在20℃水浴下反应2 min,在波长400~800 nm 内对其进行扫描。4种AgNPs溶胶催化氧化TMB体系的吸收光谱见图3。
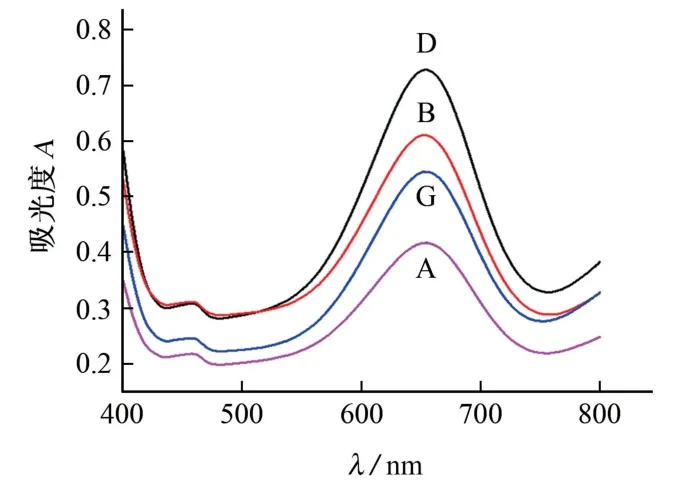
图3 4种AgNPs溶胶催化氧化TMB体系的吸收光谱Fig.3 Absorption spectra of catalytic oxidation of TMB system by 4 AgNPs sols
由图3 可知:在波长652 nm 处,加入AgNPs溶胶D 后,体系的吸光度最大,催化性能最好,其次依次为加入AgNPs溶胶B、G、A;AgNPs的催化活性并不完全随其粒径的降低而增强,无色透明的AgNPs溶胶G 粒径最小,但其催化能力反而下降了,可能是由于过多的PVP 分子对纳米粒子的保护,影响了其本身的光电效应和表面效应。因此,Ag NPs溶胶制备时以0.5 g PVP作为分散剂,制备的AgNPs溶胶D 催化性能最佳。
2.3 AgNPs催化机理
在两支试管中分别加入4 mL 水和100μL 的2 g·L-1TMB溶液,摇匀,其中一支试管通氮气除氧10 min(通氮气体系),另一支试管静置(未通氮气体系)。在两支试管中分别加入200μL AgNPs溶胶D,在20 ℃水浴反应2 min后,观察颜色发现:通氮气体系为无色透明溶液,未通氮气体系为淡蓝色溶液。在波长652 nm 处测量上述两种体系的吸光度,结果表明:通氮气体系的吸光度为0.01;未通氮气体系的吸光度为0.57,远远高于通氮气体系。这说明AgNPs溶胶对TMB 的催化活性是通过体系中的溶解氧作为氧化剂所产生的。
2.4 反应时间的选择
取6 支试管,分别加入4 mL 水及200μL 的2 g·L-1TMB溶液,摇匀,加入300μL AgNPs溶胶D,依次在20 ℃水浴中反应0.5,1,2,5,10,20 min后,在波长652 nm 处测量其吸光度。反应时间对反应体系吸光度的影响见图4。

图4 反应时间对反应体系吸光度的影响Fig.4 Effect of reaction time on absorbance of the reaction system
由图4可知:反应时间为2~5 min时,反应体系的吸光度达到最大且基本稳定;反应时间大于5 min时,反应体系的吸光度下降,可能是因为反应时间过长,生成的ox TMB 不稳定,再次发生了分解,使蓝色褪去。为了减少误差,试验选择反应时间为2 min。
2.5 反应温度的选择
取5 支试管,分别加入4 mL 水及200μL 的2 g·L-1TMB溶液,摇匀,加入300μL AgNPs溶胶D,依次在15,20,25,30,35 ℃水浴下反应2 min后,在波长652 nm 处测量其吸光度。结果表明:随着反应温度逐渐升高,反应体系的吸光度逐渐减小,AgNPs的催化能力降低;反应温度为15 ℃时,反应体系的吸光度略好于反应温度为20 ℃时反应体系的吸光度,这可能是随反应温度升高,溶液中溶解氧含量减少有关。考虑到反应温度降低的同时,会降低Hg2+与AgNPs的反应速率,试验选择反应温度为20 ℃。
2.6 TMB用量的选择
取5支试管,分别加入4 mL 水,依次加入50,100,200,300,400μL 的2 g·L-1TMB 溶液,摇匀,加入300μL Ag NPs溶胶D,在20 ℃水浴下反应2 min后,在波长652 nm 处测量其吸光度。结果表明:随着2 g·L-1TMB溶液用量的增加,反应体系的吸光度逐渐增大;2 g·L-1TMB 溶液用量为200μL 时,反应体系的显色效果较好;2 g·L-1TMB溶液用量增加至300μL 时,反应体系的吸光度增加,但增加曲线的斜率减小且会影响微量汞的测定。试验选择2 g·L-1TMB 溶液用量为200μL。
2.7 AgNPs溶胶D用量的选择
取5支试管,分别加入4 mL 的1×10-6mol·L-1汞标准溶液及200μL 的2 g·L-1TMB 溶液,摇匀,依次加入100,200,300,400,500μL AgNPs溶胶D,在20 ℃水浴下反应2 min 后,在波长652 nm 处测量其吸光度。结果表明:随着AgNPs溶胶D 用量的增加,反应体系的吸光度逐渐增大;当AgNPs溶胶D 的用量为300μL 时,反应体系的吸光度突然增大,说明只有保证AgNPs适量才能使AgNPs与TMB、AgNPs与Hg2+的反应成为一种竞争反应,从而在一定线性范围中测定Hg2+。当AgNPs的用量过大时,微量的汞离子就无法减弱其催化性能、改变体系颜色,达不到测定的效果;当Ag NPs的用量过小时,分析的误差随之增大,同样是不利的。试验选择AgNPs溶胶D 的用量为300μL。
2.8 AgNPs-TMB比色体系的选择性
为了探讨Hg2+对AgNPs的选择性,试验采用比较有代表性的碱金属元素离子(K+、Na+)、碱土金属元素离子(Ca2+、Mg2+)以及过渡金属元素离子(Zn2+、Pb2+、Cr3+)作为干扰离子。取9支试管,其中8支试管先分别加入4 mL的1×10-5mol·L-1的K+、Na+、Zn2+、Ca2+、Mg2+、Pb2+、Cr3+及Hg2+标准溶液,再向9 支试管中加入200μL 的2 g·L-1TMB 溶液,摇匀后加入300μL AgNPs溶胶D,在20 ℃下反应2 min,在波长652 nm 处测量其吸光度。结果表明:金属干扰离子为K+、Na+、Zn2+、Ca2+、Mg2+、Pb2+、Cr3+和无干扰离子的反应体系均为蓝色溶液;加入Hg2+的反应体系为无色透明溶液。这说明在相同反应条件下只有Hg2+可以使AgNPs失活,TMB 无法氧化为ox TMB,最终体系颜色呈无色。
各种金属干扰离子存在时AgNPs-TMB 体系的吸光度见表1。

表1 各种金属干扰离子存在时AgNPs-TMB体系的吸光度Tab.1 Absorbances of AgNPs-TMB systems with various metal interference ions
由表1 可知:相同浓度的金属干扰离子对AgNPs-TMB 体系的吸光度的相对误差小于±7.5%。本方法具有良好的选择性。
2.9 标准曲线和检出限
取5支试管,分别加入4 mL 的5×10-8,1×10-7,5×10-7,1×10-6,5×10-6mol·L-1Hg2+标准溶液,加入200μL的2 g·L-1TMB溶液,摇匀,再加入300μL AgNPs溶胶D,在20 ℃水浴下反应2 min后,在波长652 nm 处测量其吸光度,结果见图5。
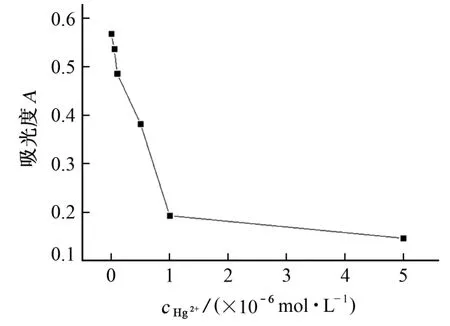
图5 Hg2+标准溶液的吸光度Fig.5 Absorbances of Hg2+standard solution
由图5 可知:Hg2+浓度在5×10-8~1×10-6mol·L-1内,与其对应的吸光度呈一定的线性关系。试验表明:Hg2+浓度低至1×10-8mol·L-1时,其吸光度却会略高于的空白溶液的吸光度(见表1)。这是由于银-汞合金会增强AgNPs的催化性能[20],因此当Hg2+浓度低于一定程度时,AgNPs粒子表面生成的汞不足以形成汞壳,包覆AgNPs粒子,而是形成银-汞合金,宏观表现为AgNPs的催化性能增强,而不是抑制。当Hg2+浓度高至5×10-6mol·L-1时,吸光度下降过低,且溶液出现浑浊,可能是在AgNPs粒子上生成了大量的汞单质。
Hg2+的检出限为5×10-8mol·L-1(即0.01 mg·L-1的Hg2+)。
采用显色稳定且呈线性的浓度范围(1×10-7~1×10-6mol·L-1)绘制标准曲线。Hg2+标准溶液系列的浓度为1×10-6,9×10-7,8×10-7,7×10-7,6×10-7,5×10-7,4×10-7,3×10-7,2×10-7,1×10-7mol·L-1,按试验方法在波长652 nm 处测量其吸光度,并绘制标准曲线。结果表明:Hg2+浓度在1×10-7~1×10-6mol·L-1内与其对应的吸光度呈线性关系,线性回归方程为y=-9.570×10-2x+1.055,相关系数为0.996 3。
2.10 样品分析
按试验方法分别取某学院池水样品和某油墨厂油墨污水样品进行分析,并与环境标准HJ 597-2011《水质 总汞的测定 冷原子吸收分光光度法》的测定结果进行比较,同时进行加标回收试验,计算回收率和测定值的相对标准偏差(RSD),结果见表2。

表2 样品分析结果(n=5)Tab.2 Analytical results of the samples(n=5)
由表2可知:池水样品中本方法未检出Hg2+,油墨污水样品中检出一定量的Hg2+;本方法对油墨污水样品的测定结果与环境标准HJ 597-2011《水质 总汞的测定 冷原子吸收分光光度法》测定结果一致;回收率为98.0%~102%,RSD 均小于2.0%。
本工作建立了纳米银溶胶催化氧化-分光光度法快速测定水中汞的分析方法,本方法具有操作简单、经济实惠、快速、灵敏、选择性好等优点,能达到国家汞排放标准监测要求。

