纯种强化发酵细菌型水豆豉细菌菌群动态研究
郭 娅,黄晓润,黎忠杰,曾金兴,陶 怡,吴拥军
(贵州大学生命科学学院,贵州贵阳 550025)
豆豉是以黄豆、黑豆为主要原料,利用微生物发酵制成的调味副食品,是深受我国民众欢迎的传统发酵食品[1]。其中,水豆豉是以大豆为原料,煮熟堆积保温发酵后添加佐料(辣椒、姜)而制成的市售产品。贵州水豆豉作为贵州地区特色微生物发酵大豆食品,其主要为细菌型豆豉。研究发现,豆豉中含有多种生理活性物质,具有特殊的保健作用,能促进皮肤、小肠粘膜损伤修复,保证机体生物氧化正常进行,并含有18种氨基酸,其中7种为人体必需氨基酸[2-4]。此外,还具有和胃、除烦、祛寒的功效,对减少血中胆固醇、降低血压也有一定作用。
迄今为止,对豆豉安全性方面的研究很少。在已有报道中,黄欣[5]从浏阳豆豉中分离出危害肾脏的赭曲霉(Aspergillus ochraceus)和可致动物肝癌、胃癌的聚多曲霉(Aspergillus sydowi);廖万清等[6]研究发现,聚多曲霉可引起阻塞性支气管曲霉病;蒋立文等[7]研究发现,曾有因食用细菌型豆豉引起的A型肉毒毒素中毒事件;WEI C L等[8]研究发现,组胺、高浓度NaCl、黄曲霉毒素也对豆豉食用性产生影响,所以豆豉内微生物种类对食用安全存在极大影响,是一个值得关注的焦点。
聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCRDGGE)技术能分离长度相似但序列组成不同的双链聚合酶链式反应(polymerase chain reaction,PCR)产物[9-10],是检测微生物群落遗传多样性的主要分子生物学方法之一。MUYZER G等[11]在1993年首次将DGGE技术应用于微生物群落结构[12-13]的研究,1999年首次应用于食品微生物多样性检测[14-15]。目前,DGGE技术已广泛应用于发酵食品中微生物多样性的研究[16-17]。
本研究采用PCR-DGGE技术首次对贵州枯草芽孢杆菌(Bacillus subtilis)BJ3-2纯种强化发酵的细菌型水豆豉工厂化生产过程中前发酵(制曲期间)和后发酵过程中细菌菌群变化进行研究,解析细菌型水豆豉生产过程中食源性致病菌的动态变化,对评估其生物安全性以及指导生产控制具有积极意义。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
豆豉样本:贵阳某水豆豉生产企业。
1.1.2 菌株与载体
枯草芽孢杆菌(Bacillus subtilis)BJ 3-2、大肠杆菌(Escherichia coli)BL21(DE3):本实验室保藏菌种;测序载体pGEM-T Easy Vector System I:美国Promega公司。
1.1.3 试剂
尿素、三羟甲基氨基甲烷、甲叉双丙烯酰胺:美国BIO-RAD公司;过硫酸铵:北京Solarbio公司;乙二胺四乙酸二钠、丙烯酰胺、去离子甲酰胺、四甲基乙二胺(tetramethylethylenediamine,TEMED):美国AMRESCO公司;冰醋酸:重庆川江化学试剂厂;GelRedTM 1000:美国BIOTIUM公司;氯化钙:德国Sigma公司;琼脂糖:吉恩(上海)贸易有限公司;甲醛:重庆川东化工(集团)有限公司;无水乙醇:国药集团化学试剂有限公司;胰蛋白胨、酵母粉:上海根生生物科技有限公司;NaCl:苏州同盛医药科技有限公司;琼脂粉:美国Sigma-Aldrich(集团)有限公司;E.Z.N.A.TM Plasmid Mini Kit Ⅰ(200)、E.Z.N.A.TMGel Extraction Kit(200):美国Omega公司;Bacterial Genomic脱氧核糖核酸(deoxyribonucleic acid,DNA)Extraction Kit Ver.3.0:日本Takara公司。所用试剂均为分析纯或生化试剂。
1.1.4 培养基
LB固体培养基:胰蛋白胨1 g,酵母粉0.5 g,氯化钠1 g,琼脂粉3 g,去离子水100 mL,调pH值至7.2。LB液体培养基中不添加琼脂粉。
1.2 仪器及设备
DCodeTMUnivesrsal Mutation Detection System、C1000 TouchTMThermal Cycler、Univesrsal Hood Ⅱ凝胶成像分析仪:美国Bio-Rad公司;Eppendorf Centrifuge 5417R离心机:德国Eppendorf公司;Applied Biosystems Veriti 96 Well ThermalCycler聚合酶链式反应仪:上海拜力生物科技有限公司。
1.3 实验方法
1.3.1 纯种强化发酵细菌型水豆豉工艺[18]
将高温高压(110 ℃、20 min)蒸煮好的黄豆,冷却至40~50 ℃,活化枯草芽孢杆菌(Bacillus subtilis)BJ3-2菌液使其OD600nm值在0.5~0.8,按4%接种量喷雾接种,搅拌均匀,置于发酵室,37 ℃发酵66 h(前发酵)制曲,按配方添加辅料(生姜、辣椒、食盐),装瓶,放入恒温室,40 ℃发酵7 d(后发酵),即为成品水豆豉。
采用五点定时取样法取200 g纯种强化发酵细菌型水豆豉,混匀,4 ℃密封保存。前发酵为每6 h取样一次,周期3 d;后发酵为每天取样一次,周期7 d,共19个样。
1.3.2 水豆豉宏基因组提取
分别取前发酵和后发酵期间不同时间段的水豆豉样品5 g,置于10 mL无菌磷酸缓冲盐溶液(phosphate buffer saline,PBS)(pH 7.2)中,150 r/min离心30 min,自然沉降5 min,吸取1 mL菌悬液,12 000 r/min离心2 min,弃上清;加1 mL无菌水重悬清洗,12 000 r/min离心2 min,收集菌体。采用Bacterial Genomic DNA Extraction Kit Ver.3.0试剂盒提取水豆豉样品的宏基因组,采用1%琼脂糖凝胶电泳检测。
1.3.3 PCR扩增
以水豆豉宏基因组为模板,选用细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')及1492R(5'-GGCTACCTTGTTACGACTT-3')对细菌的16S rDNA进行PCR扩增。PCR扩增体系:10×PCR Buffer 2 μL、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)1.6 μL、27F 0.4 μL、1492R 0.4 μL、模板0.4 μL、rTaq酶0.1 μL、超纯水15.1 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,30个循环;72 ℃再延伸10 min。采用1%琼脂糖凝胶电泳检测。
以16S rDNA序列为模板,采用引物338F(带GC夹)(5'-CGCCCGCCGCGCGCCGCGGGCGGGGCGGGGGCACGGGGGGTACGGGAGGCAGCAG-3')及518R(5'-ATTACCGCGGCTGCTGG-3')对细菌的16S rDNA的V3区序列进行降落式PCR扩增。
PCR扩增体系:10×PCR Buffer 5 μL、dNTP 4 μL、338F 1 μL、518R 1 μL、模板1 μL、rTaq酶0.25 μL、超纯水37.25 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,68 ℃(每循环降0.5 ℃)退火30 s,72 ℃延伸30 s,20个循环;72 ℃再延伸7 min。采用1%琼脂糖凝胶电泳检测。
1.3.4 DGGE电泳及图谱分析
参照MUYZER G等[11]方法,对16S rDNA的V3区序列PCR扩增产物进行DGGE,凝胶成像拍照,用Quantity One分析电泳条带差异。
1.3.5 DGGE切胶回收及克隆测序
切取DGGE明亮的目的条带,加双蒸水(ddH2O),4 ℃过夜保存。取1 μL上清液作为模板,用不带GC夹的V3区引物338F'(5'-TACGGGAGGCAGCAG-3')及518R'(5'-ATTACCGCGGCTGCTGG-3')进行PCR扩增,采用E.Z.N.A.TMGel Extraction Kit(200)回收纯化,与载体pGEM-T Easy Vector System I连接后,转化至E.coli(DE3)感受态细胞,涂布于含有60 μg/mL氨苄青霉素的LB固体培养基,37 ℃过夜培养。挑取阳性单菌落加入含有60 μg/mL氨苄青霉素的LB液体培养基,37 ℃、180 r/min培养12 h,提取质粒,委托大连宝生物公司测序。
1.3.6 数据分析
采用Quantity One 4.6.2软件对DGGE图片处理分析。将优势条带和变化明显的条带切胶回收后测序,测序所得的16S rDNA的V3区序列提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行Blast同源性比对搜索[19]。采用Sensitivity 10、Lane Width 4mm、Min.Density 0.00%、Noise Filter 4.84、Shoulder Sens.1.0处理电泳条带、粗定量分析。
2 结果与分析
2.1 水豆豉样品宏基因组的提取
水豆豉样品宏基因组的琼脂糖凝胶电泳结果见图1。由图1可知,基因组条带都较为完整、少量降解,基因片段碱基长度在15 000 bp左右,可进行16S rDNA PCR扩增。

图1 细菌型水豆豉前发酵(A)及后发酵(B)样品的宏基因组Fig.1 Metagenome of bacterial water-Douchi samples in pre-fermentation (A) and post-fermentation (B)
2.2 PCR扩增
以纯种强化发酵细菌型水豆豉前发酵(A)及后发酵(B)样品的宏基因组为模板进行16SrDNAPCR扩增,结果见图2。由图2可知,PCR扩增产物条带单一且碱基长度为1 500 bp左右,与目标结果相符,可用其作为模板进行16S rDNA V3区序列PCR扩增,结果见图3。由图3可知,PCR扩增产物条带单一且碱基长度为250 bp左右,与目标结果相符,可用于DGGE实验。

图2 细菌型水豆豉前发酵(A)及后发酵(B)样品16S rDNA PCR扩增产物Fig.2 PCR products of 16S rDNA of bacterial water-Douchi samples in pre-fermentation (A) and post-fermentation (B)

图3 细菌型水豆豉前发酵(A)及后发酵(B)样品16S rDNA V3区序列PCR扩增产物Fig.3 PCR products of 16S rDNA V3 region sequences of bacterial water-Douchi samples in pre-fermentation (A) and post-fermentation (B)
2.3 DGGE结果分析
通过quantityone 4.6.2软件处理DGGE结果,结果见图4。对不同发酵时间的DGGE条带数进行统计,结果见图5。选取条带明亮清晰度高的24条条带进行测序、鉴定,鉴定结果见表1。各个发酵时期水豆豉样品中细菌的分布见图6。

图4 细菌型水豆豉样品16S rDNA V3区序列PCR扩增产物的DGGE图谱Fig.4 DGGE map of PCR products of 16S rDNA V3 region sequences of bacteria in bacterial water-Douchi samples

图5 细菌型水豆豉样品16S rDNA V3区序列PCR扩增产物的DGGE条带数Fig.5 DGGE band numbers of PCR products of 16S rDNA V3 region sequences of bacterial water-Douchi samples
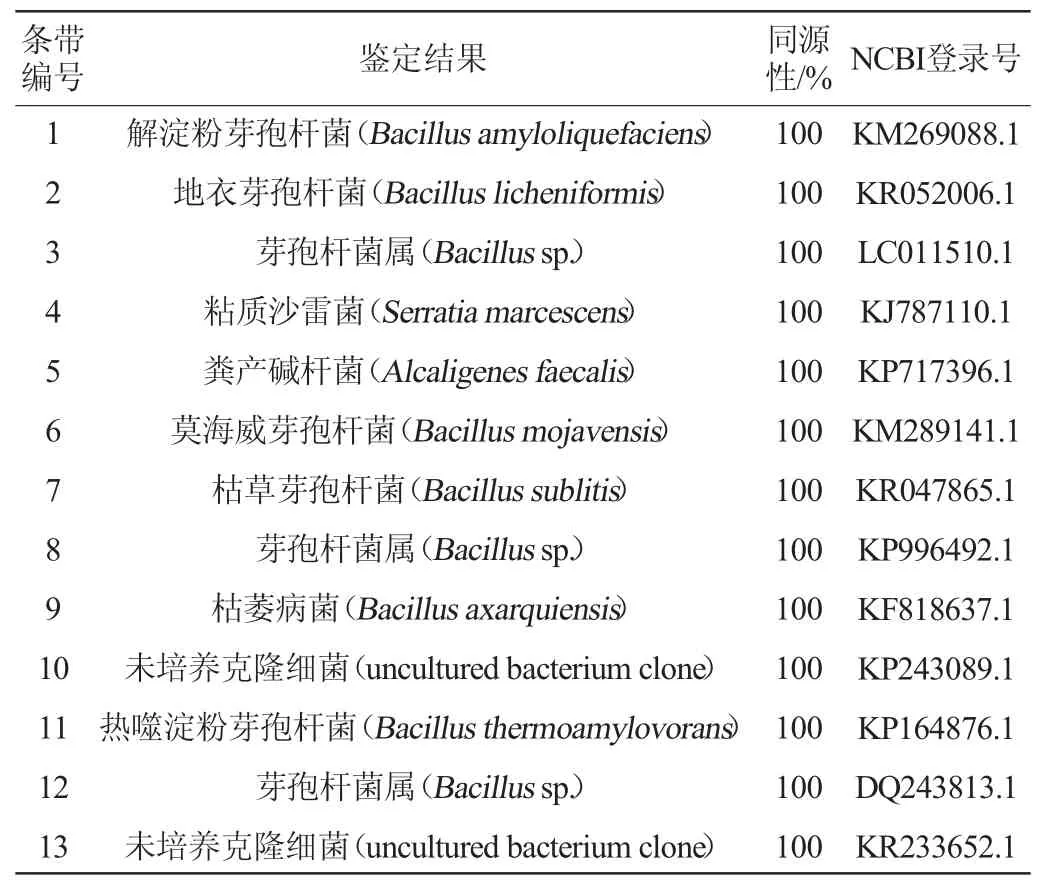
表1 DGGE条带鉴定结果Table 1 Identification results of DGGE band
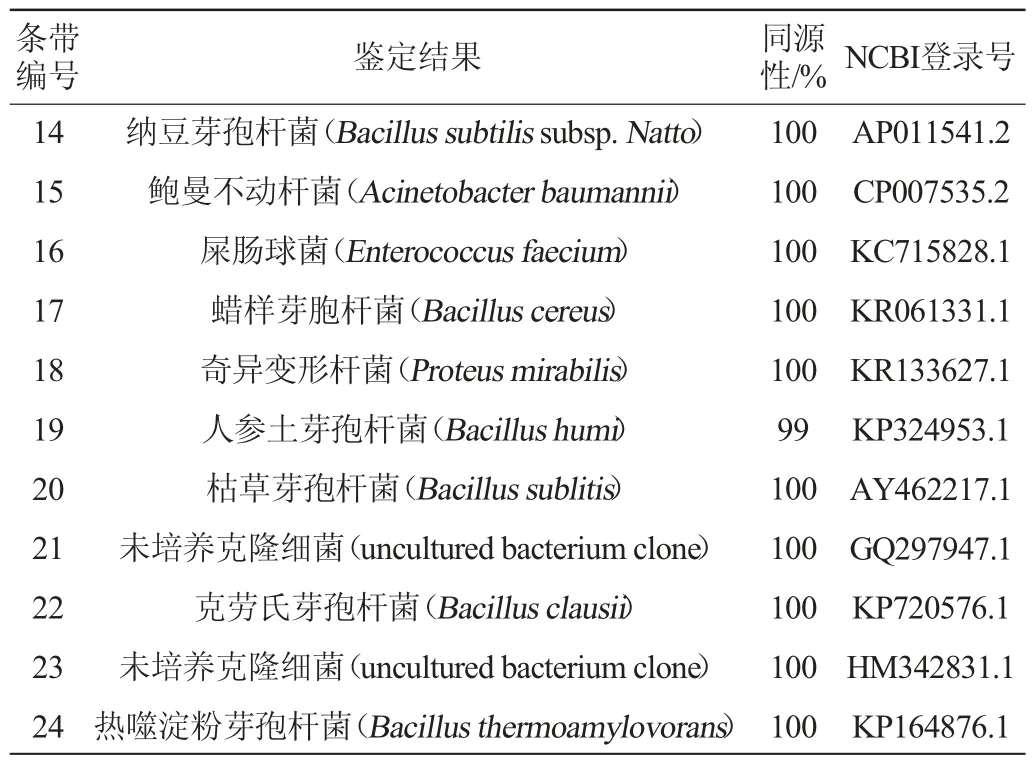
续表

图6 细菌型水豆豉样品发酵过程中细菌的分布Fig.6 Distribution of bacteria in bacterial water-Douchi samples during fermentation
DGGE图谱中每一泳道条带的数量代表微生物的丰富度,亮度强弱代表细菌的数量。由图4、图5可知,在前发酵42 h后,细菌种类数量丰富并趋于稳定。后发酵第5天细菌种类最多,推测是由于后期加辅料时带入的外源细菌。由表1可知,24条条带中有3条只能鉴定到属,4条为未培养克隆细菌。整个发酵时期共鉴定出6个属共15个种,分别为芽孢杆菌属、沙雷菌属、产碱菌属、肠球菌属、不动杆菌属以及变形杆菌属。由图4及图6可知,枯草芽孢杆菌存在水豆豉的整个发酵期间,且数量最多,为主酵细菌。解淀粉芽孢杆菌一直存在发酵过程中,属于优势菌。前发酵18 h后出现热噬淀粉芽孢杆菌,分析可能由于曲温达到50 ℃左右,适宜嗜热细菌的生长,而其他一些不适宜高温的微生物则被抑制。同时,从中共检测到6种条件致病菌,分别为粘质沙雷菌(Serratia marcescens)、粪产碱菌(Alcaligenes faecalis)、蜡样芽孢杆菌(Bacillus cereus)、奇异变形杆菌(Proteus mirabilis)与鲍氏不动杆菌(Acinetobacter baumannii)、屎肠球菌(Enterococcus faecium)。其中,粘质沙雷菌与粪产碱杆菌只存在前发酵0~6 h,推测可能是发酵前带入的菌或发酵室环境污染。鲍曼不动杆菌、蜡样芽孢杆菌、奇异变形杆菌、屎肠球菌在前发酵第66小时以及后发酵阶段被检出,推测可能是由于添加辅料时污染或辅料本身带有。其中,P.mirabilis首次被发现存在于贵州细菌型水豆豉中。检测到的屎肠球菌有较强的产酪胺和苯乙胺的能力[20],而芽孢杆菌属产尸胺,变形杆菌属产组胺,沙雷氏菌属产腐胺[21]。在豆豉发酵过程中,这4个菌属细菌的存在影响贵州水豆豉生物胺含量。鲍氏不动杆菌是目前临床上较为常见的条件致病菌。有研究发现,大蒜素对鲍氏不动杆菌有抑菌作用[22]。而蜡样芽孢杆菌在10 ℃以下时停止繁殖,在100 ℃条件下处理20 min可被杀死,生长最低水分活度为0.95[23]。因此,豆豉发酵可以通过添加抑菌性辅料(如大蒜素、辣椒、盐等)或控制发酵条件(如温度、湿度、含氧量等)[21-23]抑制甚至杀死原料中本身带有或后期带入的(条件)致病菌,对工业化生产豆豉的污染菌防控具有理论指导意义。
3 结论
通过PCR-DGGE技术研究发现,纯种强化发酵水豆豉前发酵42 h后,细菌种类及数量丰富并趋于稳定,后发酵第5天,细菌种类达到最大。从中共鉴定出6个属15个种,包括芽孢杆菌属(Bacillus)、沙雷菌属(Serratia)、产碱菌属(Alcaligenes)、肠球菌属(Enterococcus)、不动杆菌属(Acinetobacter)以及变形杆菌属(Proteus)。整个发酵期间共检测出6种条件致病菌,分别为粘质沙雷菌(Serratia marcescens)、粪产碱菌(Alcaligenes faecalis)、蜡样芽孢杆菌(Bacillus cereus)、奇异变形杆菌(Proteus mirabilis)与鲍氏不动杆菌(Acinetobacter baumannii)、屎肠球菌(Enterococcus faecium),其中,奇异变形杆菌首次报道存在于贵州纯种发酵细菌型水豆豉。证实纯种强化发酵水豆豉有条件致病菌污染,具有潜在的食品安全隐患,因此,在水豆豉发酵过程加强注意环境卫生、控制发酵条件可避免条件致病菌的产生。

