黄酒对小鼠肝脏功能及肠道菌群的影响
蒋丰岭,周玮忻,伍梓汐,程如越,沈 曦,李 鸣,张 明,陈历水,刘 蕾,何 方*
(1.四川大学华西公共卫生学院,四川成都 610041;2.北京工商大学食品与健康学院,北京 100048;3.中粮营养健康研究院食品研发中心,北京 100020)
研究表明,长期过量饮酒会导致肠道菌群紊乱,肝脏功能受损[3]。在酒精性肝硬化的患者肠道内,颤螺旋菌属[4-6]疣微菌属[4-5,7]等有益菌数量降低,而肠杆菌属等致病菌数量增多[4-7]。酒精及其分布在血液中的代谢物能够破坏肠粘膜屏障[8],增加肠道通透性,并且通过门静脉进入肝脏,对肝细胞造成直接损伤。与此同时,增加了肠源性有害物质如脂多糖(lipopolysaccharide,LPS)的量,激活受体产生炎性因子和趋化因子[9-16],在肝脏产生炎性反应造成肝脏损害。然而,适量饮酒能够减少机体炎症反应的发生,降低高血压、冠心病、动脉粥样硬化等疾病的发病风险[17],并且能够有效降低痴呆的发病风险[18]。有研究表明,黄酒的使用可以改善慢性应激大鼠肠道菌群的紊乱,增加乳酸菌等肠道益生菌的含量,并且减少致病菌或条件致病菌,有利于维持肠道微生态的平衡,对肠道微生物的组成具有一定的调控作用[19]。本研究旨在探究低浓度酒精以及同样酒精度的黄酒对小鼠肝脏和肠道功能的影响。
1 材料与方法
1.1 材料与试剂
黄酒(酒精度为19.55%vol):北京中粮集团有限公司,于4 ℃保存备用;血液生化指标谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)试剂盒:长春汇力生物技术有限公司;无水乙醇:上海国药集团化学试剂有限公司;粪便细菌总脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京天根生化科技北京有限公司;Phusion Hot start flex 2X Master Mix:NEB,M0536L;16S rRNA的V3-V4区引物(338F:5'-ACTCCTACGGGAGGCAGCAG-3' 和806R:5'-GGACTACHVGGGTWTCTAAT-3'):上海生工生物工程股份有限公司;Beckman Agencourt AMPure XP beads:美国Beckman公司;Qubit试剂盒:美国Invitrogen公司;VAHTSTMLibrary Quantification Kit for Illumina®:美国Kapa Biosciences公司。
实验动物:购于四川省医学科学院/四川省人民医院实验动物研究所[许可证号:SYXK(川)2013-15]的24只4周龄雄性昆明种小鼠,体质量为18~20 g。饲养于四川大学华西公共卫生学院动物实验中心,自由饮水饮食,标准环境喂养。
1.2 仪器与设备
Chemray 240全自动生化分析仪:深圳雷杜生命科技有限公司;752型紫外可见分光光度计:上海光谱仪器有限公司。
1.3 方法
1.3.1 实验动物处理
24只四周龄雄性昆明种小鼠随机分为3个组(对照组、酒精组、黄酒组),每组8只。对照组灌胃生理盐水;酒精组灌胃酒精,酒精绝对剂量根据中国居民膳食营养素参考摄入量(2013年版)成人(60 kg)的酒精每日最高摄入量(30 g)进行换算,为17.5 mg;黄酒绝对剂量以相同的方式进行换算,为89.51 mg。每只小鼠每天灌胃溶液量为0.2 mL,连续灌胃30 d。
1.3.2 脏器系数测定方法
使用电子天平测量肝脏的质量和小鼠体质量。脏器系数计算公式如下:

1.3.3 血液生化指标测定
根据试剂盒进行操作,采用全自动生化仪检测血清中肝脏功能相关指标ALT、AST的表达。
1.3.4 粪便DNA提取
收集小鼠粪便后,-80 ℃冻存。使用粪便细菌总DNA提取试剂盒提取DNA。每组小鼠所有收集到的粪便样品均匀混合成5个样,以反映所有受试小鼠的肠道菌群变化。
1.3.5 二代测序
二代测序由成都贝斯拜尔生物科技有限公司完成。引物5'末端添加特定的标记barcode和通用引物。在总体积为25 μL的聚合酶链式反应(polymerase chain reaction,PCR)反应体系中进行扩增。PCR体系中包含50 ng模板DNA,12.5 μL Phusion Hot start flex 2×Master Mix,2.5 μL正向引物338F 5'-ACTCCTACGGGAGGCAGCAG-3'和反向引物806R 5'-GGACTACHVGGGTWTCTAAT-3',用ddH2O调节体积。PCR条件为98 ℃初始变性30 s,在98 ℃进行35次变性10 s,在54 ℃退火30 s,在72 ℃延伸45 s,然后在72 ℃持续延伸10 min。PCR产物用2%琼脂糖凝胶电泳确认,用AMPure XT beads纯化,然后用Qubit试剂盒定量。制备扩增子池进行测序,并分别在Agilent 2100生物分析仪和Library Quantification试剂盒评估扩增子库的大小和数量。将PhiX Control library(v3)(Illumina)与扩增子文库(预期为30%)混合测序。通过Illumina MiSeq Instrument对使用标准Illumina测序引物的300 bp配对末端方案对文库进行测序。用bcl2fastq(v1.8.4)和FLASH 软件(v1.2.11)对原始测序数据进行预处理,利用QIIME v1.9.1进一步分析序列。首先,使用使用de novo Uchime(usearch v9.0.2132_i86linux32)筛选出良好序列。使用de novo UCLUST算法将最终的良好序列以97%的相似性聚类为可操作分类单(operational taxonomic units,OTU),使用Greengenes数据库(版本13.8)进行分类分配,使用PyNAST(v1.2.2)软件进行多序列比对,再用qiime脚本计算α-多样性指数(Ace、Chao1、Shannon、Simpson、PD_whole_ tree),使用Phyloseq package(v1.20.0)来分析β-多样性(unweighted UniFrac)。
1.3.6 统计学分析方法
使用Graphpad prism7.0统计软件对数据进行分析。对于服从正态分布的数据采用平均值±标准差(X±S)形式来表示数据结果,应用单因素方差分析对多组独立样本进行比较。对于不服从正态分布的数据使用[中位数(四分位数间距)的形式表示,利用Kruskal-Wallis非参数分析对多组独立样本进行比较。
2 结果与分析
2.1 体质量和脏器系数

表1 体质量和肝脏系数测定结果Table 1 Determination results of body mass and liver coefficient
由表1可知,在实验过程中,各组小鼠之间差异无统计学意义,各组小鼠之间肝脏系数差异无统计学意义(P>0.05)。结果显示,受试酒精和黄酒未显著地影响受试小鼠发育。
2.2 生化指标

表2 血液生化项目测定结果Table 2 Determination results of biochemical indicators of blood
由表2可知,黄酒组、酒精组小鼠ALT含量显著低于对照组(P<0.05)。三组间小鼠AST含量差异无统计学意义。但相对于对照组小鼠,酒精组和黄酒组AST含量有下降趋势,AST与ALT的比值有升高的趋势。ALT和AST是判断肝细胞受损的重要指标[20]。有文献指出,酒精性肝炎的患者AST和ALT均显著升高[21]。本研究为了探讨饮用酒精及含有相同酒精含量的黄酒对宿主肝脏功能的影响,按照中国居民膳食指南的受试酒精和黄酒酒精饮用标准投用受试小鼠,发现小鼠ALT显著降低,而小鼠AST也有降低的趋势。这些结果表明受试酒精浓度下的酒精和黄酒尚未造成受试小鼠肝功能的损伤,但长期投用可能会造成肝功能损伤。
2.3 二代测序
2.3.1α-多样性
由表3可知,Ace、Chao1以及PD_whole_tree指数显示的结果均为黄酒组显著低于对照组和酒精组。Shannon和Simpson结果显示三者之间差异无统计学意义。

表3 alpha多样性指数测定结果Table 3 Determination results of alpha-diversity indexes
2.3.2 肠道菌群群落组成

图1 门水平微生物群落组成情况Fig.1 Composition of microbial communities at the phylum level
图1和表4反映了门水平肠道菌群群落组成情况,拟杆菌门(Bacteroides)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、蓝菌门(Cyanobacteria)、放线菌门(Actinobacteria)为三组中相对丰度排前5位的优势菌。对照组Proteobacteria平均相对丰度高于酒精组和黄酒组,且具有统计学差异(P<0.05)。

图2 属水平微生物群落组成情况Fig.2 Composition of microbial communities at the genus level
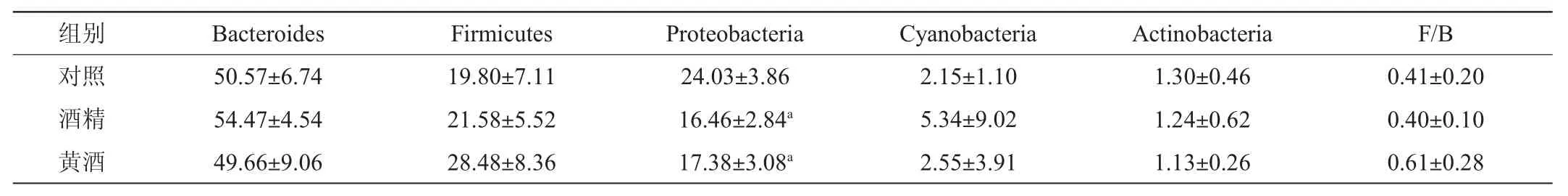
表4 门水平优势菌的平均相对丰度Table 4 Average relative abundance of dominant bacteria at the phylum level

表5 属水平优势菌的平均相对丰度Table 5 Average relative abundance of dominant bacteria at the genus level
图2和表5反映了属水平肠道菌群群落组成情况,颤螺菌属(Oscillospira)、普雷沃菌属([Prevotella])、拟杆菌属(Bacteroides)、普雷沃菌属(Prevotella)、臭杆菌属(Odoribacter)、瘤胃球菌属(Ruminococcus)、棒状杆菌属(Corynebacterium)、低嗜盐细菌属(Dehalobacterium)是三组中相对丰度在前8位的优势菌属。其中,黄酒组的Ruminococcus和[Prevotella]的相对丰度在三组中最高。对照组与酒精组Oscillospira、Ruminococcus的平均相对丰度上具有统计学差异,二者均为对照组低于酒精组(P<0.05)。对照组与黄酒组相比,Ruminococcus平均相对丰度水平低于黄酒组。从图2可以看出,黄酒组和酒精组中嗜单胞菌属(Stenotrophomonas)的含量明显减少。
图3为基于unweighted unifrac距离的主坐标轴分析,将影响群落构成的最主要的两个特征值作为横纵坐标,坐标轴中的每一个点代表一个样本,每种颜色代表同一组,当同种颜色的点距离越近,不同颜色的点距离越远时,代表组间菌群组成具有明显差异,且这种差异具有一定的稳定性。由图3可以看出,三组间菌落可以分开一定距离,说明三组间菌落组成具有一定差异。

图3 基于unweighted unifrac距离的主坐标轴分析Fig.3 Primary coordinate axis analysis based on unweighted unifrac distance
2.4 讨论
研究表明长期过量饮酒对肠道微生态具有不利影响[22]。人体摄入乙醇以后,在肠道中被肠道菌群代谢为乙醛。高浓度的乙醇和乙醛会损害肠道紧密连接,同时增加肠壁的通透性[23]。高浓度的乙醇会在机体内产生大量内毒素、引起肠道菌群的失调、造成肝脏损伤以及增加炎症反应[24]。本研究中,肠道菌群分析结果表明受试酒精浓度下的黄酒和酒精在一定程度上改变了受试小鼠的肠道细菌和种群结构。投用黄酒和酒精显著减少了Stenotrophomonas这种常见致病菌的比例[25]。黄酒组和酒精组的Ruminococcus的比例显著高于对照组(P<0.05),并且该菌属在黄酒组中的相对丰度还高于酒精组。Ruminococcus在人体内参与碳水化合物的水解,在结肠中发酵碳水化合物合成乙酸盐供机体使用,是人肠道内一种重要的益生菌[26]。黄酒组和酒精组Proteobacteria相对丰度显著低于对照组,Proteobacteria包括许多致病菌,其含量可以作为厌氧菌紊乱的一个指示,并且变形菌门的丰度升高与菌群失调相关[27]。另外,与对照组和酒精组相比,黄酒组中厚壁菌门/拟杆菌门的比值(F/B)有升高的趋势。F/B比值高的个体具有高的从食物中获取能量的能力[28]。沈赤等[29]研究发现,绍兴黄酒的多糖组分能促进小鼠肠道内双歧杆菌、乳杆菌等有益菌的增殖并且抑制肠杆菌、肠球菌和产气荚膜梭菌的增殖,同时增加小鼠肠道内的短链脂肪酸、乙酸、丁酸、乳酸含量的增加,发挥益生元作用。因此,推测黄酒对肠道菌群种群结构的调节作用可能与其含有的多糖成分有关。另外,黄酒组的肠道菌群的丰富度指数下降,但群落多样性指数并没有明显改变,表明本研究中所使用的黄酒浓度可能有一定的杀菌作用。王丽媛等[30]发现中剂量的黄酒可以提高高脂饮食小鼠的群落丰富度而对多样性指数无影响,但低剂量和高剂量对肠道菌群的丰富度和多样性均无影响。这些结果说明黄酒对肠道菌群多样性的影响与黄酒的饮用量和饮食情况密切相关。
从上述肠道菌群分析结果可知,适量的酒精以及相同酒精浓度下的黄酒并未使小鼠肠道菌群的优势菌群含量发生巨大变化,但在一定程度上减少了Stenotrophomonas、Proteobacteria等潜在致病菌的含量。此外,黄酒与酒精的摄入对肠道菌群多样性的影响略有不同,提示黄酒特有的物质可能会对机体产生额外的影响,其效应或许能在更高浓度的酒精摄入下进行观察。
3 结论
将24只4周龄雄性昆明种小鼠随机等分为3组,分别灌胃生理盐水、酒精、黄酒,连续灌胃30 d后,检测血液生化指标,二代测序检测粪便细菌的种群构成。结果表明,对照组小鼠血清中的ALT浓度显著高于酒精组和黄酒组(P<0.05)。黄酒组受试小鼠粪便细菌的三个α多样性指数Ace、Chao1、PD_whole_tree均显著低于对照组和酒精组(P<0.05)。三个组肠道菌群组成具有一定差异。门水平上,对照组Proteobacteria相对丰度显著高于酒精组和黄酒组(P<0.05);属水平上,对照组Ruminococcus相对丰度显著低于酒精组和黄酒组(P<0.05),而Stenotrophomonas相对丰度显著高于酒精组和黄酒组(P<0.05),对照组Oscillospira相对丰度显著低于酒精组(P<0.05)。表明低浓度酒精和同样酒精浓度下的黄酒并未对肝脏和肠道造成不利影响,并且都能在一定程度上抑制肠道致病菌的生长,增加部分有益菌的含量,从而对肠道菌群起到一定的调节作用。

