浓酱兼香型酒醅中乳酸菌的分离鉴定及布氏乳杆菌生长特性分析
张 松,缪礼鸿*,张明春,刘蒲临,廖卫芳
(1.武汉轻工大学生物与制药工程学院,湖北武汉 430023;2.湖北白云边酒业股份有限公司,湖北松滋 434200)
传统固态白酒发酵与酒醅中的优势微生物密切相关,白酒中的风味物质在很大程度上由其酿造的微生物所决定[1-6]。乳酸菌在白酒酿造过程中具有重要作用,其种类及动态变化对于白酒品质及产量具有重要影响[7-8]。通过对白酒酿造中的细菌群落结构分析发现,随着发酵轮次的增加,乳酸菌含量不断增加,往往是酒醅发酵后期的优势细菌[9-13]。在生产上通过调控乳酸菌的数量可以控制乳酸乙酯的含量,从而保证白酒的品质[14]。有研究表明,清香型和酱香型白酒发酵中优势乳酸菌的种类和含量均有不同,并通过可培养和未培养的方法确定了酱香型白酒中的主要乳酸菌是同型腐酒乳杆菌(Lactobacillus homohiochii)和布氏乳杆菌(Lactobacillus buchneri)[15-16]。
布氏乳杆菌(L.buchneri)常见于畜牧行业饲用菌的相关报道,具有增加青贮饲料有氧稳定性的作用[17-20]。同时,布氏乳杆菌(L.buchneri)还具有产细菌素的能力,能明显抑制某些细菌等微生物的生长,并可促进酿酒酵母(Saccharomyces cerevisiae)、拜耳结合酵母(Saccharomyces baillii)等白酒酿造中优势酵母菌的生长[21-25]。
本研究对浓酱兼香型酒醅中的乳酸菌进行分离鉴定,并对分离自不同轮次酒醅的多株L.buchneri的耐酸、耐乙醇、耐高温等能力及液态发酵产物进行比较分析,旨在为揭示白酒相关发酵机理和功能菌种选育提供基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
浓酱兼香型酒醅样品:采自湖北白云边酒业股份有限公司酿酒车间(第三轮次、第四轮次、第五轮次和第六轮次),各轮次的入池和出池酒醅样品采集数量均为2份,各酒醅样品pH值在3.2~4.5之间。
1.1.2 化学试剂
溶菌酶(20 000 U/mg):盖云天(武汉)生物技术有限公司;Ezup柱式细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)引物:生工生物工程(上海)股份有限公司;脱氧核糖核苷三磷酸(deoxy-ribonucleosidetriphosphate,dNTP)、DNA聚合酶(5 U/μL):宝生物工程(大连)有限公司;蛋白胨、酵母浸粉、牛肉膏(均为生化试剂):安琪酵母有限公司;葡萄糖、吐温80、磷酸氢二钾、无水乙酸钠、乙酸、柠檬酸氢二铵、七水硫酸镁、一水硫酸锰(均为分析纯):国药集团化学试剂有限公司;乙酸乙酯、正丙醇、叔戊醇(均为色谱纯):美国Sigma-Aldrich公司。
1.1.3 培养基
MRS液体培养基[26]:牛肉膏10 g、蛋白胨10 g、酵母浸粉5 g、葡萄糖5 g、无水乙酸钠5 g、磷酸氢二钾2 g、柠檬酸氢二铵2 g、吐温-80 1 mL、七水硫酸镁0.2 g、一水硫酸锰0.05 g、蒸馏水1 000 mL,pH值调至6.5~6.8,分装灭菌,115 ℃高压灭菌30 min。
MRS固体培养基:在MRS液体培养基中加入琼脂粉20 g,115 ℃高压灭菌30 min。
改良MRS固体培养基[27]:在MRS固体培养基中添加1.5%的CaCO3。
酸度耐受性培养基:在MRS液体培养基的基础上,使用乙酸-乳酸(1∶1,V/V)混合酸调整其pH值分别为3.5、4.0、4.5、5.0、5.5、6.5。
乙醇耐受性培养基:在MRS液体培养基的基础上,按体积分数分别加入2%、4%、6%、8%、10%的无水乙醇。
1.2 仪器与设备
ECLIPSE80i相差显微镜:日本Nikon公司;ZHJH-C1115B超净工作台、ZXDP-A2160全自动新型电热培养箱:上海智城分析仪器制造有限公司;T3000PCR仪:德国Biometra公司;SYDR/1305凝胶成像仪:美国Syngene公司;UV-5900PC紫外可见分光光度计:上海元析仪器有限公司;YXQ-LS-50Sll立式压力蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂;7890A气相色谱(gas chromatography,GC)仪、1260c高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦科技有限公司。
1.3 方法
1.3.1 浓酱兼香型酒醅乳酸菌的分离[28]
称取不同轮次酒醅样品10g,加入90mL无菌水中,30℃、170 r/min摇床振荡0.5 h,经系列稀释后,取适当稀释度的菌液各1 mL涂布于MRS固体培养基上,封口,置于30 ℃恒温培养箱72 h静置培养。待乳酸菌长出后,随机挑取形态不同的单菌落,在改良MRS固体培养基上划线分离纯化2~3次,挑取产生透明圈的单菌落于MRS液体培养基中,30 ℃静置培养48 h,进行革兰氏染色和过硫化氢实验,将革兰氏染色呈阳性且过硫化氢实验呈阴性的菌株初步确定为乳酸菌。分离乳酸菌时MRS培养基中均添加100 U/mL制霉菌素,以抑制酒醅中酵母菌的生长。
1.3.2 浓酱兼香型酒醅乳酸菌的分子生物学鉴定
挑取纯化后的乳酸菌单菌落接种于MRS液体培养基中,30 ℃、静置培养48 h,用Ezup柱式细菌基因组DNA抽提试剂盒提取DNA,完成后置于-20 ℃冰箱中保存备用。以分离菌株的基因组DNA为模板,采用乳酸菌16S rDNA通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')与1492R(5'-TA-CGGTTACCTTGTTACGACTT-3')对其16S rDNA进行PCR扩增。PCR扩增体系:2×PowerTaqMaserMix 25 μL,DNA模板1 μL,引物27F和1492R各1 μL,双蒸水(ddH2O)22 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性50 s,54 ℃退火50 s,72 ℃延伸90 s,30个循环;72 ℃再延伸10 min[24]。取5 μL PCR扩增产物,利用0.8%琼脂糖凝胶电泳检测。取1 400 bp左右的16S rDNA PCR扩增产物送至生工生物工程(上海)股份有限公司测序。采DNAStar软件对测序结果进行人工校对。校正以后的序列提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行BLAST同源序列搜索,比较测试菌株和已知乳酸菌菌株之间的亲缘关系及其系统地位。根据同源序列搜索结果,用DNAMAN6.0校准排齐序列,采用MEGA5.2软件中的邻接(neighbor-joining,NJ)法,1 000次Bootstrap检验构建系统发育树[29]。
1.3.3 不同轮次布氏乳杆菌生长特性的测定
耐酸能力的测定:挑取布氏乳杆菌单菌落接种于MRS液体培养基,装液量20 mL/25 mL,30 ℃静置培养48 h,进行活化。按1%(V/V)的接种量接种于MRS液体培养基,装液量20 mL/25 mL,30 ℃静置培养24 h,作为种子液。将种子液按1%(V/V)的接种量分别接种到不同pH值(3.5、4.0、4.5、5.0、5.5、6.5)的MRS液体培养基中,装液量20 mL/25 mL,30 ℃静置培养48 h,将菌液稀释一定倍数,采用紫外分光光度计测菌液的OD600nm值。
耐乙醇能力的测定:将布氏乳杆菌种子液按1%(V/V)的接种量分别接种于含不同乙醇体积分数(0%、2%、4%、6%、8%、10%、12%)的MRS液体培养基中,装液量20 mL/25 mL,30 ℃静置培养48 h,将菌液稀释一定倍数,采用紫外分光光度计测菌液的OD600nm值。
耐高温能力的测定:将布氏乳杆菌种子液按1%(V/V)的接种量接种于MRS液体培养基中,装液量20 mL/25 mL,分别在37 ℃、41 ℃、45 ℃、50 ℃条件下,静置培养48 h,将菌液稀释一定倍数,采用紫外分光光度计测菌液的OD600nm值。
1.3.4 不同布氏乳杆菌株液体发酵实验
将布氏乳杆菌种子液按2%(V/V)的接种量接种于200mL MRS液体培养基,摇匀,用无菌不透气保鲜膜封口,密闭,28 ℃恒温静置发酵3 d。发酵结束后,将发酵液过膜处理,采用高效液相色谱分析发酵产物差异。
1.3.5 发酵产物中有机酸的测定
取布氏乳杆菌发酵液,涡旋振荡混匀,直接用5 mL的注射器(不带针头)取不同菌株发酵液5 mL,先用0.45 μm有机滤膜初步过滤,再用0.22 μm有机滤膜注入2 mL的液相进样瓶中,每一个处理条件平行三次。采用高效液相色谱法检测有机酸[30],HPLC条件:Bio-RadAminexHPX-87H色谱柱(300 mm×7.8 mm×9 μm),柱温30 ℃,检测器二极管阵列紫外-可见光检测器,检测波长210 nm,流速0.6 mL/min,进样量10 μL,流动相为4 mmol/L硫酸溶液。
1.3.6 数据处理
通过SPSS22.0软件分析不同样本间是否存在显著性差异,对数据进行单因素方差分析,使用Tukey方法,假设样本间方差相等,若Tukey HSD检验P>0.05则无显著性差异;0.01<P<0.05则差异显著;P<0.01则差异极显著。
2 结果与分析
2.1 浓酱兼香型不同轮次酒醅中乳酸菌的分离鉴定
采用稀释平板分离法从浓酱兼香型不同轮次酒醅中共分离获得30株乳酸菌,编号分别为ZS-B1~ZS-B21、ZS~Z4、ZS-RSP1、ZS-RSP2、ZS-WT1、ZS-WT2、ZS-FC1。采用MEGA5.2软件中的邻接法构建系统发育树,结果见图1。
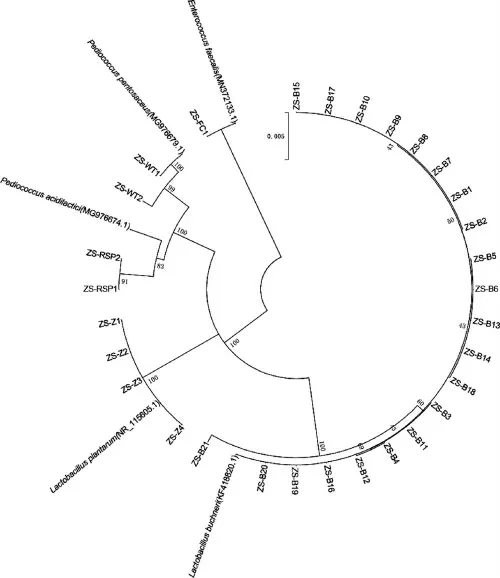
图1 基于16S rDNA序列不同轮次酒醅分离乳酸菌的系统发育树Fig.1 Phylogenetic tree of lactic acid bacteria isolated from different rounds of fermented grains based on 16S rDNA sequences
由图1可知,30株分离的乳酸菌分属于3个属共5个种,其中,布氏乳杆菌(Lactobacillus buchneri)21株,植物乳杆菌(Lactobacillus plantarum)4株,粪肠球菌(Enterococcusfaecalis)1株,乳酸片球菌(Pediococcus acidilactici)2株,戊糖片球菌(Pediococcus pentosaceus)2株,说明从不同轮次酒醅中分离的乳酸菌主要为布氏乳杆菌(L.buchneri),约占总分离菌株数的70%,其具体菌株编号及来源酒醅信息见表1。

表1 21株布氏乳杆菌分离材料来源信息Table 1 Source information of isolation material of 21 strains of Lactobacillus buchneri
由表1可知,21株布氏乳杆菌(Lactobacillus buchneri)中,第三和第四轮次出池酒醅中分离的L.buchneri菌株数较多,分别为6株、5株。与浓酱兼香型高温大曲中分离的乳酸菌比较,从酒醅中分离的这3个属的乳酸菌均在大曲中出现,但优势菌种明显不同[31],这与酒醅发酵与制曲发酵环境条件有明显差异有关。
2.2 不同布氏乳杆菌株生长特性研究结果
2.2.1 不同布氏乳杆菌株耐酸能力的测定结果
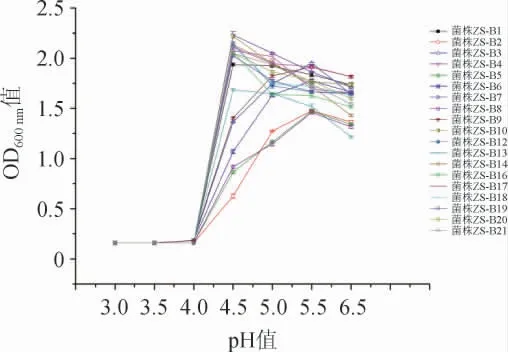
图2 不同布氏乳杆菌株耐酸能力比较Fig.2 Comparison of acid tolerance of different strains of Lactobacillus buchneri
由于菌株ZS-B11和菌株ZS-B15生长过于缓慢,不符合实验室应用标准,故除去。由图2可知,各菌株的最适生长pH范围在4.5~5.5之间;当培养基pH值<4.5之前,L.buchneri生长会受到明显抑制;当培养基pH值进一步降低至4.0时,绝大多数菌株不能生长,部分L.buchneri菌株间耐酸能力也存在差异(P<0.05)。结果显示,菌株ZS-B3、ZS-B9在pH4.0时能微弱生长,而其他菌株均停止生长;菌株ZS-B2、ZS-B5和ZS-B8在培养基pH4.5和pH5.0时,菌液OD600nm值在0.6~1.1之间,生长明显低于其他菌株;耐酸能力较好的菌株共11株,最适pH值均在4.5左右,分别是菌株ZS-B19、ZS-B16、ZS-B20、ZS-B21、ZS-B17、ZS-B4、ZS-B14、ZS-B18、ZS-B12、ZS-B10、ZS-B7;其中菌株ZS-B10不仅耐酸能力好,菌株生长能力较好,pH4.5时其OD600nm值可以达到2.23。
2.2.2 不同布氏乳杆菌株耐乙醇能力的测定结果
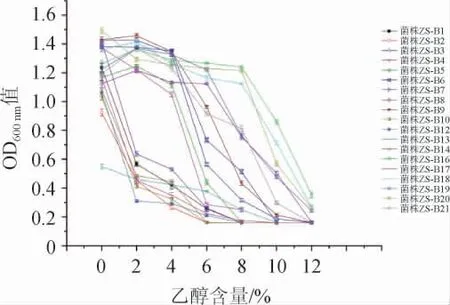
图3 不同布氏乳杆菌株耐乙醇能力比较Fig.3 Comparison of ethanol tolerance of different strains of Lactobacillus buchneri
由图3可知,不同L.buchneri菌株间耐乙醇能力存在显著性差异(P<0.05)。与未添加乙醇组比较,2%乙醇组明显抑制菌株ZS-B12、ZS-B10、ZS-B17、ZS-B2、ZS-B13、ZS-B14、ZS-B1、ZS-B7的生长,但所测试菌株抑制效果强弱存在差异。初始培养基中含6%乙醇时,部分L.buchneri菌液的OD600nm值已经<0.5,但菌株ZS-B6、ZS-B21、ZS-B9、ZS-B8、ZS-B18、ZS-B19、ZS-B20、ZS-B16这8株L.buchneri菌液的OD600nm值仍能达到0.7以上。当培养基中乙醇添加到8%时,菌株ZS-B10、ZS-B2、ZS-B14、ZS-B12、ZS-B1、ZS-B7、ZS-B5、ZS-B17几乎停止生长,有少数L.buchner有微弱的生长,但菌株ZS-B8、ZS-B19、ZS-B21、ZS-B18、ZS-B20、ZS-B16这8株菌液的OD600nm值仍能达到0.7。当培养基中添加10%乙醇时,大多数L.buchner完全受到抑制,仅有菌株ZS-B18、ZS-B16生长良好,菌液OD600nm值达到0.7左右。当培养基中乙醇含量达到12%时,菌株ZS-B18、ZS-B16生长也受到明显抑制,几乎不能生长。经过对比,有3株布氏乳杆菌耐乙醇能力较好,分别是菌株ZS-B20、ZS-B18、ZS-B16,它们的最大耐乙醇含量可以达到10%。由图3亦可知,其中部分L.buchneri出现了添加少量乙醇(2%)反而比不添加乙醇的培养基生长状况好的情况。
2.2.3 不同布氏乳杆菌株耐高温能力测定结果
由图4可知,当培养温度为37 ℃时,19株L.buchneri生长较好,菌液OD600nm值在1.5~2.1之间;当培养温度为41 ℃时,菌液OD600nm值在1.1~1.7之间,说明L.buchneri生长受到一定的抑制;当培养温度提升至45 ℃时,L.buchneri菌液的OD600nm值均<0.4,其中菌株ZS-B20、ZS-B17、ZS-B14、ZS-B16有微弱生长,具有一定的耐高温生长能力,其余菌株几乎不生长;当培养温度进一步提升至50 ℃,所有菌株均停止生长。
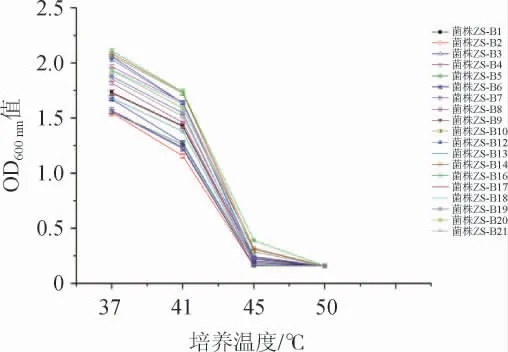
图4 不同布氏乳杆菌株耐高温能力比较Fig.4 Comparison of high temperature tolerance of different strains of Lactobacillus buchneri
2.3 不同布氏乳杆菌株液体发酵产有机酸能力的测定结果
以植物乳杆菌(Lactobacillus plantarum)ZR1为对照,探究6株L.buchneri代表菌株纯菌种液体发酵产有机酸能力,其中3株L.buchneri为综合耐受性较差菌株(ZS-4、ZS-B7和ZS-B8),3株为综合耐受性优良菌株(ZS-16、ZS-B18和ZS-B21)。由表2可知,6株L.buchneri在发酵产柠檬酸方面相较于植物乳杆菌(L.plantarum)ZR1存在很大差异。6株L.buchneri的柠檬酸平均产量为3.761 g/L,而L.plantarum的柠檬酸产量只有0.338 g/L,L.buchneri柠檬酸产量是L.plantarum的11.13倍。6株L.buchneri与L.plantarum间柠檬酸产量存在极显著差异(P<0.01)。对6株L.buchneri间的柠檬酸产量进行显著性差异分析,得出菌株ZS-B16与ZS-B4、ZS-B8、ZS-B21间的柠檬酸产量也存在显著性差异(P<0.05)。由于MRS培养基本身含有2 g/L的柠檬酸氢二铵,造成布氏乳杆菌与植物乳杆菌发酵液中柠檬酸含量的差异主要是由于布氏乳杆菌具有合成柠檬酸的能力,还是由于布氏乳杆菌只能利用柠檬酸氢二铵中的铵盐而不能利用柠檬酸根导致柠檬酸的积累所致尚不清楚,其机理有待进一步研究。
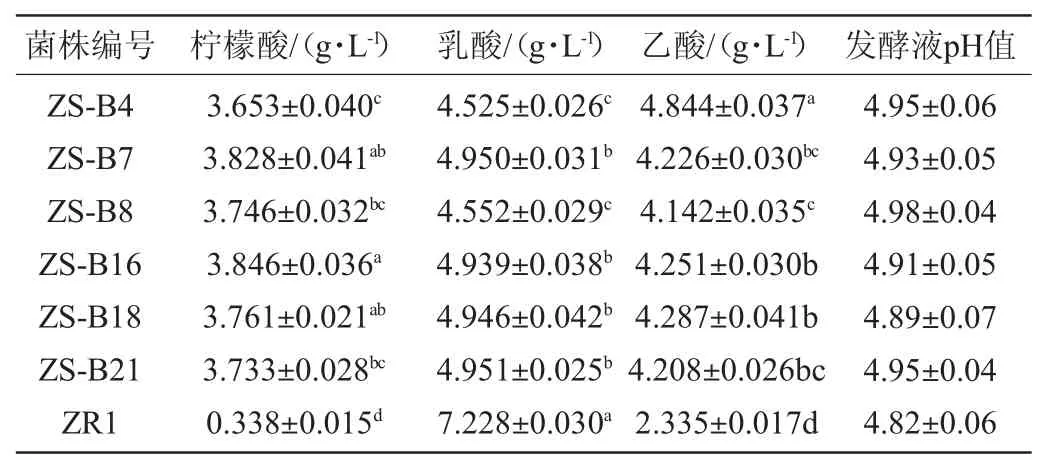
表2 7株乳酸菌发酵液有机酸分析结果Table 2 Analysis results of organic acid in fermentation broth of 7 strains of lactic acid bacteria
L.plantarumZR1的乳酸产量为7.228 g/L,而6株L.buch-neri的乳酸平均产量为4.810 g/L,前者的乳酸产量是后者的1.50倍。在产乙酸方面,6株L.buchneri相较于L.plantarum也存在显著差异(P<0.01)。6株L.buchneri的乙酸平均产量在4.222 g/L,L.plantarum的乙酸产量为2.335 g/L,L.buchneri的乙酸产量是L.plantarum的1.80倍。分析其原因,主要是由于L.plantarum属同型乳酸发酵,而L.buchneri属异型乳酸发酵乳酸菌,在发酵生成乳酸的同时还会生成少量的乙酸、CO2等物质[32]。
3 结论
本研究从浓酱兼香型不同轮次的酒醅中共分离到30株乳酸菌,归属于3个属共5个种,分别为布氏乳杆菌、植物乳杆菌、粪肠球菌、乳酸片球菌和戊糖片球菌,其中布氏乳杆菌(L.buchneri)最多,为21株,占总分离菌株数的70%,是第三、第四轮出池酒醅中的优势乳酸菌。
不同轮次酒醅中分离的19株L.buchneri的耐酸、耐乙醇和耐高温生长能力存在一定差异,最适生长pH值大多在4.5左右,其中,菌株ZS-B3、ZS-B9和ZS-B10耐酸性较好,pH 4.0条件下培养48 h后,OD600nm值可以达到0.2;对乙醇的耐受能力在2%~10%之间,约有50%的菌株乙醇耐受能力达到6%,其中菌株ZS-B18和ZS-B16乙醇耐受能力最强,在含10%乙醇的MRS液体培养基中培养48 h后,OD600nm值仍能达到0.7;最适生长温度均为37 ℃,在41 ℃条件下,L.buchneri生长均受到抑制,当温度升高到45℃时,所有菌株均停止生长。
6株布氏乳杆菌代表菌株表现出了较强的发酵产柠檬酸和乙酸的能力。其平均柠檬酸产量为3.761 g/L,平均乙酸产量为4.222 g/L,分别是L.plantarumZR1的11.13倍和1.80倍。柠檬酸是良好的食物酸味剂,具有抗氧化、增加酸味、抑制细菌等作用。传统固态发酵白酒中主要呈香物质乙酸乙酯的形成又与乙酸有直接相关。对布氏乳杆菌在白酒发酵系统中的存在状态及其功能进行研究,对于调控白酒中柠檬酸和乙酸乙酯含量具有一定的指导意义。

