新型冠状病毒实时荧光RT-PCR检测的性能验证
何吕芬 李沙 利振坤 李欢 王立程 符晓莹 黎元莉 陈海 陈少金 朱雄
2019年12月以来,湖北省武汉市陆续发现多起新型冠状病毒[后来更新为严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)]感染后引起新型冠状病毒肺炎(coronavirus disease2019,COVID-19)的病例,随后疫情迅速蔓延至全国各省市。SARSCoV-2属于β属冠状病毒,有包膜,颗粒呈圆形或椭圆形,常为多形性,直径60~140 nm。其基因特征与严重急性呼吸系统综合征冠状病毒(Severe Acute Respiratory Syndrome Coronavirus,SARSCoV)和中东呼吸综合征冠状病毒(Middle East Respiratory Syndrome Coronavirus,MERS-CoV)有明显区别。目前研究显示SARS-CoV-2与蝙蝠SARS样冠状病毒(bat-SL-COVZC45)同源性达85%以上[1]。该病作为急性呼吸道传染病已纳入《中华人民共和国传染病防治法》规定的乙类传染病,按甲类管理。随着对疾病认识的不断深入,我国先后发布了《新型冠状病毒感染的肺炎诊疗方案》及《新型冠状病毒感染的肺炎防控方案》等规范性文件,并已进行了多次更新[2-3]。
病原学检测是诊断COVID-19的金标准。由于病毒测序技术对人员、设备要求较高[4],因此采用RT-PCR技术检测核酸是目前确诊SARS-CoV-2最为广泛的方法。ISO15189是国际医学界普遍承认并遵照执行的关于医学实验室质量和能力方面要求的国际标准。2019年2月15日最新发布的CNAS-GL039[5]文件由中国合格评定国家认可委员会制定,是对CNAS-CL02:2012《医学实验室质量管理和能力认可准则在分子诊断领域的应用说明》中有关分子诊断相关检验程序进行性能验证实验所做的具体解释和指导。
1 材料与方法
1.1 临床样本
选取2020年1月25日至2020年2月24日在三亚市人民医院检测的SARS-CoV-2核酸阳性和阴性样本所有患者均已鉴知情同意书及通过医院伦理委员会。
1.2 试剂与仪器
核酸提取或纯化试剂盒(批号:2019004)、2019新型冠状病毒(ORF1ab/N)核酸检测试剂盒(批号:20200123)、DA3200核酸提取仪,均购自中山大学达安基因股份有限公司;ABI 7500型PCR仪购自美国Thermo Fisher Scientific。
1.3 检测方法
按试剂盒说明书操作,扩增反应条件为:50℃15 min;95℃15 min;94℃15 s;55℃45 s;共45个循环,在55℃采集荧光信号。
1.4 判断标准
根据试剂盒要求,结果判断标准如下:①如果检测样本在ORF1ab和N基因通道无扩增曲线或Ct值>38,判为SARS-CoV-2阴性;②如果检测样品在ORF1ab和N基因通道Ct值≤38,且有明显的扩增曲线,判为SARS-CoV-2阳性;③如果检测样品在ORF1ab或者N基因通道Ct值≤38,另一通道无扩增曲线,建议复检,复检结果与原结果一致,判为SARS-CoV-2阳性。
1.5 性能验证方法及指标
1.5.1 精密度评估
选取4例咽拭子,其中SARS-CoV-2核酸阳性3例(S1、S2、S3),阴性1例(S4)。批内精密度试验,在同一批试验中重复检测20次;批间精密度试验,重复测定5次,连续测定4 d,共计测定20次。要求变异系数(CV)≤5%,阴阳性符合率均>95%,则精密度符合要求。
1.5.2 准确度评估
选取经海南省COVID-19诊断专家组确诊为COVID-19患者的咽拭子10例和三亚市疾控中心已确认的5例咽拭子(SARS-CoV-2阳性3例、阴性2例)进行检测,分析结果的一致程度,阴阳性符合率>95%,则准确度符合要求。
1.5.3 最低检测下限评估
将1例SARS-CoV-2核酸浓度为2.33×106copies/mL的咽拭子样本分别稀释为1×106、1×105、1×104、1×103、1×102copies/mL,核酸提取后,进行双重实时荧光RT-PCR反应体系的灵敏度测试,初步测试该方法的灵敏度范围,再进一步各进行10个重复测试确定最低检测下限,计算各浓度检出率,100%检出率的最小值为检测下限。
1.5.4 特异性评估
将冠状病毒(OC43、NL63、229E、HKU1)、甲型流感病毒、乙型流感病毒、肺炎链球菌、结核分枝杆菌、金黄色葡萄球菌、白色念珠菌、人巨细胞病毒、MERS冠状病毒样颗粒、SARS冠状病毒样颗粒分别加入到SARS-CoV-2阴性的咽拭子样本中,同时各以1例阴性和阳性样本为阴阳性对照,各重复检测3次。可接受性能标准:不应出现阳性扩增曲线或Ct值。
1.5.5 内源性干扰评估
选取1例SARS-CoV-2核酸阳性的咽拭子样本分成4份,各200μL,每份样本加入正常人红细胞0、6、10、12μL,红细胞浓度分别是0%、3%、5%、6%,提取核酸后进行复孔扩增,重复5次,要求变异度(CV)≤5%,并评判符合性。
1.6 统计学方法
采用Excel和SPSS 19.0统计软件进行数据分析,计算计量资料的均数、方差、标准差和CV值。
2 结果
2.1 精密度验证
批内精密度试验中,SARS-CoV-2样本阳性3例(S1、S2、S3),重复测定20次,ORF1ab基因通道的Ct值的平均值分别是23.19、30.06、33.87,其变异系数CV分别是1.21%、1.52%、1.49%;N基因通道的Ct值的平均值分别是23.19、29.07、33.11,其变异系数CV分别是1.34%、1.54%、1.46%。批间精密度试验中,SARS-CoV-2样本阳性3例(S1、S2、S3),重复测定5次,连续测定4 d,ORF1ab基因通道的Ct值的平均值分别是23.30、30.01、33.98,其变异系数CV分别是2.05%、1.97%、2.05%;N基因通道的Ct值的平均值分别是23.16、28.96、33.07,其变异系数CV分别是2.09%、1.92%、1.91%。精密度试验的阴性、阳性符合率均为100%,所有通道的Ct值的变异系数CV<5%,精密度符合性能验证标准。
2.2 准确性验证
15例样本进行检测结果显示:13例为SARS-CoV-2阳性,ORF1ab基因通道的Ct值为22.40~35.62,N基因通道的Ct值为21.31~37.25,Ct值均<38,且有明显的扩增曲线;2例阴性,在ORF1ab和N基因通道均无扩增曲线。与海南省COVID-19诊断专家组和三亚市疾控中心的结果一致,阳性和阴性样本符合率均为100%,其准确性符合性能验证标准。
2.3 最低检测下限
浓度为10倍差梯度(1×106~1×103copies/mL)的SARS-CoV-2样本,ORF1ab和N基因检测通道均有明显扩增曲线,且Ct值均<38;1×102copies/mL SARS-CoV-2样本,双基因通道虽然存在荧光信号和扩增曲线,但ORF1ab和N基因Ct值分别是:38.23、40.75,见图1。因此,采用浓度为1×103、5×102、2×102copies/mL的SARS-CoV-2样本,各重复测试10次。1×103copies/mL SARS-CoV-2样本双基因通道的Ct值均<38,检出率均为100%,见图2;5×102copies/mL SARS-CoV-2样本双基因通道虽然存在荧光信号和扩增曲线,但ORF1ab和N基因检出率分别是90%、80%。见图3。
2.4 特异性验证
除SARS-CoV-2阳性样本有扩增曲线外,其它均无扩增曲线,表明该检测体系具有较好的特异性,见图4。
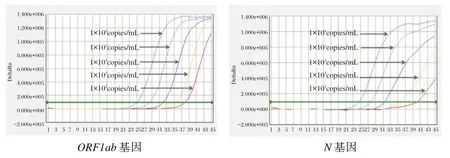
图1 双重实时荧光RT-PCR体系灵敏度测试扩增曲线Figure 1 Amplification curves of dual real-time fluorescent RT-PCRsystem sensitivity

图2 1×103 copies/mL SARS-CoV-2样本双重实时荧光RT-PCR扩增曲线Figure 2 Dual real-time fluorescence RT-PCRamplification curves of 1×103 copies/mL SARS-CoV-2 samples
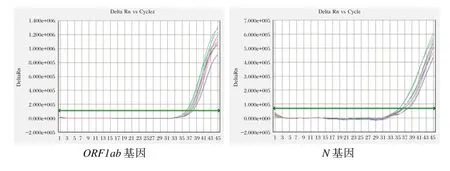
图3 5×102 copies/mL SARS-CoV-2样本双重实时荧光RT-PCR扩增曲线Figure 3 Dual real-time fluorescence RT-PCR amplification curves of 5×102 copies/mL SARS-CoV-2 nucleic samples
2.5 内源性干扰
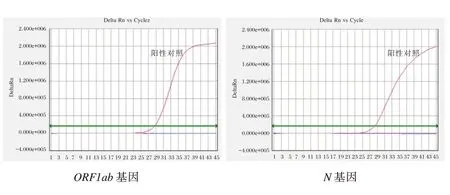
图4 双重实时荧光RT-PCR反应特异性扩增曲线Figure 4 Amplification curves of dual real-time fluorescent RT-PCR reaction specificity
红细胞浓度分别为0%、3%、5%、6%的SARSCoV-2的阳性样本,复孔扩增,重复5次,ORF1ab基因通道的Ct值的平均值分别是32.10、33.44、32.94、30.68,其变异系数CV分别是1.37%、2.57%、2.29%、2.00%;N基因通道的Ct值的平均值分别是30.81、32.03、31.56、29.18,其变异系数CV分别是1.03%、2.72%、2.05%、0.88%。所有通道Ct值的变异系数CV<5%,符合率均为100%,表明不存在明显的内源性干扰,验证结果通过。
3 讨论
分子生物学方法敏感性高,特异性强,已逐渐成为病毒检测的主要方法。RT-PCR是最常用的分子生物学检测方法之一,广泛应用于临床疾病的诊断、疗效评估和预后检测[6-8]。依据ISO15189和CNAS-GL039性能评价,新试剂和新项目应用于临床检测前必须对其检测体系进行严格的方法学评价和性能验证,定性项目至少对准确度、检测下限、特异性及抗干扰能力进行验证。
检测系统良好的精密度是进行其他方法学验证实验的前提[9-10]。本研究结果显示,精密度试验的阴性和阳性符合率均为100%,ORF1ab和N基因通道的Ct值的CV值均小于5%,表明试剂盒重复性高,随机误差小。内源性抗干扰能力CV值均小于5%,表明试剂盒抗干扰能力良好。与冠状病毒(OC43、NL63、229E、HKU1)、甲型流感病毒、乙型流感病毒、肺炎链球菌、结核分枝杆菌、金黄色葡萄球菌、白色念珠菌、人巨细胞病毒等无交叉反应,因条件限制,未能获取MERS-CoV和SARS-CoV,使用MERS和SARS冠状病毒样颗粒进行实验,尚不能说明与MERS-CoV和SARS-CoV无交叉反应,但试剂厂家前期的研发结果显示:与MERS-CoV和SARS-CoV无交叉反应。因此,RT-PCR检测方法灵敏度高,重复性好,抗干扰力强,检测下限和特异性均符合要求,可用于临床检测。
SARS-CoV-2核酸结果受多因素影响,如采样标本是否合格、操作是否规范、检测试剂盒本身敏感性等问题,临床上若出现鼻、咽拭子阴性而流行病学史、症状或影像学表现高度疑似COVID-19的患者,建议同时采下呼吸道样本进行核酸检测,选择不同的检测试剂,或者增加检测次数[11-12]。
综上所述,本研究依据ISO 15189和CNASGL039文件,对SARS-CoV-2核酸检测试剂盒进行性能验证,严把质量控制关,有助于规范SARSCoV-2实时荧光RT-PCR检测的实验室质量管理,提高SARS-CoV-2检测结果的可靠性、稳定性和准确性。

