EDA基因外显子缺失所致外胚层发育不良家系的基因型研究及产前诊断
丁红珂 余丽华 曾玉坤 刘玲 尹爱华 卢建 张彦 兰菲菲
外胚层发育不良(Ectodermal dysplasia,EDs)是一种遗传性人类疾病,会影响外胚层起源的结构,是一组临床和先天异质性的疾病,其特征是两个或两个以上的外胚层结构发育障碍,包括头发、牙齿、指甲或汗腺的异常,这类疾病降低了患者的生活质量。还有其他外胚层结构可能与EDs有关,如乳腺、甲状腺、胸腺、垂体前叶,肾上腺髓质,中枢神经系统,黑色素细胞,外耳,泪腺和导管,结膜,角膜和睑板腺[1]。研究报道的已有200多种EDs类型[1-2],最常见的表型是无汗或少汗型外胚层发育不良(HED/EDA)。尽管存在常染色体隐性和显性形式,但X连锁隐性遗传是该病最常见的遗传方式,在普通人群中,每17 000个新生儿中就有一个患有此病[3]。
EDA基因(OMIM ID:300451)是X-连锁少汗型外胚层发育不良1型(OMIM ID:305100,中文名称来源于CHPO数据库:http://chinahpo.org/)的主要致病基因。人类EDA基因有5种转录本,其中最长的转录本编码由391个氨基酸组成的跨膜蛋白,其余4个转录本,编码缺少胶原结构域的截短蛋白[4]。Kere等报道了EDA1基因的定位克隆,他们从一个成年人的汗腺cDNA文库中鉴定出一个代表全长转录本的cDNA,该转录本由2个外显子组成。推测基因产物是135个残基的蛋白质,预计包含一个跨膜结构域。该基因表达于角质形成细胞、毛囊、汗腺,表达的EDA1蛋白通过EDA受体在皮肤附件的形成过程中起至关重要的作用。Kere等还在几例EDA患者中,发现了EDA1基因的缺失和突变[5]。Srivastava等克隆了小鼠的“Tabby”(Ta)基因,并鉴定出3种不同的转录亚型,分别编码391、177和220个氨基酸。所有转录本都具有共同的第1外显子,与人EDA的前132个氨基酸显示88%的同源性[6],这提示第1外显子对于野生蛋白功能的发挥具有中重要作用。本文通过先证者家系致病基因的检测和缺失断裂位点的验证及胎儿的产前诊断,为先证者母亲生育健康孩子提供遗传咨询。
1 材料与方法
1.1 研究对象
患儿,男,13岁,足月顺产,临床表现为皮肤干燥,少汗(脚底可少量出汗),毛发稀少(无眉毛,睫毛稀少),牙齿发育不良(共出牙4颗),具有外胚层发育不良的特殊面容。患儿母亲孕3产3,曾生育一名男婴出生后不明原因夭折。患儿母亲未见明显异常。
1.2 标本采集
经签署知情同意书及广东省妇幼保健院医学伦理委员会审批,采集先证者及其父母外周血2 mL(EDTA抗凝)进行相关分子遗传学检测。经过知情同意,母亲于孕13周时在超声引导下进行绒毛穿刺抽取术抽取胎儿绒毛。使用德国Qiagen公司生产的Qiamp DNA Blood Mini Kit提取剂盒进行基因组DNA提取。
1.3 方法
1.3.1 高通量测序
先证者DNA进行与外胚层发育不良的相关基因高通量测序,由广州嘉检医学检测公司完成。高通量测序结果分析包含相 关的EDA、EDAR、ABCC9、DSP、EVC2等38个基因,630个编码区,99 981个碱基,平均覆盖深度183+/-89×,大于10×覆盖区间占99.4%,大于20×覆盖区间占98.9%。参考序列版本号:GRCh37/hg19。
1.3.2 高通量测序CNV计算
使用CASAVA v1.7(美国,Illumina公司)软件将原始图像转换为碱基序列并按样本特异的DNA条码进行拆分。拆分后的序列数据由NextGENe软件(SoftGenetics,State College,PA)进一步处理进行比对。删除低质量的reads(Phred分数<Q25)。每个外显子的平均覆盖率使用特定捕获基因的bed文件数据中提取。通过分析检测到的可能具有拷贝数变化的外显子会被自动描绘出来,以供进一步验证。检测CNV的脚本存放于https://sourceforge.net/projects/cnvanalysis。
1.3.3 染色体微阵列分析(Chromosomal Microarray Analysis,CMA)
使用美国Affymetrix公司生产的CytoScan750 k芯片和扩增、杂交试剂盒进行CMA检测。参照Infinium HD Assay标准操作流程进行操作,检测结果使用Chromosome Analysis Suite(Ch AS;version 2.1)软件进行分析。结果判读参照DGV、ISCA、OMIM、DECIPHER等数据库。
1.3.4 断裂位点PCR检测
根据CMA检测结果提示的CNV缺失区域,设计多对引物,其中引物LFS2-LR1配对扩增出1 061 bp片段,上游引物5′-GTCAGGCAGGCTTACTACCCA-3′,下游引物5′-ACCAGACAATGTATACGTTAAGTGC-3′。同时用LFS2-LR1扩增200例正常对照。将1 061 bp扩增产物进行Sanger测序,通过序列比对分析,判断EDA基因第一外显子缺失断裂位点的准确位置。
2 结果
2.1 分子遗传学检测结果及分析
2.1.1 高通测序结果
未发现38个相关基因的致病/疑似致病点突变。数据分析发现先证者EDA基因第一外显子编码区(396bp)信号缺失,正常对照可检测到序列信息(图1)。

图1 高通量测序提示EDA基因第一外显子信号缺失Figure 1 Absent signal of the EDA gene exon 1 detected by next generation sequencing
2.1.2 染色体微阵列分析
CMA检测结果发现X染色体存在约267 kb片段缺失(chrX:68,801,113-69,068,115),其中包含了EDA基因第一外显子及上下游区域(图2)。
2.1.3 断点PCR检测
LFS2-LR1引物对在先证者及其母亲样本中扩增出1 061 bp片段,正常对照未扩增出相应片段(图3)。并对包含可疑断点的PCR产物进行了Sanger测序,提示先证者EDA基因缺失范围为chrX:68,800,768-69,068,576,缺失片段总长267 808 bp,包含了EDA基因上游35 143 bp,第一外显子638 bp以及第一内含子区域的232 027 bp(图4)。
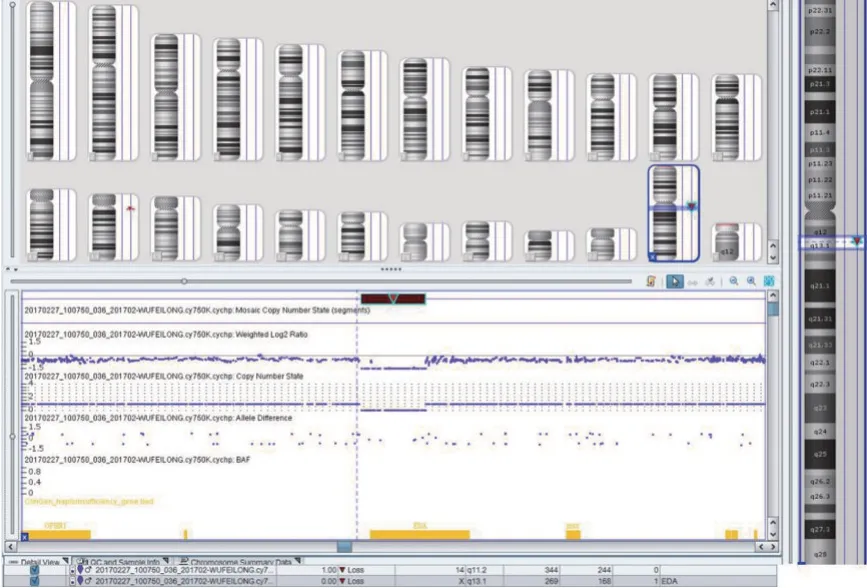
图2 先证者染色体微阵列检测结果Figure2 Chromosomal Microarray Analysisresultof the proband
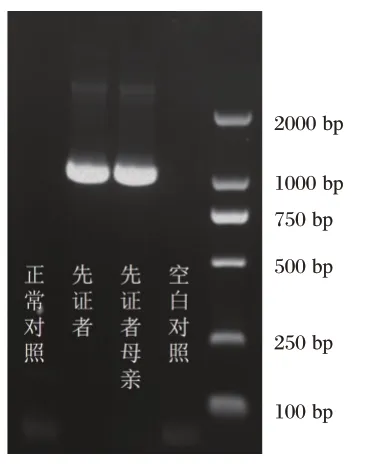
图3 断点PCR检测电泳图Figure 3 Electrophoretogram results of the breakpoint PCR detection
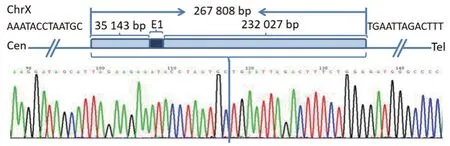
图4 EDA基因缺失范围示意图和包含断点的PCR产物测序图Figure 4 The diagram of the EDA gene deletion fragments and the PCR products sequencing result containing breakpoint
2.2 产前诊断结果
对胎儿绒毛DNA进行断裂位点PCR检测,未发现先证者的1 061 bp片段,同时对胎儿进行CMA检测,未发现异常。提示胎儿未遗传来自母亲的EDA基因第一外显子拷贝数缺失。胎儿分娩后随访结果,女婴,生长发育无异常,8个月大出牙2颗,头发生长正常。
3 讨论
少汗型外胚层发育不良(Hypohidrotic Ectodermal Dysplasia,HED)的发病机制与编码皮肤附件分化相关信号通路上的基因突变有关,可导致牙齿发育不全或其他外胚层结构缺陷[1,3]。EDA基因包括8个外显子,编码391个氨基酸[7],是HED最常见的致病基因,目前报道有200多个突变[8],以编码区的单碱基突变居多[9]。
近年来EDA基因CNV也有报道[10-13]。本文利用高通量测序检测技术发现先证者EDA基因第一外显子编码区信号缺失,结合先证者典型的HED表型,提示EDA上游区域存在CNV可能。通过CMA检测提示存在大片段缺失,为寻找精确缺失范围,通过断点PCR扩增,发现先证者存在约267 kb的缺失片段,包含了EDA基因第一外显子及其上下游区域,遗传自母亲。该CNV使野生蛋白丢失了转录翻译起始区,推测无法正常产生野生型EDA蛋白。野生蛋白的破坏情况以及是否存在新的转录本需要更一步的实验研究。有研究指出非等位基因同源重组和复制机制在解释多种生殖系和体细胞重排事件中发挥了重要作用[14]。本实验发现该家系CNV断点上下游存在一些repeat masker序列,这些同源性较高的序列很可能是通过以上机制介导了CNV的发生。
本次实验明确先证者的可能致病原因及其母亲为携带者后,经过充分知情告知,对家系第三胎进行CMA和断裂位点PCR检测,未发现胎儿携带该缺失区域,胎儿出生后未见异常。该病表型严重的成年男性患者生存质量较差,少数EDA基因突变的女性携带者有轻微症状[15]。本研究明确了先证者HED表型的病因,并且找到了缺失CNV的精确断裂位点,可以快速进行家系其他成员的检测,为先证者母亲提供了准确的遗传咨询和产前诊断信息,丰富了我国X连锁的HED患者EDA基因外显子的缺失数据库,为该疾病筛查、诊断和产前诊断提供遗传学参考数据,并为可能的EDA基因第一外显子缺失的发生机制提供了研究基础。

