miR-142-5p对癫痫发作后神经元损伤的作用机制
赵利 李海燕
癫痫属于慢性脑功能障碍性疾病,神经元细胞凋亡、神经再生、神经炎症及神经功能异常等均可导致癫痫的发生[1-2]。已有报道指出微小RNA(miRNA)异常表达与癫痫发生及发展密切相关[3]。微小RNA-142-5p(miR-142-5p)在大鼠癫痫模型中表达升高,但关于其具体作用机制尚未阐明[4]。Apelin(APLN)是一种血管活性肽并可调控多种生物学过程,并可降低神经兴奋性缓解癫痫发作[5]。利用TargetScan预测发现APLN可能是miR-142-5p的靶基因。因此,本研究主要探讨miR-142-5p在癫痫发作后神经元细胞损伤中的作用及其对PI3K/AKT信号通路的影响,并验证APLN是否为miR-142-5p的靶基因,为揭示癫痫发病机制奠定理论基础。
1 材料与方法
1.1 材料与试剂
大鼠神经元细胞购自上海康朗生物科技有限公司。胎牛血清、RPMI 1640培养基、胰蛋白酶均购自美国Sigma公司;蛋白提取试剂盒、反转录试剂盒、RNAisoPlus反转录试剂盒与实时荧光定量PCR试剂盒均购自大连宝生物工程有限公司;兔抗鼠APLN抗体购自美国Abcam公司;兔抗鼠Bcl-2、Bax、β-actin单克隆抗体均购自上海赛信通生物试剂有限公司;miR-142-5p抑制剂(anti-miR-142-5p)(AAAGAGACCGGUUCACGUGA)、miR-142-5p抑制剂的阴性对照anti-miR-con(CAGUACUUUUGUGUAGUACAA)、miR-142-5p模拟物(mimics)(UCACGUGAACCGGUCUCUUU)、miR-142-5p过表达的阴性对照miR-con(UUCUCCGAACGUGUCACGUUU)均购自百奥迈科生物技术有限公司;Lipofectamine2000转染试剂购自上海阳光生物科技有限公司;APLN小干扰RNA(si-APLN)(AGGGAGGTCGGAGGAAAUU)、乱序无意义阴性对照序列(si-con)(CAGUAAUUUAUGCAAAGCA)均购自上海吉玛制药技术有限公司;Annexin V-FITC细胞凋亡检测试剂盒均购自碧云天生物技术研究所;双荧光素酶报告基因检测试剂盒购自美国Promega公司;HRP标记的山羊抗兔IgG二抗购自美国Santa Cruz公司;GSH与MDA ELISA检测试剂盒均购自上海江莱生物科技有限公司。
1.2 方法
1.2.1 构建大鼠海马神经元癫痫模型
正常维持液内培养大鼠海马神经元,14 d后弃掉原维持液,用低镁细胞外液清洗,随后用低镁外液培养(每孔2 mL),参照相关文献构建大鼠海马神经元癫痫模型[6],根据氧化应激水平升高预示模型构建成功。将未经处理的正常神经元细胞作为正常对照组,同时将大鼠海马神经元癫痫模型大鼠神经元细胞为癫痫细胞模型组。
1.2.2 细胞转染及分组
收集处于对数生长期癫痫大鼠神经细胞分为anti-miR-142-5p组(转染anti-miR-142-5p)、antimiR-con组(转染anti-miR-con)、miR-142-5p组(转染miR-142-5p mimics)、miR-con组(转染miRcon),NC组(未经任何处理的细胞);anti-miR-142-5p+si-con组(共转染anti-miR-142-5p与si-con)、anti-miR-142-5p+si-APLN组(anti-miR-142-5p与si-APLN),参照Lipofectamine2000转染试剂盒进行操作。转染6 h更换含有10%胎牛血清及双抗的RPMI 1640完全培养基,继续培养48 h后收集细胞。
1.2.3 qRT-PCR检测细胞中miR-142-5p、APLN mRNA表达水平
取各组神经元细胞,按照Trizol试剂提取细胞总RNA,参照反转录试剂盒合成cDNA,根据实时荧光定量PCR试剂盒说明书检测miR-142-5p、APLN mRNA相对表达量。采用2-ΔΔCt法计算miR-142-5p、APLN mRNA相对表达量。miR-142-5p正向引物5′-AACGATACAGAGAAGATT-3′,反向引物5′-GGAACGCTTCACGAAT-3′;APLN正向引物5′-GGAACGATACAGAGAAGATT-3′,反向引物5′-GGAACGCTTCACGAAT-3′。
1.2.4 蛋白免疫印迹(Western blot)检测APLN、Bax、Bcl-2蛋白表达
用蛋白裂解液裂解各组神经元细胞,离心细胞后提取细胞总蛋白,经SDS-PAGE凝胶电泳分离蛋白,转膜,封闭1 h,加入蛋白一抗稀释液,4℃孵育24 h后加入二抗稀释液(1∶5 000),滴加ECL显影,置于凝胶成像系统成像,观察蛋白条带灰度值。
1.2.5 检测GSH与MDA含量
取各组神经元细胞,胰蛋白酶消化细胞,4℃条件下,3 000 r/min转速离心10 min(离心半径5 cm),吸取1 mL上清液利用ELISA检测GSH与MDA含量,同时需绘制标准品线性回归曲线,根据曲线方程计算样本中GSH与MDA浓度值。
1.2.6 流式细胞术检测细胞凋亡
收集转染48 h后各组癫痫大鼠神经细胞,0.25%胰蛋白酶消化,PBS洗涤,加入Binding Buffer 200μL重悬细胞,依次分别加入5μL Annexin V-FITC与PI,充分混匀后置于室温下避光孵育15 min,加入300μL Binding Buffer,利用流式细胞仪检测各组神经细胞凋亡情况。
1.2.7 荧光素酶报告基因检测
TargetScan预测miR-142-5p的靶基因可能是APLN,构建野生型载体APLN-WT、突变型载体APLN-MUT,取对数生长期癫痫大鼠神经细胞共转染APLN-WT(100 ng)与miR-142-5p mimics或miR-con,共转染APLN-MUT与miR-142-5p mimics或miR-con,继续培养48 h,根据双荧光素酶报告基因试剂盒说明书检测各组细胞荧光素酶活性值。
1.3 统计学处理
采用SPSS 21.0统计学软件分析数据,计量资料以()表示,数据均符合正态分布,两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 miR-142-5p和APLN在大鼠癫痫神经细胞中的表达
NC组与癫痫细胞模型组大鼠神经细胞中miR-142-5p的表达水平分别为(1.03±0.11)、(4.28±0.37);APLN mRNA的表达水平分别为(1.03±0.21)、(0.62±0.06);APLN蛋白相对表达量分别为(0.54±0.06)、(0.28±0.04),NC组与癫痫细胞模型组相比差异有统计学意义(P<0.05),见图1。

图1 Western blot检测大鼠癫痫神经细胞APLN蛋白表达Figure 1 Western blot analysis of APLN protein expression in rat epilepsy neurons
2.2 大鼠神经细胞干扰miR-142-5p表达对大鼠癫痫神经细胞氧化应激参数GSH和MDA含量的影响
相较于NC组、anti-miR-con组,anti-miR-142-5p组大鼠神经细胞中GSH含量明显增加,而MDA含量明显减少(P<0.05),见图2。
2.3 干扰miR-142-5p表达对大鼠癫痫神经细胞凋亡的影响
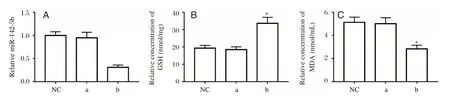
图2 检测大鼠神经细胞中GSH、MDA含量(48 h)Figure 2 Detection of GSH and MDA in rat nerve cells(48 h)
anti-miR-142-5p组癫痫大鼠神经细胞凋亡率与NC组、anti-miR-con组比较差异有统计学意义(图3D、3E)(P<0.05),进一步检测发现anti-miR-142-5p组癫痫大鼠神经细胞中Bcl-2蛋白表达水平显著高于NC组、anti-miR-con组(P<0.05),而Bax蛋白表达水平降低(P<0.05)(图3A、3B、3C)。
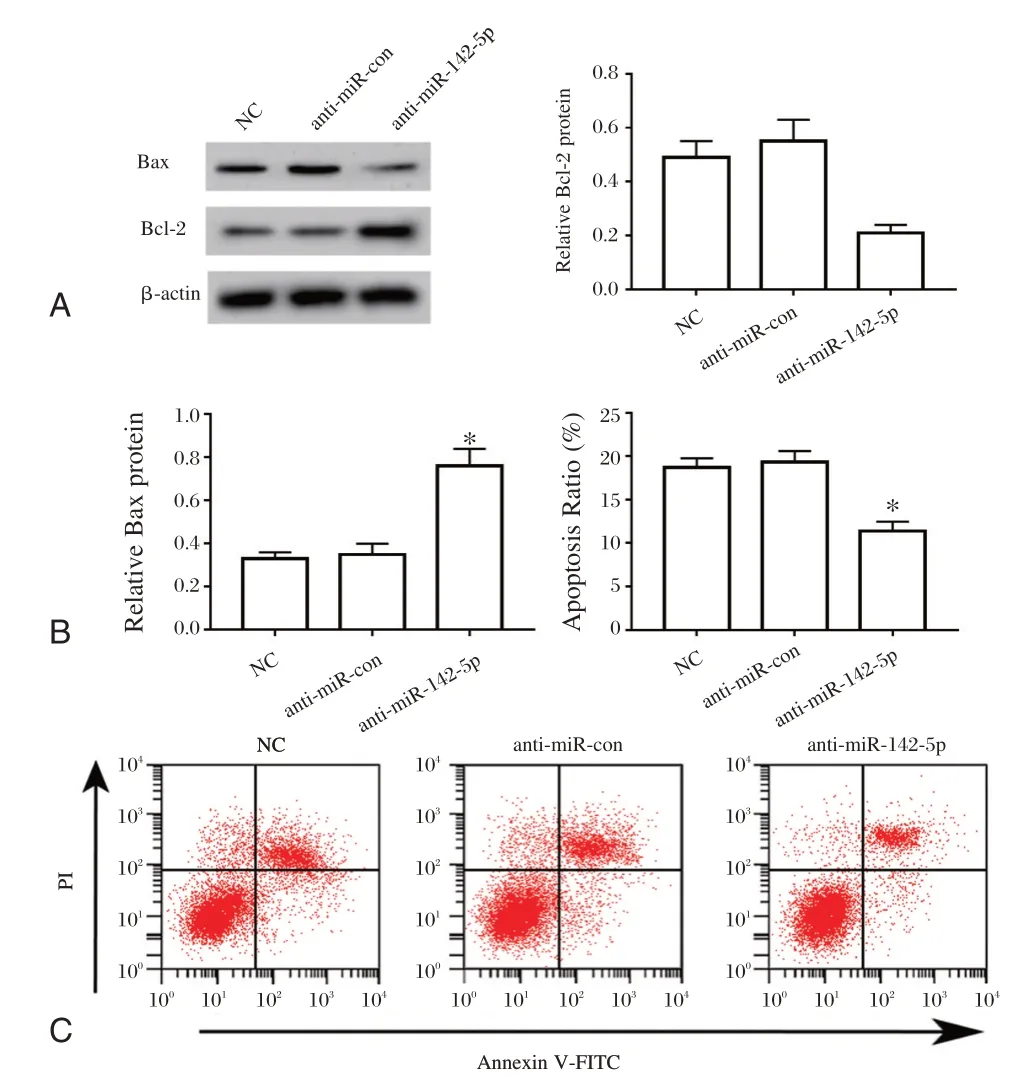
图3 干扰miR-142-5p表达后对大鼠癫痫神经细胞凋亡的影响Figure 3 Effect of interference with miR-142-5p expression on apoptosis of rat epileptic neurons
2.4 miR-142-5p靶向APLN
靶基因预测结果显示APLN是miR-142-5p的靶基因,见图4A。双荧光素酶报告基因实验显示,共转染APLN-WT与miR-142-5p mimics后,癫痫大鼠神经细胞荧光素酶活性较转染miR-con组明显下降(P<0.05),而共转染APLN-MUT与miR-142-5p mimics后,癫痫大鼠神经细胞荧光素酶活性较转染miR-con组无统计学意义(P>0.05),见表1。转染miR-142-5p mimics后,癫痫大鼠神经细胞中APLN蛋白的表达水平较转染miR-con组降低(P<0.05),而转染anti-miR-142-5p后,癫痫大鼠神经细胞中APLN蛋白的表达水平较转染anti-miRcon组升高(P<0.05),见图4B、表2。
2.5 沉默APLN部分逆转干扰miR-142-5p对大鼠癫痫神经细胞的保护作用
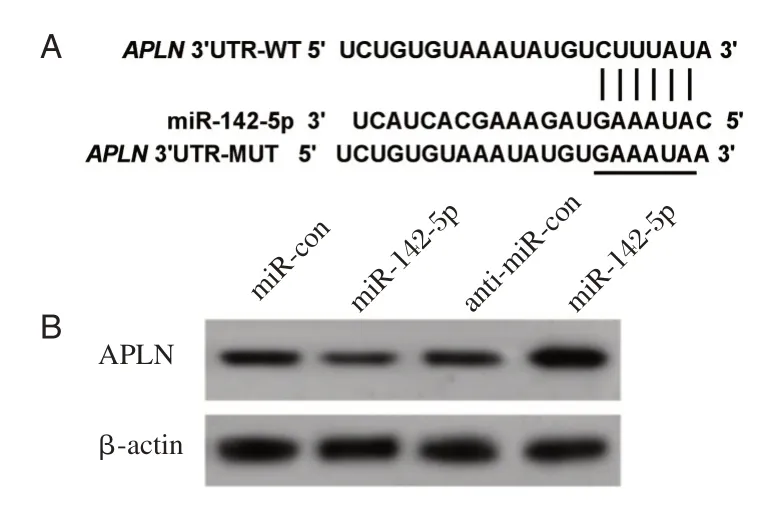
图4 miR-142-5p与APLN靶向序列和调控APLN蛋白表达Figure 4 miR-142-5p and APLN targeting sequences and regulation of APLN protein expression
表1 双荧光素酶报告实验(±s,n=3)Table 1 Dual luciferase reporter experiment(±s,n=3)
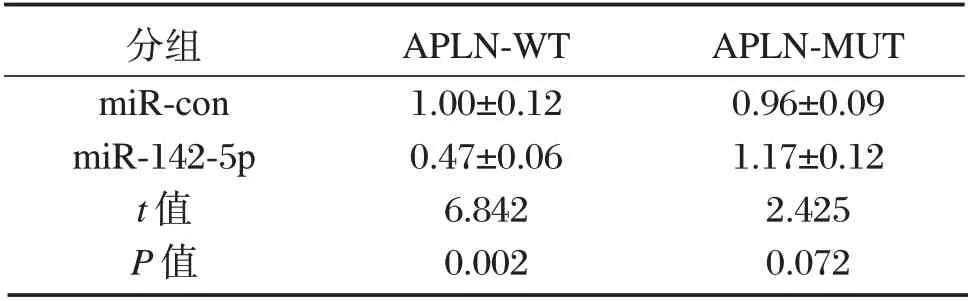
表1 双荧光素酶报告实验(±s,n=3)Table 1 Dual luciferase reporter experiment(±s,n=3)
分组miR-con miR-142-5p t值P值APLN-WT 1.00±0.12 0.47±0.06 6.842 0.002 APLN-MUT 0.96±0.09 1.17±0.12 2.425 0.072
表2 miR-142-5p调控APLN蛋白的表达(±s,n=3)Table 2 miR-142-5p regulates the expression of APLN protein(±s,n=3)

表2 miR-142-5p调控APLN蛋白的表达(±s,n=3)Table 2 miR-142-5p regulates the expression of APLN protein(±s,n=3)
分组miR-con miR-142-5p anti-miR-con anti-miR-142-5p F值P值APLN蛋白0.61±0.08 0.34±0.05 0.64±0.07 0.92±0.08 33.401 0.000
如图5、表3所示,共转染anti-miR-142-5p与si-APLN后,癫痫大鼠神经细胞凋亡率较共转染anti-miR-142-5p+si-con组升高,差异有统计学意义(P<0.05),Bax蛋白表达水平升高,而Bcl-2蛋白表达水平降低,差异有统计学意义(P<0.05)。
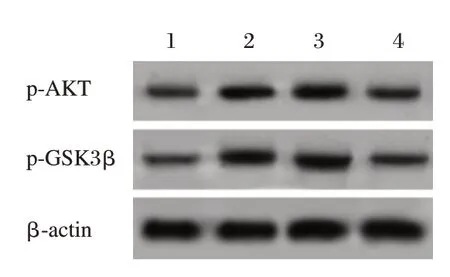
图5 Western blot检测大鼠癫痫神经细胞Bax和Bcl-2表达Figure 5 Western blot analysis of Bax and Bcl-2 expression in rat epileptic neurons
表3 沉默APLN部分逆转干扰miR-142-5p对大鼠癫痫神经细胞APLN、Bax和Bcl-2的表达以及细胞凋亡率的影响(±s,n=3)Table 3 Effect of silencing APLN partial reversal of miR-142-5p on the expression of APLN,Bax and Bcl-2 and apoptosis rate in rat epileptic neurons(±s,n=3)
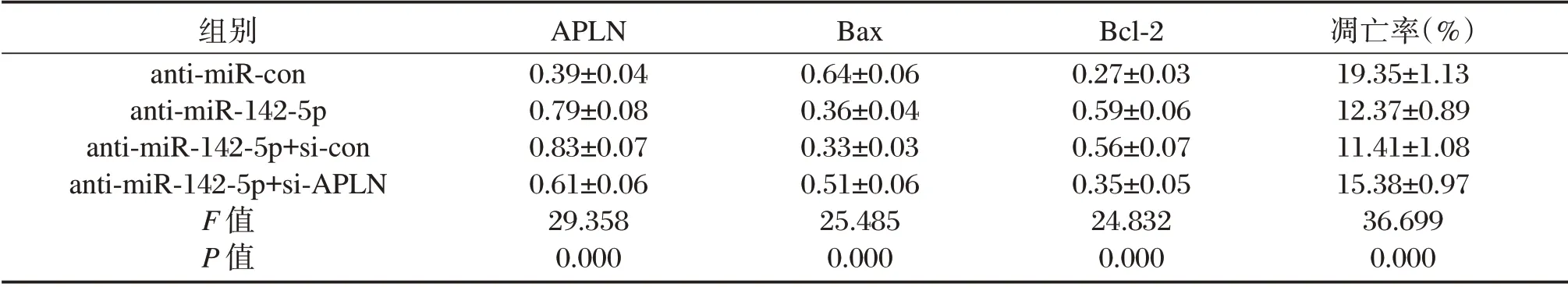
表3 沉默APLN部分逆转干扰miR-142-5p对大鼠癫痫神经细胞APLN、Bax和Bcl-2的表达以及细胞凋亡率的影响(±s,n=3)Table 3 Effect of silencing APLN partial reversal of miR-142-5p on the expression of APLN,Bax and Bcl-2 and apoptosis rate in rat epileptic neurons(±s,n=3)
组别anti-miR-con anti-miR-142-5p anti-miR-142-5p+si-con anti-miR-142-5p+si-APLN F值P值APLN 0.39±0.04 0.79±0.08 0.83±0.07 0.61±0.06 29.358 0.000 Bax 0.64±0.06 0.36±0.04 0.33±0.03 0.51±0.06 25.485 0.000 Bcl-2 0.27±0.03 0.59±0.06 0.56±0.07 0.35±0.05 24.832 0.000凋亡率(%)19.35±1.13 12.37±0.89 11.41±1.08 15.38±0.97 36.699 0.000
表4 APLN和miR-142-5p表达对大鼠癫痫神经细胞AKT信号通路相关蛋白p-AKT和p-GSK3β的表达(±s,n=3)Table 4 Expression of APLN and miR-142-5p on AKT signaling pathway-associated proteins p-AKT and p-GSK3β in rat epileptic neurons(±s,n=3)
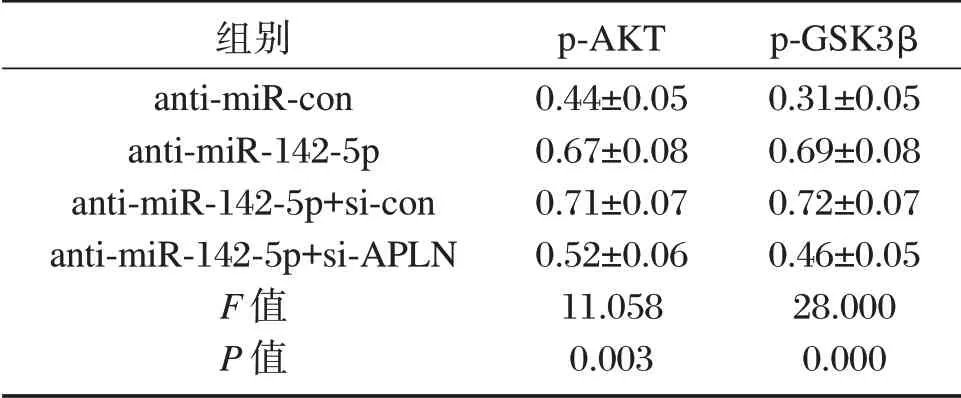
表4 APLN和miR-142-5p表达对大鼠癫痫神经细胞AKT信号通路相关蛋白p-AKT和p-GSK3β的表达(±s,n=3)Table 4 Expression of APLN and miR-142-5p on AKT signaling pathway-associated proteins p-AKT and p-GSK3β in rat epileptic neurons(±s,n=3)
组别anti-miR-con anti-miR-142-5p anti-miR-142-5p+si-con anti-miR-142-5p+si-APLN F值P值p-AKT 0.44±0.05 0.67±0.08 0.71±0.07 0.52±0.06 11.058 0.003 p-GSK3β 0.31±0.05 0.69±0.08 0.72±0.07 0.46±0.05 28.000 0.000
3 讨论
miR-142-5p在动脉粥样硬化组织中呈高表达,其可通过抑制靶基因转化生长因子β2(TGF-β 2)表达进而诱导人巨噬细胞凋亡[7]。miR-142-5p通过靶向Ulk1进而破坏猪血凝性脑脊髓炎病毒感染的神经元形态[8]。本研究结果表明癫痫细胞模型组神经细胞中miR-142-5p的表达水平显著升高,干扰miR-142-5p表达后癫痫大鼠神经细胞氧化应激指标GSH含量显著升高,而MDA含量显著降低。GSH属于抗氧化系统酶类,而MDA属于氧化系统酶类,氧化系统与抗氧化系统失衡可促使脑组织或细胞损伤[9]。提示干扰miR-142-5p表达可通过抑制神经细胞氧化应激反应进而减缓神经元损伤程度。Bcl-2可抑制细胞凋亡,而Bax可促进细胞凋亡[10]。本研究结果发现,干扰miR-142-5p表达后,癫痫大鼠神经细胞中Bcl-2表达水平明显升高,而Bax表达水平显著降低。提示干扰miR-142-5p表达可通过减轻神经细胞氧化应激反应及抑制细胞凋亡进而减缓癫痫大鼠神经元损伤。
APLN可在多种组织中表达,并可参与氧化应激、炎症反应及心肌缺血再灌注损伤等多种生理病理过程[11]。APLN可作为内源性神经保护因子,并可在神经元遭受兴奋性毒性损伤时发挥抗神经细胞凋亡的作用[12]。与上述研究结果相似,本研究结果表明癫痫细胞模型组中神经细胞中APLN的表达水平明显降低,进一步证实miR-142-5p可负向调控靶基因APLN表达,anti-miR-142-5p与si-APLN共转染癫痫大鼠神经细胞后,细胞凋亡率明显增加。提示干扰miR-142-5p表达可通过上调APLN表达进而对癫痫发作后神经元损伤发挥保护作用。
综上所述,干扰miR-142-5p表达可能通过调控APLN的表达进而抑制癫痫发作后神经细胞凋亡,并可能通过抑制神经细胞氧化应激反应进而对神经元损伤发挥保护作用,其可能通过激活AKT信号通路而发挥作用,为进一步研究miR-142-5p在癫痫发病过程中的作用机制奠定理论基础,为临床诊断及治疗提供一定依据。

