冠心病风险评估模型构建的进展
吴孟娜 年士艳 叶丹 张春婷 冯磊★
心血管病死亡已成为城乡居民死亡的首要原因,并向低龄和低收入群体快速蔓延,所带来的医疗费用增长远高于国内生产总值增速,故加强政府主导下的疾病防治已刻不容缓[1]。动脉粥样硬化性心血管病(atherosclerotic cardiovascular disease,ASCVD)是一种以动脉粥样硬化为基础病理机制,主要包括冠心病(Coronary heart disease,CHD)、卒中和周围血管病的公共卫生疾病。正确识别心血管疾病发病相关的危险因素、进行风险评估及危险分层对心血管病的防治有重要作用。
近年来,全基因组关联研究及大规模病例对照研究发现了众多与CHD易感性相关的重要基因,主要从影响脂质代谢、血栓形成、血管舒张及收缩、与炎症反应相关等方面影响CHD的发生发展[2-3]。为提升预测模型的评估效能,有研究提出联合危险因子与易感基因构建CHD风险评估模型的新策略[4],但其评估效能仍存在争议。本文欲分析国内外心血管疾病风险评估模型,探讨其存在的局限性以及危险因子联合易感基因的新策略对模型评估效能的提升作用。
1 心血管疾病风险评估模型
1948年美国首先启动了Framingham心脏研究,经多年监测和随访识别出CHD、中风和其他心脑血管疾病的主要危险因素,构建了心脑血管疾病的风险评估模型[5],为心血管疾病的一级预防提供了理论依据。由于Framingham心脏研究的预测模型存在较强的地域及人群特异性[6],主要适用于大部分的美国成年人,各国积极探索适合本国人群的心血管风险评估模型,目前主要风险评估模型如表1所示。
2 目前CHD风险评估模型存在的问题
国内外研究已构建诸多CHD风险评估模型,但这些模型的临床适用性仍存在问题,主要表现为以下几方面。
2.1 模型中纳入的危险因素不足
国内外学者构建的诸多CHD风险评估模型中所纳入的危险因素不尽相同。除传统危险因子(年龄、性别、吸烟、血压、糖尿病等),近年国内外学者就CHD危险因子的研究中陆续提出了一些新危险因子,如总胆红素(total bilirubin,TBIL)、同型半胱氨酸(homocysteine,HCY)等。但新危险因子以及部分传统危险因子如大多数血脂类指标并未得到风险评估模型的普遍认可和采纳。
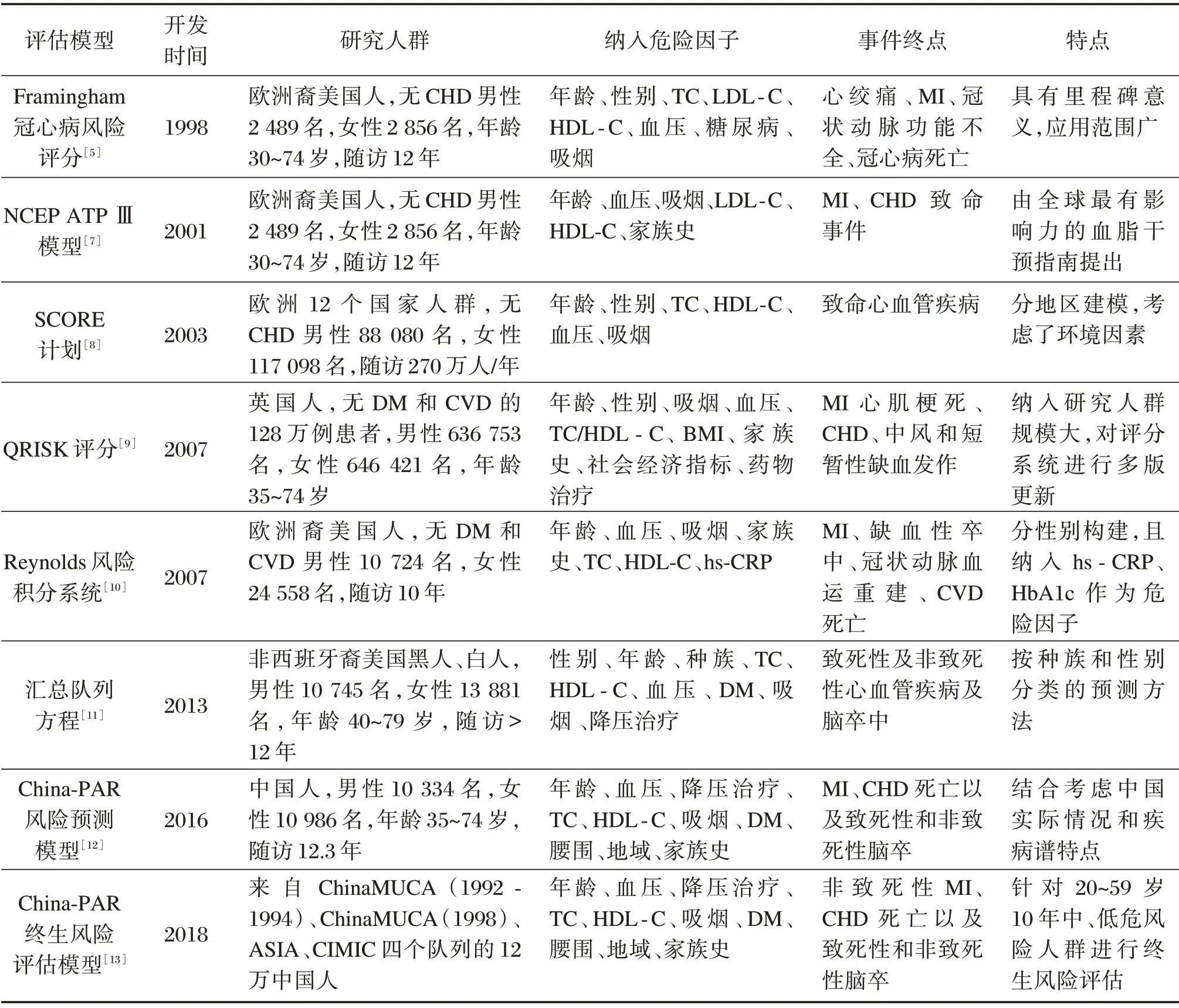
表1 心血管疾病风险评估模型比较Table 1 Comparison of cardiovascular disease risk assessment models
究其原因,除检测方法不统一和不够严谨的统计分析外,人为干预导致该类指标无法代表疾病发生与发展的初始状态等问题也是导致其临床作用未被认可的原因之一,故需选择能反映ASCVD发生与发展、且目前常规临床干预手段影响较少的指标。同时CHD是一种复杂的多因素疾病,将多个与ASCVD相关的危险因子进行整合后纳入心血管疾病风险评估模型中可提高传统险评估模型的诊断效能[14]。检测指标间相关性可能影响结果的准确性,可考虑将存在相关性的指标组合为综合指数,如:TC/(HDL-C+TBIL)比值及LDL-C/(HDL-C+TBIL)等[15]。
2.2 模型缺乏年龄分层
年龄已被众多评估模型广泛纳入,有必要依据年龄分层构建评估模型。有研究发现,年龄与很多指标存在较强相关性,如糖化血红蛋白[16],统计分析时产生的混杂因素可能影响结果准确性。且由于ASCVD随年龄增长患病率本身就会升高,研究时需保证病例组和对照组年龄匹配。此外,ASCVD发病已呈年轻化趋势,对早发或青年型ASCVD研究发现,不同年龄段风险因子构成存在差异[17]。有研究进行了ASCVD传统公认血脂类危险因子在人群中随年龄变化的大数据分析[18],研究结果发现随着年龄增长,经典血脂指标在男女性水平间关系以及与疾病相关性方面发生改变。
2.3 缺乏个体化的CHD风险评估模型
国际上推出的风险评估模型存在较强的地域及人群特异性[6]。我国现已有顾东风团队开发了China-PAR十年风险及终生风险评估模型。而我国属于统一的多民族国家,不同民族间可能由于遗传背景、饮食及生活习惯等因素导致风险评估模型存在民族差异性。
近年来提出“精准医疗”旨在为人们提供更精准、高效、安全的预防、诊断及治疗措施,针对基因多态性与CHD发生发展之间的关系是当今国内外学者的一个研究热点。有研究发现,基因易感性与风险评估数学模型间存在一定关联性,将基因易感性因素与传统危险因子进行有机结合,可能会完善和提高对CHD风险评估的效能[4]。
3 新危险因子联合易感基因构建CHD风险模型新策略
3.1 CHD危险因子分类
与ASCVD发生、发展相关的危险因子主要可分为以下四大类:①经典不可改变危险因子:年龄、性别、家族史、种族差异等。②经典可改变危险因子:血压、血脂异常、糖尿病、肥胖等。③行为危险因子:吸烟、多食少运动等。④新危险因子:血栓形成相关危险因子[19],如:D-二聚体;炎症相关危险因子[20],如:超敏C反应蛋白;促血管平滑肌增生指标[14],如:HCY;氧化应激类危险因子[21],如TBIL、γ-GT;基因易感性指标[22-24]等。
3.2 CHD发病相关易感基因
现已有研究发现与CHD发生发展相关的基因或基因位点,通过单核苷酸多态性(single nucleotide polymorphism,SNP)检测,可进行个体基因风险评分,进而预测CHD风险[24]。但目前有关CHD发病相关易感基因的研究结果间仍存在争议,可能有以下原因导致结果间存在差异:①种族差异。由于种族间人群所携带的遗传基因存在差异,已有相关文献提出特定基因位点多态性与CHD发病之间的相关性存在种族差异[25]。②表型差异。在众多CHD相关易感基因中,不同的基因突变可能影响所诱发CHD的临床表型,如性别间差异、发病年龄、疾病严重程度及发展特征等。因此在CHD相关易感基因研究中可将研究对象依据表型分组进行分析。③局限于单个SNP分析。由于单个基因效应微弱且遗传研究中存在基因调控的现象,孤立地研究单个基因及其表达往往无法确切地反应疾病发生发展相关的内在机制,因此有必要对多个基因的SNPs同时进行分析。
3.3 危险因子联合易感基因构建CHD风险模型
从遗传学理论上推测某些易感基因与临床生理、生化指标间可能存在一定关联性,两者在疾病发生与发展中可能存在协同或抑制机制。已有研究将构建的CHD发病风险评估模型[18]与两个新发现的基因易感性因子[22-23]进行了联合分析,结果发现易感基因型别与数学模型间确实存在一定关联性[4],传统危险因子与易感基因联合可能会促进风险模型评估效能的进一步提升。
目前大规模的基因筛查确定了众多与复杂疾病风险相关的基因位点,而单个基因效应微弱且基因间存在调控现象,应当考虑多个DNA变异对发病风险的累积影响。近年有研究计算多基因风险评分(Polygenic risk score,PRS)用于评估个体发病风险[24],Mars等[26]评估了PRS对CHD的临床风险评估附加价值,研究结果显示PRS能提高净重新分类改善指数。然而JAMA近期发表的两项研究[24,27]提出,传统危险因素仍然是预测CHD发病风险的有力工具,将PRS添加到传统风险评估模型中并未明显提高一般中年白种人群的风险评估效能。由于以上研究均是在白种人群中进行,种族差异性可能导致结果间存在差异,还需在中国人群中进一步验证。
尽管目前各国学者均积极进行全基因组关联研究以明确CHD相关易感基因,但相比单独传统风险评估模型,危险因子联合易感基因构建CHD风险模型的评估效能仍存在争议,未来还需大样本病例对照研究及前瞻性研究的进一步探索。
4 小结与展望
CHD风险评估是心血管疾病一级预防的重要内容,国际上已构建诸多CHD风险评估模型,然而目前国内外所构建模型的临床适用性仍存在问题。通过大量病例对照研究及前瞻性研究,现已提出众多CHD发病相关危险因素。随着全基因组关联研究的发展及应用,为开发更准确的风险评估策略提供了新的方向,有学者提出联合危险因子与易感基因构建CHD风险评估模型的新策略,但其相比传统风险评估模型的效能提升仍存在争议。未来还需针对特定人种或区域人群进行大样本病例对照及前瞻性研究,就进一步探索危险因子联合易感基因的新模型构建策略是否优于传统风险评估模型开展更深入研究。

