MRSA耐药性检测及SCCmec基因分型分析
屠雷钧 叶永志 林 娅 边保华
自1961年英国学者Jevons首先发现了耐甲氧西林金黄色葡萄球菌(MRSA),随后在世界各国陆续发现,已成为医院内感染的重要病原菌之一[1-3]。2012年中国医院细菌监测网监测结果显示,在我国MRSA感染在SA中所占比例达47.9%[4]。MRSA具有致病力强、传播速度快、耐药性强、耐药谱广的特点,对人类健康构成严重威胁,其造成的感染与乙型肝炎、艾滋病并列成为世界三大难解决的感染性疾病之一[5]。MRSA的耐药主要是因为葡萄球菌染色体mec基因盒(CSSmec)中携带甲氧西林耐药决定子A(mecA)。且SCCmec型别较多,不同地区MRSA的SCCmec流行型别不同,其耐药特性也有所不同。为了解本院住院患者MRSA感染、SCCmec流行型别及耐药特征,将临床住院患者各类标本中分离的金黄色葡萄球菌(SA)作MRSA检测、基因分型及耐药性分析,报道如下。
1 材料与方法
1.1 菌株来源 157株SA为台州市中西医结合医院2018年1月至12月住院患者痰液、脓汁、血液、尿液等各种标本分离所得,排除同一部位重复的菌株。
1.2 质控菌株 金黄色葡萄球菌ATCC43300(MRSA菌株)、金黄色葡萄球菌ATCC25923(MSSA菌株)均购自中国菌种保藏中心。
1.3 主要试剂与仪器 血平板、MH平板、5%羊血哥伦比亚琼脂平板、MH肉汤等均为杭州天和微生物试剂公司产品;各种药敏纸片均为英国Oxoid产品;细菌基因组提取试剂盒为上海生工生物工程(股份)有限公司产品;VITEK-2Compact全自动微生物分析仪和革兰阳性细菌鉴定片为法国梅里埃公司产品;PCR扩增仪BIO-RAD S1000 Thermal cycle、凝胶电泳仪和成像系统均为美国BIO-RAD公司产品。
1.4 方法 (1)SA的培养与鉴定:以《全国临床检验操作规程》为标准进行分离培养[6],并经法国梅里埃VITEK-2Compact型全自动细菌分析仪进行鉴定。(2)MRSA表型检测:采用头孢西丁琼脂扩散法,操作方法及结果判断按美国临床实验室标准化委员会(CLSI)推荐的标准[7]。以金黄色葡萄球菌ATCC25923和金黄色葡萄球菌ATCC43300作质控。(3)MRSA基因检测:①MRSA基因组DNA提取:采用上海生工生物工程(股份)有限公司生产的细菌基因组提取试剂盒提取细菌DNA。严格按试剂盒说明书操作。提取液质量的检测用1%琼脂糖凝胶电泳鉴定。②mecA及SCCmec基因分型检测:引物设计:mecA及SCCmec基因扩增引物委托上海生工生物工程(股份)有限公司合成。见表1和表2。聚合酶链反应(PCR)扩增体系及条件:PCR扩增总体系均为50μl:dNTPs混合液(2.5mmol/L)4μl,10× 缓冲液 5μl,上下游引物(25μmmol/L)各1μl,Taq酶0.5μl,镁离子0.5μl,DNA模板1μl,双蒸馏水补足至50μl。扩增条件:94℃预变性2min,94℃变性 60s,55℃退火 60s,72℃延伸 60s,循环35个周期,最后72℃延长至10min。取PCR产物5 μl在1.5%琼脂糖凝胶电泳,EB染色紫外灯下成像,观察分析结果。

表1 PCR扩增mecA基因引物序列

表2 PCR扩增SCCmec基因引物序列
1.5 基因测序及分析 将PCR产物送上海生工生物工程(股份)有限公司纯化测序。测序结果经Gen Bank序列数据库中采用BLAST程序进行核苷酸序列比对,确定基因型。
1.6 药敏试验 采用K-B纸片扩散法,以CLSI标准进行操作和结果判断[7],采用金黄色葡萄球菌ATCC25923和金黄色葡萄球菌ATCC43300作质控菌株。
2 结果
2.1 MRSA菌株表型检测结果 157株分离自临床各类标本的SA经表型检测有76株阳性,初筛阳性率为48.41%。
2.2 MRSA菌株基因检测及SCCmec分型结果 76初筛阳性的菌株,再经PCR检测mesA基因,电泳结果在147bp处有73株出现DNA阳性条带,MRSA确证试验阳性率为46.50%。PCR电泳结果见图1。73株确证为MRSA菌株经PCR检测SCCmec基因型,结果在280bp处出现41条DNA阳性条带,在398bp处出现27条DNA阳性条带,在200bp处出现2条DNA阳性条带,尚有3株无法分型。PCR电泳结果见图2。

图1 mecA基因PCR扩增电泳图
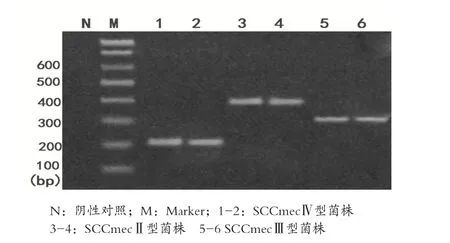
图2 SCCmec分型PCR基因扩增电泳图
2.3 基因序列测序结果 PCR阳性产物经纯化测序,并与Gen Bank序列数据库提供的SCCmec序列比对,结果确定200bp处阳性条带为SCCmecⅣ型,280bp处为SCCmec型,398bp处为SCCmecⅡ型。
2.4 药敏试验结果 SCCmecⅡ型与Ⅲ型对万古霉素、替考拉宁具有极高敏感性,相反对β-内酰胺类抗菌药物100%耐药,对其他常用抗菌药物也有较高耐药性,但SCCmecⅡ菌株耐药率显著低于SCCmecⅢ菌株,差异有统计学意义(P<0.05)。见表2。

表2 主要MRSA菌株不同SCCmec基因型的耐药结果(%)
3 讨论
MRSA具有较强的致病力,且具有多重耐药性的特点,备受临床医师高度关注。本资料结果显示,MRSA表型检测有76株阳性,初筛阳性率48.41%。由于MRSA产生的耐药是因MRSA获得mesA基因,mecA基因能编码产生新的青霉素结合蛋白2a(PBP2a),造成对β-内酰胺类药物耐药,CLSI明确指出一旦在金黄色葡萄球菌中检测到mecA基因,即可认定MRSA[8]。据此,采用PCR技术将76株表型阳性菌株经mecA特异性检测,结果有73株PCR反应扩增到147bpDNA片段,MRSA确证阳性率为46.50%,该结果与2012年中国细菌耐药性监测网所监测的全国MRSA平均检出率47.9%基本相一致[5],高于应建飞报道的37.28%[9],表型与基因型检测符合率为96.05%。另3株表型检测虽然阳性,能表达β-内酰胺酶,但菌株未携带mecA基因,其原因据学者报道认为一旦SA细胞壁增厚变粗也能导致表型阳性而对β-内酰胺类药物耐药[10]。
SCCmec是一个能移动的遗传基因元件,由mecA等多种基因构成,还携带有多种质粒和转座子,编码除对β-内酰胺类药物耐药外,还能编码产生对多种抗菌药物耐药。依据SCCmec盒上基因复合体的组成不同,SCCmec有多种型别,SCCmecⅠ、Ⅱ、Ⅲ型主要见于医院感染获得性MRSA(HA-MRSA),SCCmecⅣ、Ⅴ型主要见于社区获得性MRSA(CAMRSA)。这几年又陆续发现其他新的型别SCCmec。SCCmecⅠ型是最早发现,所带耐药基因少,大多数对非β-内酰胺类药物敏感。SCCmecⅡ、Ⅲ型含耐药基因比Ⅰ型要多,且多种耐药基因整合在一起,表现为对多种抗菌药物耐药。相对SCCmecⅢ型要比Ⅱ型携带耐药基因更多,故其耐药性更强更广些。SCCmecⅣ、Ⅴ型分子较小,且基因较稳定,仅携带mecA基因,不带有其他耐药基因[11],因此,对非β-内酰胺抗生素大多敏感。不同型别SCCmec在不同国家和不同地区流行也不相同,亚洲地区MRSA流行型别以SCCmecⅡ型为主,在我国南北地区流行菌株的基因型也有差异,北方对SCCmecⅡ型为主,而南方则以SCCmecⅢ型为主[12]。本资料结果显示,本组MRSA流行菌株主要是SCCmecⅢ型,由于SCCmecⅢ型携带有更多的耐药基因整合在一起,还可通过质粒等途径在葡萄球菌间传播而造成多重耐药,应引起临床医师高度关注。
SCCmecⅡ型与Ⅲ型对万古霉素、替考拉宁具有极高敏感性,未见耐药菌株,对β-内酰胺类药物100%耐药,对其他抗菌药物也有较高耐药性,但SCCmecⅡ型菌株对氨基糖苷类、大环内酯类、喹诺酮类、四环素类和林可霉素类的耐药性显著低于SCCmecⅢ型菌株。表明SCCmecⅢ型菌株比Ⅱ型菌株携带有更多的耐药基因整合在一起,且mecA基因与其耐药基因紧密相邻而连锁,造成更为严重耐药。利奈唑胺对MRSA具有很高敏感性,极少见到耐药报道,但在本资料中尚有1株SCCmecⅢ型菌株产生耐药,据报道可能与23S核糖体RNA 突变或cfr基因介导的2503位腺嘌呤甲基化有关[13],有待今后工作中进一步加以研究。
了解MRSA在临床感染率及SCCmec基因型在当地的流行情况,对防控MRSA菌株在院内流行及耐药性分析具有重要意义。

