完全胸腔镜引导下肺癌切除术的短期疗效及对感染指标的影响
赵岩,焦英洁,翟所锴
淄博市第一医院1心胸外科,2外三科,山东 淄博 255200
肺癌发病率、病死率居恶性肿瘤首位[1-2],手术是治疗肺癌的主要方式。近年来,胸腔镜肺癌切除术以微创、术后恢复快、并发症少等优势在临床应用逐渐增多[3],但目前研究多关注胸腔镜肺癌切除术的临床疗效,较少关注对感染指标的影响。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、超敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)、降钙素原(procalcitonin,PCT)和白细胞介素-10(interleukin-10,IL-10)是临床常用的感染指标。本研究在观察胸腔镜肺癌切除术短期疗效的基础上,探讨其对感染指标的影响,为临床治疗提供参考,现报道如下。
1 对象与方法
1.1 研究对象
选择2013年5月至2018年10月淄博市第一医院收治的103例肺癌患者为研究对象。纳入标准:①经皮穿刺细胞检查初次确诊为肺癌;②肿瘤直径<5 cm;③切缘超过病灶边缘2 cm。排除标准:①癌灶累及主气管;②合并脏器功能障碍;③既往胸部手术史。根据随机数字表法将103例肺癌患者分为观察组和对照组。观察组51例,男31例,女20例;年龄51~69岁,平均(62.35±5.94)岁;病理类型:腺癌25例,鳞状细胞癌20例,腺鳞癌6例;临床分期:Ⅰ期19例,Ⅱa期20例,Ⅱb期12例;肿瘤直径1~4 cm,平均(3.21±0.24)cm。对照组52例,男33例,女19例;年龄46~71岁,平均(63.02±6.17)岁;病理类型:腺癌27例,鳞状细胞癌18例,腺鳞癌7例;临床分期:Ⅰ期22例,Ⅱa期23例,Ⅱb期7例;肿瘤直径0.5~4 cm,平均(3.16±0.35)cm。两组患者基线特征比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,向所有患者及其家属介绍研究目的、方法及注意事项,患者及家属均签署知情同意书。
1.2 治疗方法
对照组采用传统开胸手术,于第5/6肋骨间行25~30 cm切口,手术切除肿瘤并行淋巴结清扫,常规放置引流管;术后预防性使用抗生素预防感染,严密观察病情。观察组采用完全胸腔镜引导下肺癌切除术,于腋中线第7肋间做一长约1.5 cm的切口,腋前线中心3~4 cm为主操作口,腋后线第8、9肋间为副操作口。主操作孔下依次暴露、离断肺门部位软组织,逐渐深入处理肺裂,由前向后自第3肋间切除上叶,从下向上自第4肋间切除下叶,淋巴结清扫方法和术后处理同对照组。
1.3 观察指标
①观察两组患者手术时间、术中出血量、淋巴结清扫数目、术后3天引流总量、术后疼痛程度视觉模拟评分(visual analogue scale,VAS)、拔管时间、住院时间的差异。VAS评分共0~10分,其中0分为无痛,10分为不可忍受的剧痛[4]。②治疗前后采用Vmax229肺功能仪(美国森迪斯公司)参照美国胸科协会肺功能检查操作规范进行常规肺功能检查,记录第1秒用力呼气容积(forced expiratory volume in one second,FEV1)、FEV1与用力肺活量(forced vital capacity,FVC)的比值(FEV1/FVC)、FEV1占预计值百分数(PFEV1/pred)。③感染指标:术前、术后3天采用酶联免疫吸附试验检测血清TNF-α、hs-CRP、PCT和IL-10水平。④观察两组患者肺部感染、漏气、低氧血症、脓胸、心律失常等术后并发症发生情况以及围手术期死亡率。
1.4 统计学分析
采用SPSS 25.0软件进行数据分析,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数及率(%)表示,组间比较采用χ2检验;以P<0.05为差异有统计学意义。
2 结果
2.1 肺功能的比较
术前两组患者 FEV1、PFEV1/pred、FEV1/FVC水平比较,差异均无统计学意义(P>0.05);术后,两组患者FEV1、PFEV1/pred、FEV1/FVC水平均出现不同程度降低,但观察组患者FEV1、PFEV1/pred、FEV1/FVC水平均高于对照组,差异均有统计学意义(P<0.05)。(表1)
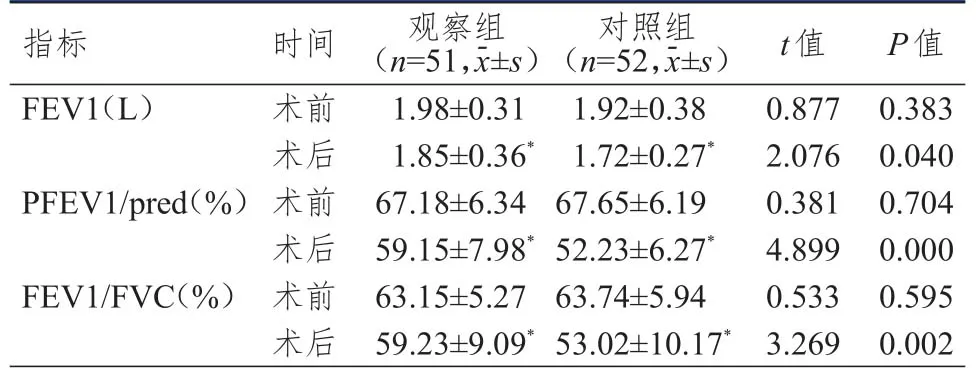
表1 手术前后两组患者FEV1、PFEV1/pred、FEV1/FVC水平的比较
2.2 围手术期指标的比较
观察组患者手术时间、拔管时间、住院时间均明显短于对照组,术中出血量、术后3天引流量均明显少于对照组,VAS评分明显低于对照组,差异均有统计学意义(P<0.01);两组患者术中淋巴结清扫数目比较,差异无统计学意义(P>0.05)。(表2)
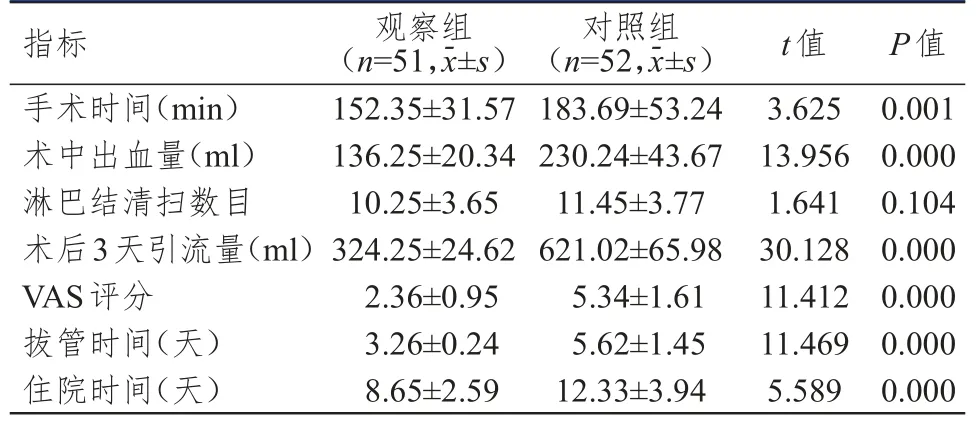
表2 两组患者围手术期指标的比较
2.3 感染指标的比较
术前,两组患者血清TNF-α、hs-CRP、PCT、IL-10水平比较,差异均无统计学意义(P>0.05);术后,两组患者血清TNF-α、hs-CRP、PCT、IL-10水平均增高,但观察组患者术后血清TNF-α、hs-CRP、PCT、IL-10水平均明显低于对照组,差异均有统计学意义(P<0.01)。(表3)

表3 手术前后两组患者感染指标的比较
2.4 并发症发生情况的比较
两组患者术后肺部感染、漏气、低氧血症、脓胸、心律失常发生率比较,差异均无统计学意义(P>0.05);观察组死亡0例,对照组死亡1例,两组比较,差异无统计学意义(P>0.05)。(表4)

表4 两组患者并发症发生情况
3 讨论
传统开胸手术可有效切除肺部肿瘤,效果确切,但术后并发症发生率高,影响患者术后康复[5]。近年来,随着微创手术在临床的广泛应用,术者经验不断积累,操作水平逐渐提高,熟练程度逐渐加深,其临床疗效逐渐得到认可,可与传统开胸手术媲美[6-8]。
临床对胸腔镜手术是否能有效清除淋巴结一直存有较大争议,本研究中观察组术中淋巴结清扫数目与对照组无明显差异,提示胸腔镜下肺癌切除术可对病灶、周围淋巴结进行有效清除,疾病控制率满意。胸腔镜放大作用可扩大手术视野,精确找到淋巴结位置,同时胸腔镜手术术中出血少,视野清晰,为术中准确清扫淋巴结提供了有力的条件[9-10]。本研究中观察组术后肺功能指标FEV1、PFEV1/pred、FEV1/FVC水平均高于对照组,且手术时间、拔管时间、住院时间均明显短于对照组,术中出血量、术后3天引流量均明显少于对照组,VAS评分明显低于对照组,提示胸腔镜下肺癌切除术可大大缩短手术时间,减少术中出血量,减轻术后患者疼痛程度,使患者痛苦小、恢复快。胸腔镜肺叶切除术切口小,操作简单,通过有效利用胸腔镜等仪器,保证手术视野清晰,并能显示更深层次组织,减少对肺的损伤和术中出血量,促进患者术后恢复。由于胸腔镜手术创伤小,对免疫系统损伤也明显减小,患者术后肺部感染率明显降低[11-13]。本研究中两组患者术后肺部感染率比较差异虽无统计学意义,且观察组为1.96%,对照组为5.77%,均处于较低水平,提示胸腔镜手术与开胸手术均具有较高的安全性。以上结果证实完全胸腔镜下肺癌切除术治疗具有较高可行性、有效性和安全性,这一点也在多数临床研究中得到证实[14-16]。
TNF-α、hs-CRP、PCT、IL-10是炎性因子,可反映机体创伤程度、炎性反应和免疫反应状态,患者手术时受到创伤程度越严重,血清TNF-α、hs-CRP、PCT、IL-10水平越高[17-18]。本研究两组患者术后血清TNF-α、hs-CRP、PCT、IL-10水平均出现不同程度升高,提示手术创伤可引起机体炎性因子释放,诱导炎症免疫反应发生,而观察组患者血清TNF-α、hs-CRP、PCT、IL-10水平均明显低于对照组,提示胸腔镜手术可降低手术带来的炎性创伤,术后患者整体免疫状态较好,炎性反应轻微,感染率更低。本研究观察组术后肺部感染率较低,与该组患者血清低水平TNF-α、hs-CRP、PCT、IL-10结果相吻合。有研究同样显示完全胸腔镜肺叶切除手术可显著减轻手术对机体的创伤,降低手术对肿瘤周围正常组织的影响,术后患者应激反应程度更轻微[19-20]。
综上所述,本研究结果显示完全胸腔镜引导下的肺癌切除术短期疗效优于传统开胸手术,且创伤小,术后恢复快,并发症发生率低,对感染指标影响小,是值得临床推广的术式。

