液相色谱-串联质谱法测定血浆中甲氧基肾上腺素和甲氧基去甲肾上腺素
李 艳,许舒欣,刘海培,张远清,胡 玮,李小强,程文播*
(1.天津国科医工科技发展有限公司,天津 300399; 2.中国科学院苏州生物医学工程技术研究所,江苏苏州 215163;3.天津大学精密仪器与光电子工程学院,天津 300072)
嗜铬细胞瘤和副神经节瘤(Pheochromocytoma and Paraganglioma,PPGL)是一种源于肾上腺髓质或肾上腺外交感神经链的肿瘤,主要合成并分泌儿茶酚胺,进而引起高血压等症状,并造成心、脑、肾等严重并发症[1]。患者一般早期没有明显症状,直到肿瘤已经转移到身体的其他部位才被诊断出来,所以早期诊断对于神经内分泌肿瘤的治疗和预后具有十分重要的意义。
儿茶酚胺类物质作为神经递质和激素,可调节人体的基本生理功能,传递生理信号,其代谢物甲氧基肾上腺素(Metanephrine,MN)和甲氧基去甲肾上腺素(Nometanephrine,NMN)是肾上腺素和去甲肾上腺素的中间代谢产物,它们仅在肾上腺髓质和PPGL内代谢生成并且以高浓度水平持续存在,是PPGL的特异性标记物,可以提高PPGL的检出率,降低假阴性结果[2 - 6]。因此,测定血浆或尿液中的MN和NMN成为了诊断PPGL的首选生化检测。尿液样本检测需要收集24 h的样本,而血浆中的MN和NMN检测更加适用于临床。MN和NMN的结构见图1。
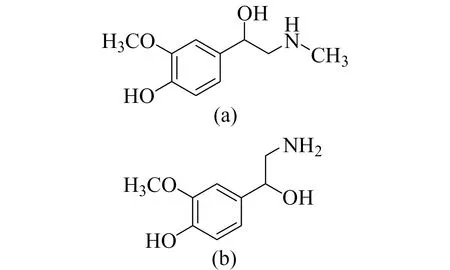
图1 MN(a)和NMN(b)的结构式Fig.1 The structure of MN (a) and NMN (b)
检测血浆中MN和NMN的方法中,最常用的是高效液相色谱法及高效液相色谱和电化学联用检测法,但存在灵敏度低,样本需求量大,前处理时间长,组分干扰强等弊端,无法满足临床检测需求[7 - 10]。基于免疫的检测方法由于交叉反应和非特异性的结合会导致检测准确度低,且不同的免疫测试,其结果不能相互比较,故不具备普适性[11]。液相色谱-串联质谱(Liquid Chromatography-Tandem Mass Spectrometry,LC-MS/MS)技术成为了定量检测生物样本中微量目标分析物的强有力手段[12 - 14]。本文基于液相色谱-串联质谱联用技术对血浆中的甲氧基肾上腺素和甲氧基去甲肾上腺素进行定量测定。
1 实验部分
1.1 仪器与试剂
LC-20AXR液相色谱仪(日本,岛津公司);API4000三重四极杆质谱仪(美国,AB Sciex公司);5427R离心机(德国,Eppendorf有限公司);VORTEX-5旋涡混合器(其林贝尔仪器公司);Multi SPE-M96固相萃取装置(天津博纳艾杰尔科技有限公司);固相萃取微孔板(PWCX 96微孔板)规格为5 mg/1mL/well(天津博纳艾杰尔科技有限公司)。
标准品:甲氧基肾上腺素、甲氧基去甲肾上腺素(加拿大,Toronto Research Chemicals公司);内标:甲氧基肾上腺素-d3盐酸盐、甲氧基去甲肾上腺素-d3盐酸盐(美国,Cambridge Isotope Laboratories公司)。甲醇、乙腈、甲酸铵、NH4Ac(美国,Fisher Chemical公司)。高纯水是符合国家际准(GB/T 6682-2008)的一级水。
配制标准曲线的生物基质为空白人血清(美国,Golden West Diagnostics公司),待测血浆样本采集自健康志愿者。
1.2 溶液的配制
称取标准品甲氧基肾上腺素(MN)、甲氧基去甲肾上腺素(NMN)各5 mg,用含甲酸的乙腈溶液进行稀释,得到20、50、200、500、800、2 000、4 000、5 000、10 000 pg/mL系列浓度标准品溶液。甲氧基肾上腺素-d3盐酸盐(MN-d3)、甲氧基去甲肾上腺素-d3盐酸盐(NMN-d3)通过稀释得到的浓度分别为400 ng/mL和800 ng/mL。
1.3 样品处理
取500 μL待测样品,加入10 μL内标溶液,再加入500 μL的NH4Ac溶液,混匀后,采用固相萃取分离富集,主要步骤如下:(1)活化:先用200 μL甲醇活化,再用200 μL NH4Ac溶液活化。(2)上样:把预处理的样品分两次上样,每次500 μL,施加正压全部压下。(3)淋洗1:向每孔加入500 μL乙腈,正压压下。(4)淋洗2:向每孔加入500 μL水溶液,正压压下。(5)洗脱:向每孔中加入100 μL 2%甲酸乙腈溶液,正压压下收集。收集液供LC-MS/MS测定。
1.4 LC-MS/MS条件
色谱柱:艾杰尔的Venusil XBP Silica柱(100 mm×2.1 mm,3 μm);流动相:甲酸-甲酸铵溶液(A相)和甲酸-水-甲酸铵乙腈溶液(B相)。梯度洗脱程序:0~0.01 min,100%B;0.01~1.5 min,60%B;1.5~2.4 min,60%B;2.4~2.5 min,100%B;2.5~4 min,100%B。流速:0.6 mL/min;进样量:10 μL;柱温:40 ℃。质谱条件:电喷雾离子源(ESI);检测方式:多反应监测(MRM);气帘气(CUR)68.9 kPa,喷雾器(GS1)482.3 kPa,辅助加热气(GS2)344.5 kPa,温度(TEM)550 ℃,离子化电压(IS)5 500 V,碰撞气(CAD)27.5 kPa。每种化合物的母离子、子离子、驻留时间、锥孔电压、碰撞能量等质谱参数见表1。
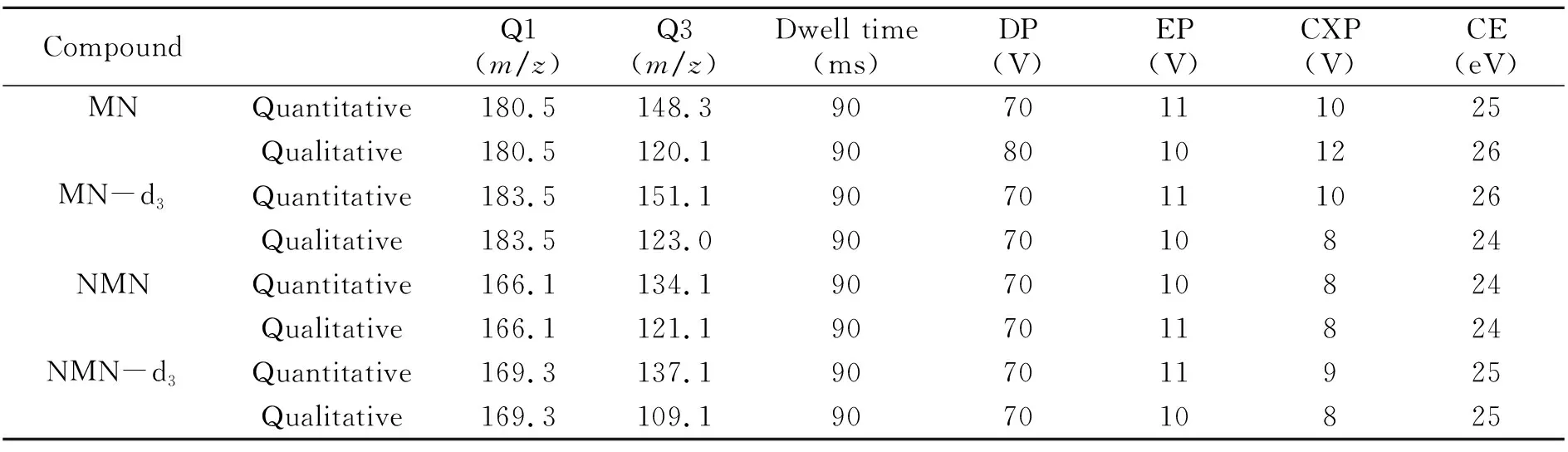
表1 质谱采集参数
2 结果与讨论
2.1 基质效应评价
通过柱后灌注法对基质效应进行评价[15]。测试的样本包括用于配制标准曲线的空白血清样本以及生物样本。目标分析物MN、NMN为内源性小分子,在考察生物样本的基质效应情况时以同位素内标(IS)的出峰行为推测目标分析物的基质影响情况。由图2(a)可知,MN、MN-d3保留时间为2.10 min,NMN、NMN-d3保留时间为2.09 min;图2(b)为空白人血清样本,通过柱后灌注,可以看出在分析物的出峰位置2.09~2.10 min处,没有出现如0.5~0.6 min明显的信号下降趋势,也没有出现明显的信号上升趋势。由此可判断在分析物的出峰位置,没有发生明显的离子抑制或增强现象,故表明不存在明显的基质效应;图2(c)为人血浆样本,由于分析物为内源性物质,故只需要考察同位素内标在出峰位置处的响应程度,由图可知在分析物的出峰位置2.09~2.10 min处,没有出现如0.5~0.6 min、0.7~0.8 min明显的信号下降和上升趋势。由此可判断在分析物的出峰位置,没有发生明显的离子抑制或增强现象,故表明不存在明显的基质效应。
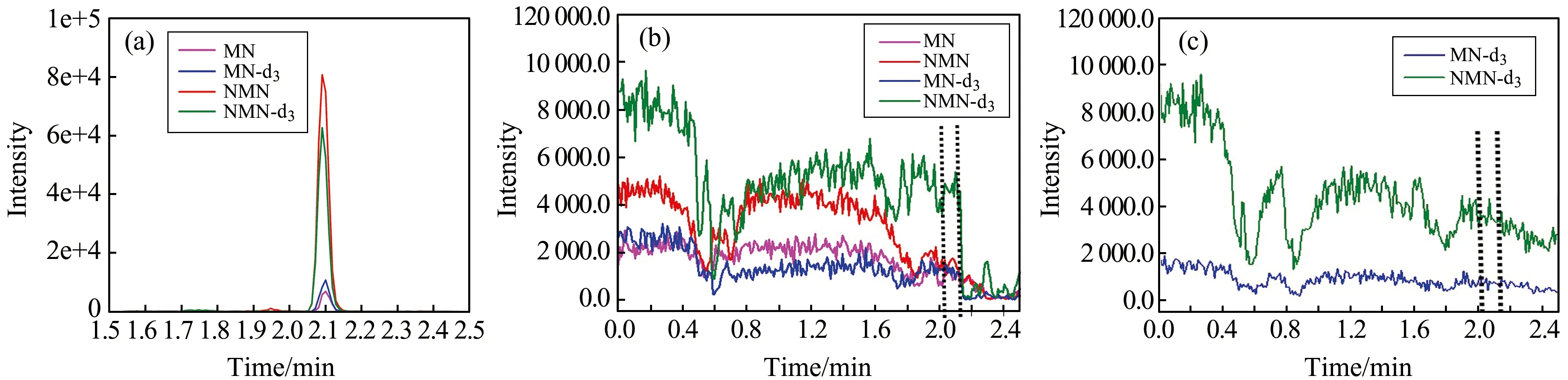
图2 标准品(a)空白人血清柱后灌注标准品(b)和血浆柱后灌注内标(c)的色谱图Fig.2 Chromatograms of standard substance(a),post-column infusion of MN/NMN-free human serum(b) and post-column infusion of IS in plasma sample(c)
2.2 线性范围及定量限
根据MN和NMN的临床检测需求确定检测范围[1],以及优化条件下浓度x为横坐标,峰面积比值y为纵坐标拟合工作曲线,结果呈良好的线性关系,如图3。MN的线性范围为50~10 000 pg/mL,线性方程式为:y=0.00151x+0.00766(R=0.9998);NMN的线性范围为50~10 000 pg/mL,线性方程式为:y=0.00432x-0.00633(R=0.9991)。此外,该检测方法与其他方法相比,具有更宽的线性范围,检出时间更短(表2),可以更好地满足临床的应用需求。
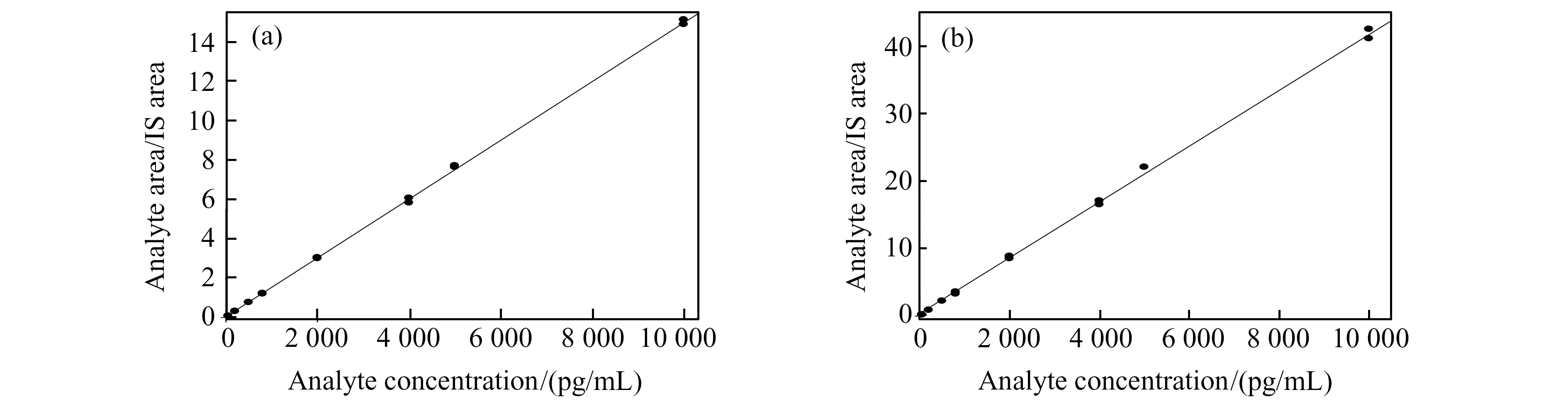
图3 MN(a)和NMN(b)的线性关系图Fig.3 The linear equations of MN(a) and NMN (b)
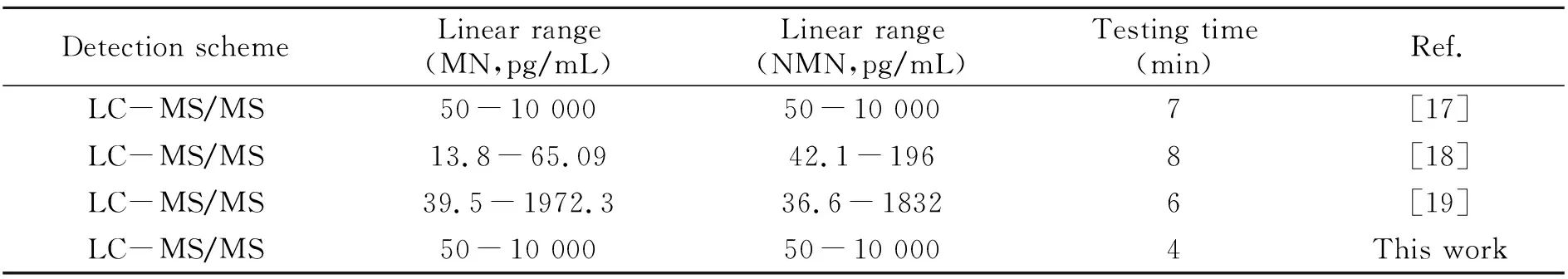
表2 MN和NMN含量测定的不同方法比较
根据MN和NMN的临床检测需求[16]以及仪器的灵敏度,将方法的定量限(LOQ,S/N≥10)定为MN 20 pg/mL,NMN 20 pg/mL,每个浓度检测10次,考察检测值和理论值的偏差以及测试结果的变异系数(CV)(表3)。由结果可知准确度偏差均在15%以内,测试的平行样本CV值在15%以内,表明该方法的定量限MN为20 pg/mL、NMN为20 pg/mL符合临床检测方法学要求。
2.3 精密度和准确度
选取低、中、高三个浓度评价方法的精密度,每个批次每个浓度样本分5次进行处理,连续测定3个批次,总样本数为45份,分别评估每个浓度样本的批内精密度和批间精密度以及总精密度。结果表明批内精密度、批间精密度以及总精密度偏差均在15%以内,表明该方法符合临床检测方法学要求。
采用真实混合人血浆的加标回收率来评价方法的准确度。每个浓度做三个平行样,考察加标回收率和检测结果的变异系数CV,见表3。由结果可知,加标回收率均在±15%以内,回收率的变异系数CV值在15%以内。表明该方法的准确度符合临床检测方法学要求。
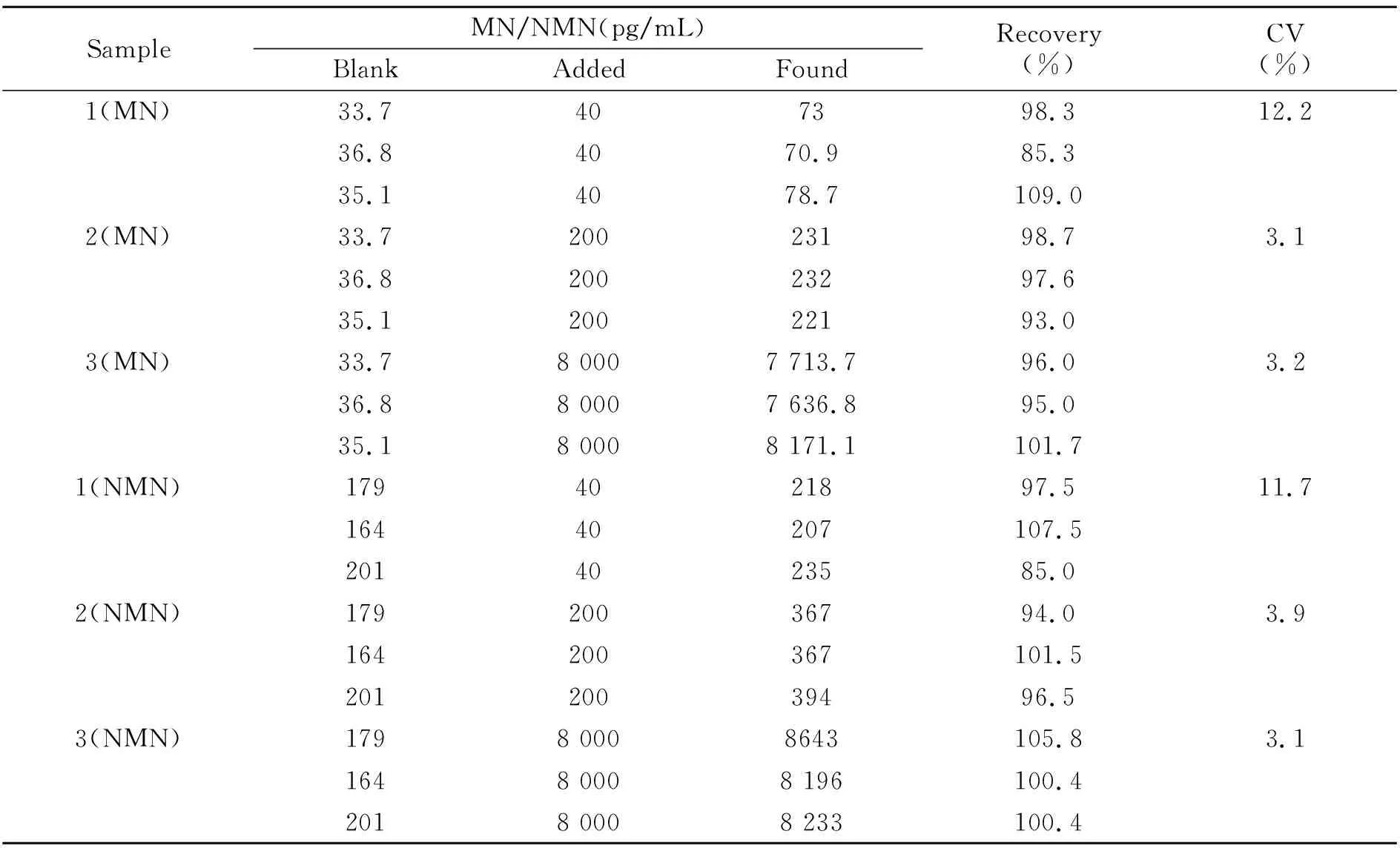
表3 血浆中MN和NMN的加标回收率
3 结论
建立了可以定量测定人血浆中甲氧基肾上腺素和甲氧基去甲肾上腺素的分析检测方法。结果表明该方法灵敏度高、特异性强、准确度高、检测时间短,可以满足临床的检测需求。

