葛花中异黄酮类活性成分的分离及鉴定
吴 桐,黄 彧,侯万超,夏建丽,刘春明,李赛男
(长春师范大学中心实验室,吉林长春 130032)
葛花(PuerariaeFlos)为豆科植物野葛的干花蕾,又名葛条花,具有降低血压[1]、扩张冠状动脉血管、增加冠状动脉血流量[2]、解酒保肝[3]、抗炎解热、抗氧化等作用,是中国传统医学中具有代表性的解酒药物[4]。异黄酮类化合物,如鸢尾苷元和鸢尾苷,是葛花的主要有效成分之一[5]。现代药理研究表明,异黄酮类化合物可以通过激活肝脏内的ADH和ALDH活性来解酒,从而保护胃黏膜,因此葛花作为异黄酮含量丰富的植物,开发利用价值较高[6]。由于传统中药成分复杂,分离难度较大,因此,建立一个快速筛选分离中药活性成分的方法是必要的。
传统的分离葛花异黄酮方法有硅胶柱色谱法、中低压柱色谱法、高效液相色谱法[7,8],这些常规方法存在耗时长、死吸附大的缺点造成样品的缺失。高速逆流色谱(HSCCC)具有进样量大、分离能力强、样品损失小、样品回收率高等优点,克服了固相载体对样品的吸附损失、变性等缺点[9],已被广泛应用于天然药物成分的分析鉴定及分离制备[10]。超滤活性筛选法是一种以生物靶分子为目标,快速筛选天然药物活性成分的一种方法[11]。使用超滤技术可以更快速的发现天然药物中的活性成分。超高效液相色谱-串联质谱(UPLC-MS/MS)技术可提供准确、可靠的相对分子质量及一些结构信息,在各领域中发挥着重要作用[12,13]。
本研究采用高速逆流色谱及超滤质谱联用技术,从葛花粗提物中分离鉴定得到染料木苷、鸢尾苷、葛根素(图1)三个高纯度异黄酮单体化合物,旨在为葛花异黄酮类活性化合物的分离与纯化提供科学有效的技术支持。
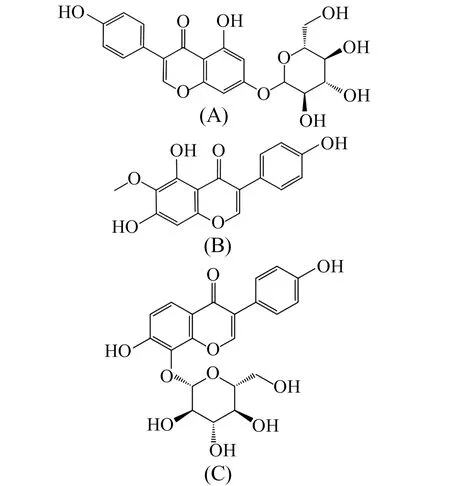
图1 化合物染料木苷(A)、鸢尾苷(B)和葛根素(C)的结构Fig.1 Chemical structures of genistin(A),tectorigenin(B) and puerarin(C)
1 实验部分
1.1 主要仪器、试剂与材料
Waters 2695高效液相色谱仪(美国,Waters公司);TBE300A高速逆流色谱仪(上海同田生物有限公司);UPLC-Q-Extractive超高效液相色谱-高分辨质谱联用仪(美国,Thermo Scientific公司);离心机(美国,Sigma公司);超滤离心管(德国,Merck Millipore公司)。
α-葡萄糖苷酶(E.C.3.2.1.20),乳酸脱氢酶(美国Sigma公司);乙腈为色谱纯(美国Thermo Fisher公司);其它试剂均为分析纯(北京化工厂);实验用水为超纯水(美国Millipore公司)。
葛花购自与北京同仁堂药店(长春店),经长春师范大学中心实验室刘春明教授鉴定,确认为豆科植物野葛的干花蕾。
1.2 样品制备
精确称取葛花200 g,用15倍量的70%乙醇回流提取三次,每次2.0 h,过滤,合并滤液并浓缩,所得浸膏用石油醚多次萃取,合并多次萃取后的水相提取物,将其减压浓缩至干后,放置干燥箱中,备用。
1.3 葛花提取物α -葡萄糖苷酶、乳酸脱氢酶抑制剂的超滤技术研究
1.3.1 样品溶液的配制准确称取葛花粗提物50 mg,溶于50%的甲醇水溶液中,配成50 mg/mL的溶液待用。
1.3.2 超滤条件20 μL 50 mg/mL样品溶液分别与90 μL 0.2 U/mLα-葡萄糖苷酶、0.5 U/mLα-葡萄糖苷酶、1.0 U/mLα-葡萄糖苷酶,在100 μL NH4Ac缓冲溶液水浴锅中,于37 ℃孵化30 min,将未结合的小分子与结合的复合物通过超滤膜分离。20 μL 50 mg/mL样品溶液分别与90 μL 0.2 U/mL乳酸脱氢酶、0.5 U/mL乳酸脱氢酶、1.0 U/mL乳酸脱氢酶,在100 μL磷酸盐缓冲溶液(PBS)水浴锅中;于37 ℃时孵化30 min,将未结合的小分子与结合的复合物通过超滤膜分离。在室温下,用30 kD超滤膜过滤,滤后溶液以3 000 r/min离心10 min。加入100 μL 50%甲醇水溶液冲洗结合的化合物,离心10 min,若膜上还残留有结合的复合物则重复上一步骤。空白组实验用相同体积的NH4Ac缓冲溶液及PBS替代酶,其他条件与实验组相同,最后得到的溶液用高效液相色谱法检测。
1.4 高速逆流色谱(HSCCC)分离
配制体积比乙酸乙酯∶乙醇∶水=4.0∶0.5∶3.0(V/V/V)的三相溶剂系统,充分振摇后静止过夜。分出上、下相,使用前分别用超声脱气30 min。取200 mg葛花粗提物,溶于8.0 mL的上/下相(1∶1,V/V)混合溶剂系统中,振荡使之完全溶解。将上相(固定相)以20 mL/min的流速泵入高速逆流色谱仪的螺旋管中。待上相充满螺旋管,使转速稳定在800 r/min后,以1.2 mL/min的流速泵入下相(流动相),当有下相从出口流出即螺旋管的上下相已达到平衡时,将样品溶液从进样圈注入高速逆流色谱仪。开启检测器和记录仪,检测波长为265 nm,根据色谱峰收集馏分。
1.5 高效液相色谱(HPLC)条件
色谱柱:SunFireTMC18柱(250 mm×4.6 mm,5 μm),以乙腈(A)和0.05%H3PO4水溶液(B)作为液相色谱流动相,进行二元线性梯度洗脱,流动相梯度程序:0~5 min,90~80%B;5~20 min,80~77%B;20~35 min,77~50%B;35~40 min,50~50%B;流速0.8 mL/min;进样量为10 μL;检测波长:265 nm;柱温:30 ℃。
1.6 超高速液相色谱-串联质谱(UPLC-MS/MS)条件
流动相A为0.1%甲酸水,流动相B为乙腈。梯度程序:0~5 min,95%~90%A;5~8 min,90%~87%A;8~16 min,87%~86%A;16~24 min,86%~76%A;24~32 min,76%~68%A;32~36 min,68%~60%A;36~50 min,60%~50%A;50~60 min,50%~39%A;流速:0.4 mL/min;进样量:1.0 μL;柱温:25 ℃。质谱为电喷雾离子源、负离子模式(ESI-);扫描范围:m/z150~2 000;离子阱条件:离子源喷雾电压4.5 kV,鞘气辅助气为氮气,流速为20 L/min,离子阱压力331.7 Pa;金属毛细管温度350 ℃,金属毛细管电压3.5 V。
2 结果与讨论
2.1 葛花提取物的超滤质谱活性筛选
我们利用超滤色谱技术对葛花粗提物的α-葡萄糖苷酶抑制活性进行了研究,结果见图2。由图2可以看出,葛花粗提物中的化合物与0.5 U/mLα-葡萄糖苷酶的结合效果最好,葛花粗提物对酶的抑制率可以通过下式计算:抑制率(%)=(A对照-A实验)/A对照×100%。式中,A对照为不加α-葡萄糖苷酶反应后的峰面积,A实验为加入α-葡萄糖苷酶反应后的峰面积。
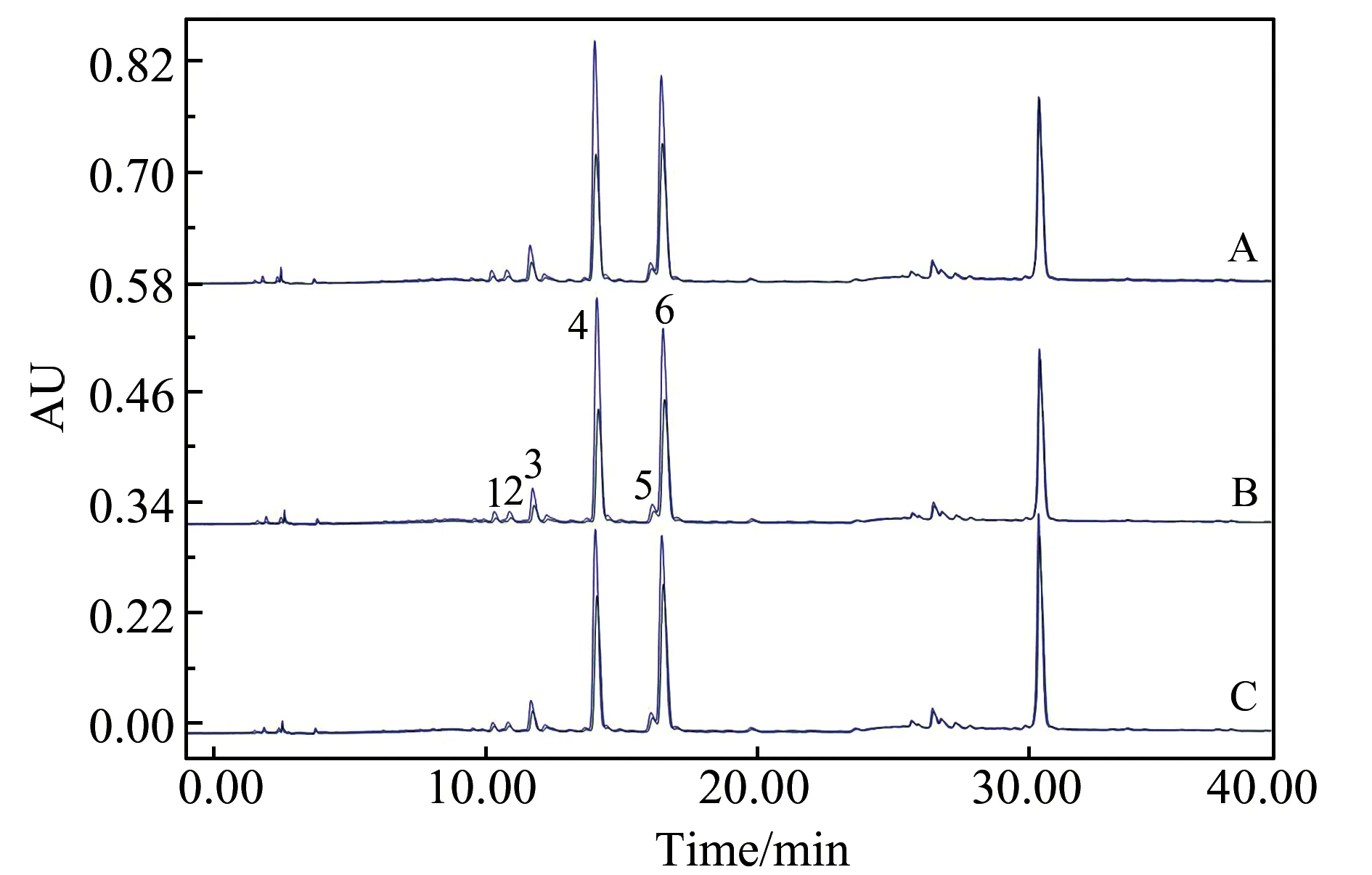
图2 葛花提取物与0.2 U/mL(A)、0.5 U/mL(B)和1.0 U/mL(C) α -葡萄糖苷酶结合的色谱图Fig.2 Chromatograms of the extract of P.Flos with 0.2 U/mL(A),0.5 U/mL(B) and 1.0 U/mL(C) α -glucosidase inhibitors
通过进行体外活性实验发现,葛花中6个化合物具有α-葡萄糖苷酶的抑制活性。化合物的抑制活性顺序为:化合物4>化合物6>化合物3>化合物5>化合物1>化合物2。表1数据表明,加α-葡萄糖苷酶的样品中化合物的色谱峰面积均明显高于空白对照组。抑制率分别为48.41%、42.16%、38.47%、31.27%、30.69%和28.75%。证明葛花中的化学成分与α-葡萄糖苷酶具有生物亲和能力,可以抑制α-葡萄糖苷酶生物活性,具有潜在的抗糖尿病活性。
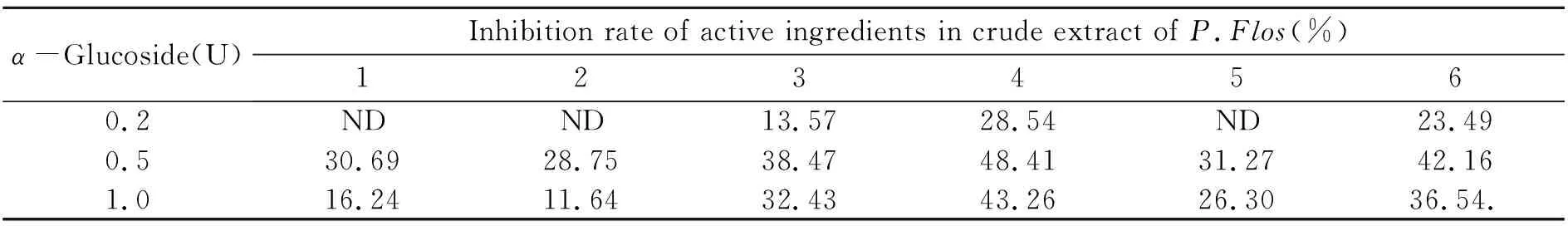
表1 受体结合能力通过液相色谱信号增强因子的表达
利用超滤色谱技术对葛花粗提物的乳酸脱氢酶(LDH)抑制活性的研究结果见图3。由图3可以看出,葛花粗提物中的化合物与1.0 U/mL LDH的结合效果最好。通过进行体外活性实验发现,葛花中6个化合物具有LDH的抑制活性。化合物的抑制活性顺序为:化合物4>化合物6>化合物3>化合物5>化合物2>化合物1。表2的数据表明,加LDH的样品中化合物的液相色谱峰面积均明显高于空白对照组。抑制率分别为28.26%、25.73%、24.54%、18.61%、16.34%和15.67%。证明葛花中的化学成分与LDH具有生物亲和能力,可以抑制LDH生物活性,具有潜在的抗脑卒中活性。
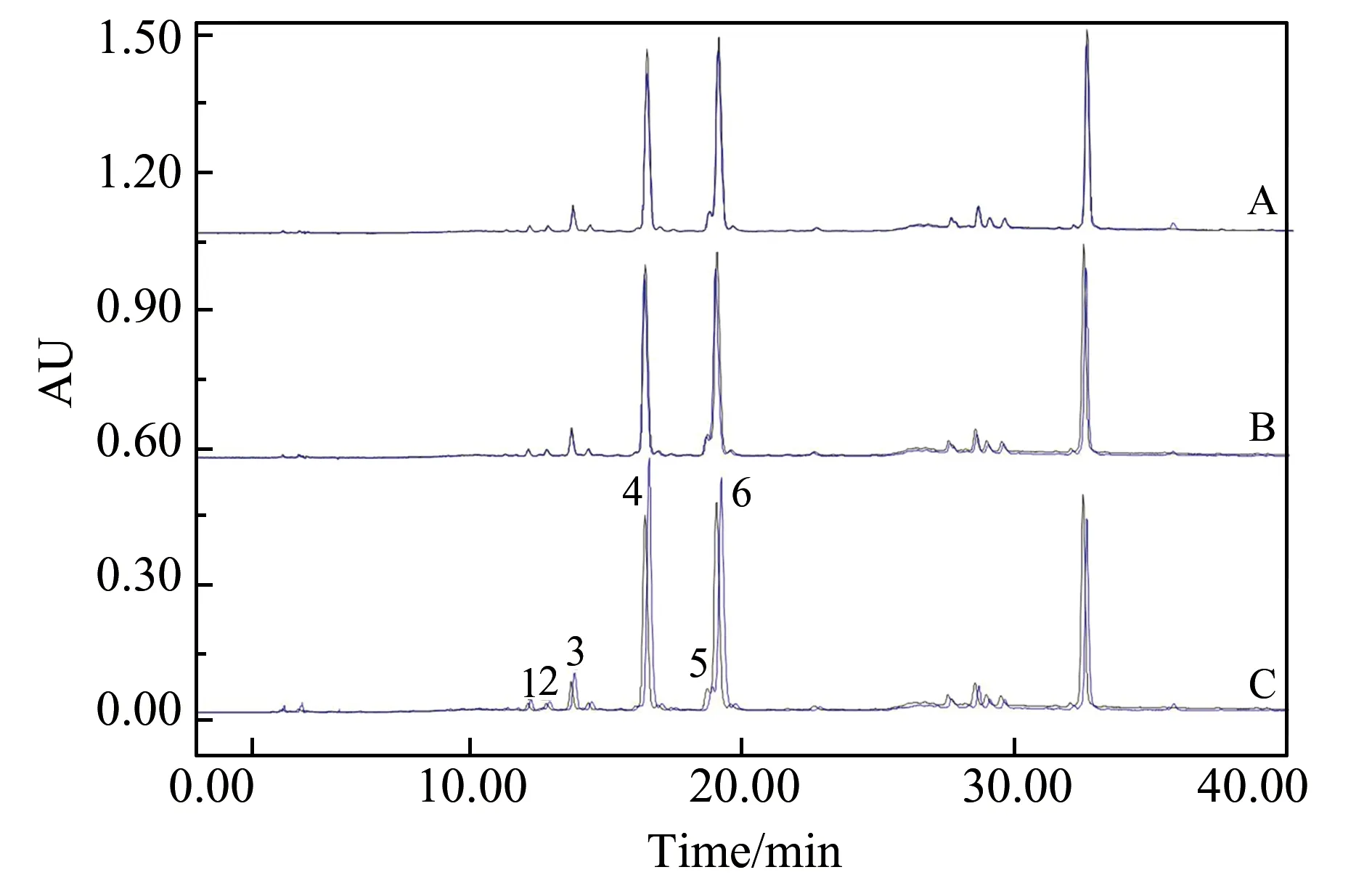
图3 葛花提取物与0.2 U/mL(A)、0.5 U/mL(B)和1.0 U/mL(C)乳酸脱氢酶结合的色谱图Fig.3 Chromatograms of the extract of P.Flos with 0.2 U/mL(A),0.5 U/mL(B) and 1.0 U/mL(C) LDH inhibitors

表2 受体结合能力通过液相色谱信号增强因子的表达
2.2 高速逆流色谱(HSCCC)对葛花中活性成分的分离
根据文献报道,HSCCC最适合的K值范围是0.5~2.0[16]。本研究中根据所分离化合物的特性,考察了乙酸乙酯-正丁醇-水、正己烷-乙酸乙酯-正丁醇-水、乙酸乙酯-乙醇-水、石油醚-乙酸乙酯-甲醇-水等溶剂系统的分配系数如表3。从表3中可以看出,当溶剂系统为乙酸乙酯-乙醇-水(4.0∶0.5∶3.0,V/V/V)时,三个异黄酮类化合物能够在短时间内实现高效分离纯化,一次就可以得到三个高纯度单体化合物。实验中还对流动相的流速进行了优化,最终选择流速为1.2 mL/min。在上述优化的条件下,HSCCC分离得到3个较明显的峰。分别收集这3个峰,采用“1.5”节条件,运用HPLC技术对收集到的三个峰的纯度进行了检测,得到三个单体化合物,根据面积归一化法,其纯度依次为90.60%、99.00%和91.73%,如图4所示。此结果表明,利用HSCCC对葛花中异黄酮类的化学成分进行大量制备分离的方法切实可行。
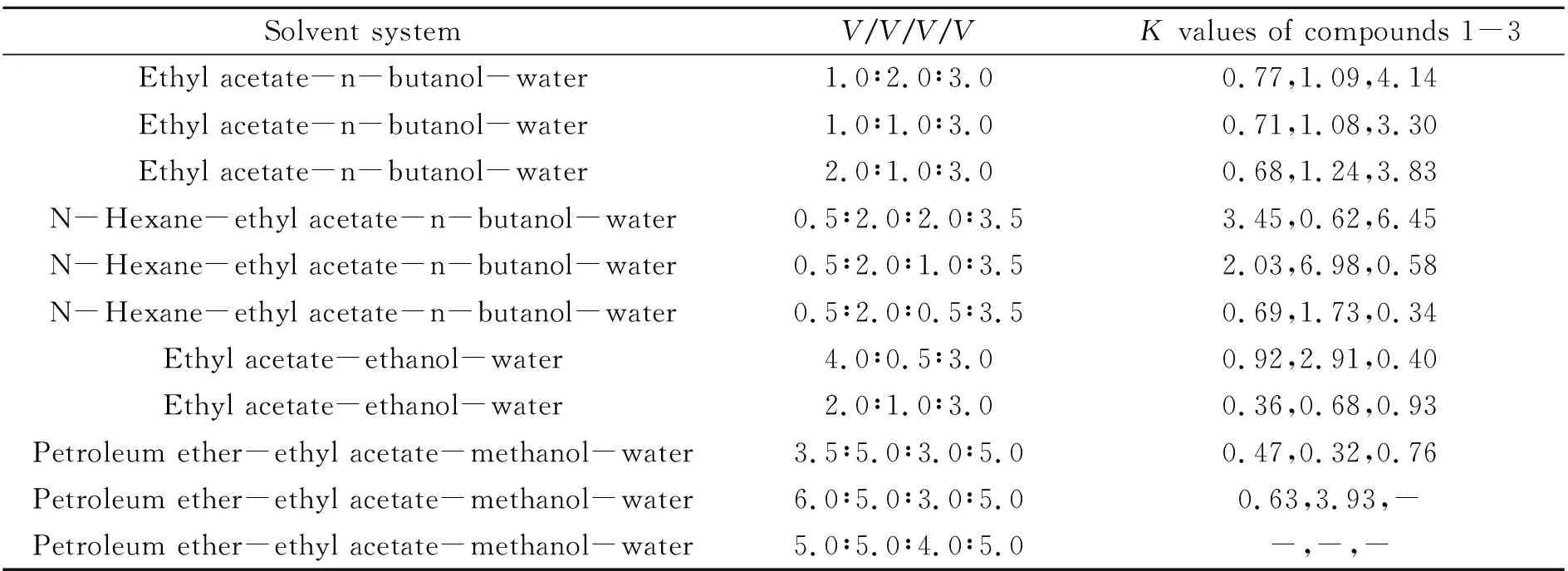
表3 葛花中异黄酮类成分在不同溶剂系统中的分配系数(K)
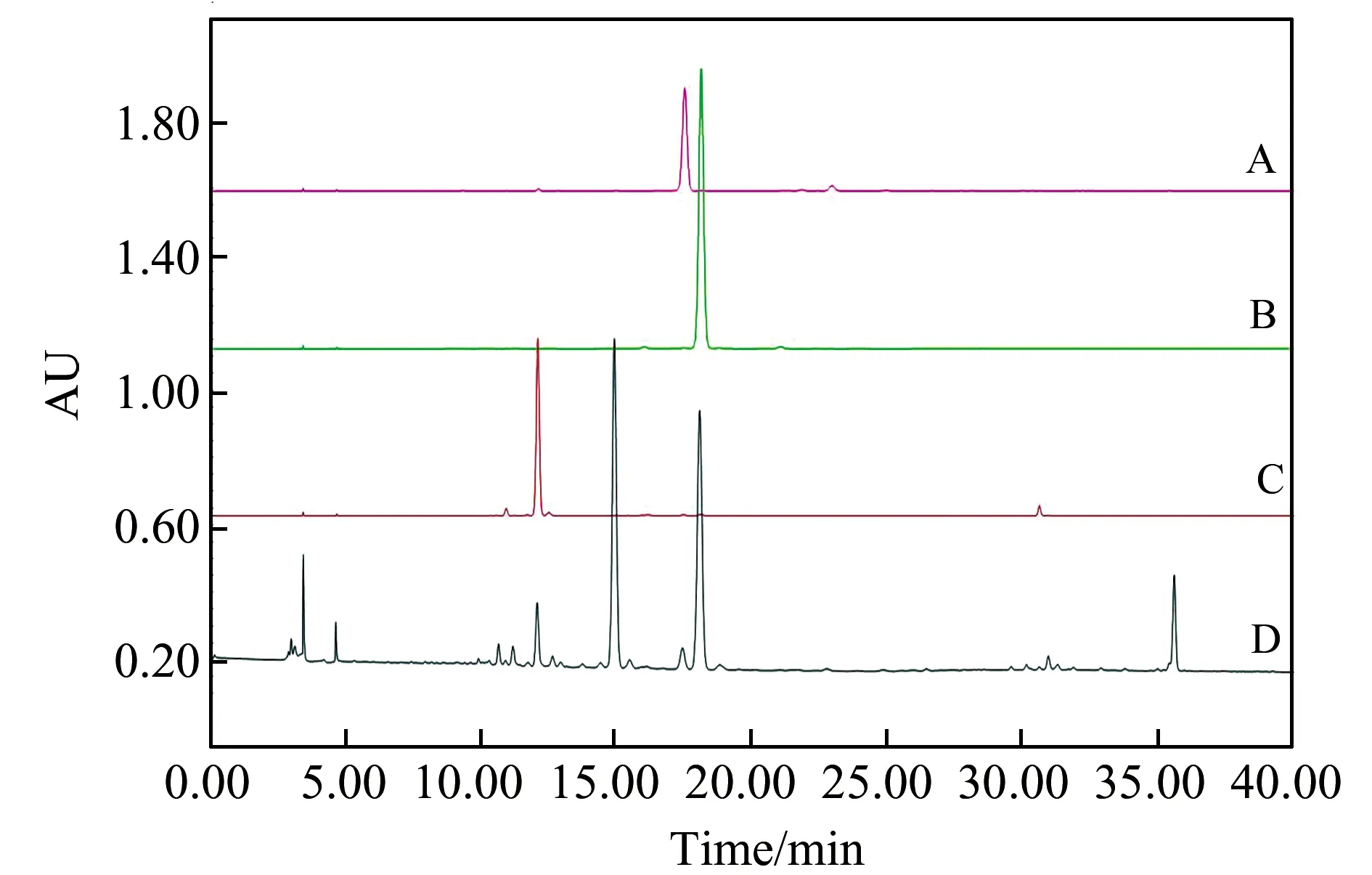
图4 葛花中粗提物(A)、分离得到的葛根素(B)、染料木苷(C)和鸢尾苷(D)的色谱图Fig.4 Chromatograms of crude extract(A),extracted from P.Flos and puerarin(B),genistin(C) and tectorigenin(D) isolated from P.Flos
2.3 液-质联用技术鉴定葛花中异黄酮类活性物质
为了进一步确定HSCCC得到的3个化合物结构,通过UPLC-Q-Extractive在负离子模式下对HSCCC所得的3个馏分进行初步鉴定,并结合文献报道对比保留时间和紫外最大吸收波长,最终鉴定了3个异黄酮化合物。单体化合物1的保留时间为6.19 min,准分子离子峰[M-H]-为m/z415,与文献报道的葛根素分子量一致[14]。单体化合物2的保留时间为27.80 min,准分子离子峰[M-H]-为m/z299,与文献报道的鸢尾苷分子量一致[15]。单体化合物3的保留时间为19.95 min,准分子离子峰[M-H]-为m/z431,与文献报道的染料木苷的分子量一致[16],结果见图5。
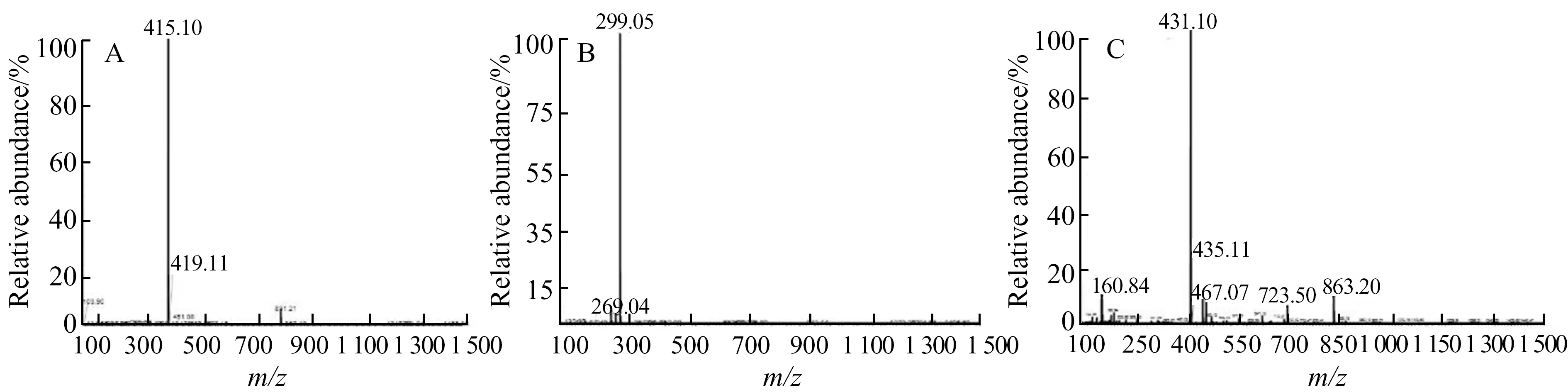
图5 化合物1(A)、2(B)和3(C)的电喷雾质谱图Fig.5 Electrospray mass spectra of compounds 1(A),2(B) and 3(C) in anionic mode
2.4 核磁共振波谱鉴定葛花中异黄酮类活性成分
化合物1核磁共振数据分析结果如下:ESI-MS:415[M-H]-;1H-NMR(400MHz,DMSO-d6)δ:8.06(1H,d,J=9Hz;C5-H),6.97(1H,d,J=9Hz;C6-H),7.33(2H,d,J=9Hz;C2,6-H),6.97(2H,d,J=9Hz;C3,5-H),8.12(1H,s,C2-H),5.07(1H,d,J=10Hz;C1-H).13C-NMR(125 MHz,CD3OD)δ:153.1(C-2),122.8(C-3),176.9(C-4),126.7(C-5),115.5(C-6),162.0(C-7),111.6(C-8),157.1(C-9),116.9(C-10),124.0(C-1'),130.0(C-2',6'),114.9(C-3',5'),156.6(C-4'),74.3(C-1''),71.6(C-2''),78.6(C-3''),70.3(C-4''),81.3(C-5''),61.4(C-6'')。以上测定结果与文献报道[17]的葛根素的数据相符,故确定化合物1为葛根素。
化合物2核磁共振数据分析结果如下:ESI-MS:299[M-H]-;1H-NMR(400MHz,DMSO-d6)δ:12.7(1H,s,OH-5),9.57(1H,s,OH-4'),8.41(1H,s,H-2),6.86(1H,s,H-8),7.38(2H,d,J=8 Hz,H-2',6'),6.81(2H,d,J=8 Hz,H-3',5'),3.77(1H,s,OCH3-6),5.08(1H,d,J=8 Hz,Glc-1),3.32-3.68(6H,m,Glc-2~6).13C-NMR(100 MHz,DMSO-d6)δ:154.7(C-2),122.1(C-3),180.8(C-4),152.9(C-5),132.5(C-6),156.6(C-7),94.0(C-8),152.5(C-9),106.5(C-10),121.0(C-1'),130.2(C-2',6'),115.1(C-3',5'),157.5(C-4'),100.2(Glc-1),73.2(Glc-2),76.7(Glc-3),69.8(Glc-4),77.3(Glc-5),60.7(Glc-6)。以上测定结果与文献报道[18]的鸢尾苷的光谱数据相符,故确定化合物2为鸢尾苷。
化合物3核磁共振数据分析结果如下;ESI-MS:431[M-H]-;1H-NMR(400MHz,DMSO-d6)δ:8.40(1H,S,2-H)6.45(1H,d,J=2.16Hz,6-H),6.70(1H,d,J=2.16Hz,8-H),7.39(2H,dd,J=6.68,1.96Hz,2',6'-H),6.80(2H,dd,J=6.68,1.96Hz,3',5'-H).13C-NMR(100MHz,DMSO-d6)δ:153.5(C-2),122.4(C-3),180.2(C-4),162.2(C-5),99.2(C-6),162.7(C-7),94.6(C-8),157.6(C-9),104.5(C-10);121.7(C-1'),130.2(C-2'),115.4(C-3'),157.9(C-4'),115.4(C-5'),130.2(C-6');101.6(C-1''),73.3(C-2''),77.6(C-3''),68.7(C-4''),78.7(C-5''),61.2(C-6'')。以上测定结果与文献报道[19]的染料木苷的光谱数据相符,故确定化合物3为染料木苷。
3 结论
本文运用高速逆流色谱和超滤质谱联用的方法对葛花粗提物进行了活性成分的筛选和分离,共分离出3种α-葡萄糖苷酶抑制剂以及3种乳酸脱氢酶抑制剂,纯度均达到90.0%以上。对分离得到的三种化合物运用液-质联用及核磁共振波谱技术进行结构解析,成功鉴定出3种化合物分别为染料木苷、鸢尾苷、葛根素。该联用方法可广泛应用于对异黄酮类生物靶分子相互作用的药物筛选分离及鉴定工作。

