溶液中褐藻胶低聚糖在活性炭上的吸附特性与机制研究
于 宇, 曹为安
(青岛农业大学 海洋科学与工程学院, 山东 青岛 266237)
褐藻胶(Alginate)是一种来源于褐藻细胞壁的酸性多糖, 通常从巨藻、海带和马尾藻等褐藻中提取得到[1]。褐藻胶是由 β-1, 4-D-甘露糖醛酸(M)和 α-1,4-L-古罗糖醛酸(G)两种糖醛酸单体连接而成的直链多糖。褐藻胶低聚糖(Alginate oligosaccharides, AOS)是褐藻胶经过降解而得到的一种低分子聚合物, 降解后水溶性提高。研究表明, AOS具有促进植物生长[2], 增强植物抗盐[3]、抗旱[4]、抗有机污染物[5]、抗重金属污染等活性, 还具有抑菌[6]、抗肿瘤[7]、抗氧化[8-9]、增强免疫力[10]、保护神经[11]等多种生物活性, 在食品、医药、饲料添加、植物生长调节等领域应用前景广阔。AOS经褐藻胶降解而制备得到, 常用的降解方法有物理降解法、化学降低法和酶降解法[12]。在褐藻胶提取和降解的过程中, 会产生一系列不同聚合度的AOS以及蛋白、色素等其他杂质。对AOS进行分离纯化, 获得纯度高、单一聚合度的AOS对于揭示其化学结构与其生物活性间的构效关系具有重要意义[9,13]。
活性炭作为一种最常见的吸附剂, 具有多孔结构, 比表面积大。同时活性炭表面有丰富的官能团, 对气相和液相中多种有机物和无机物具有良好的吸附能力[14-15]。活性炭被广泛应用于多糖和寡糖物质的分离纯化过程, 比如应用于离子交换色谱分离后的壳寡糖组分的脱盐纯化[16], 应用活性炭柱对岩藻多糖组分进行初步分离[17], 用活性炭对提取的褐藻胶粗多糖进行脱色处理等[18]。但在以往实践中, 活性炭分离纯化糖类物质的过程中样品损失严重。应用活性炭分离纯化糖类物质的原理是基于活性炭对糖的吸附反应, 但目前尚未见关于酸性糖在活性炭上吸附机制与性能的研究报道。因此研究活性炭对于酸性低聚糖的吸附性能对于应用活性碳分离纯化酸性低聚糖具有重要的指导作用。
本研究以一种酸性低聚糖AOS为研究对象, 研究溶液的pH、反应时间、反应温度、初始浓度等条件对AOS在活性炭上吸附性能的影响, 进而揭示活性炭吸附AOS的动力学与热力学机制。本研究对于应用活性炭对AOS及其他海洋酸性多糖进行分离、脱色、脱盐等具有重要的指导意义。
1 材料与方法
1.1 实验试剂
AOS购于青岛博智汇力生物科技有限公司,分子量6 000 Da。活性炭Darco G-60购于Sigma化学有限公司(美国), 粒度为 100目。实验中所用的硫酸和苯酚为优级纯试剂, 其他化学试剂均为分析纯试剂。
1.2 吸附实验

式中,C0为AOS溶液的初始浓度 (g/L),Ct为吸附后溶液中AOS浓度(g/L),V为溶液体积(L),m为活性炭质量(g)。
研究溶液 pH对吸附性能的影响时, 将 AOS溶液的pH用稀HCl或稀NaOH调节至1~12, 在25℃下以上述过程进行吸附实验。吸附动力学研究在2 g/L,25℃和pH 5条件下进行批量吸附实验, 在不同的吸附时间(5, 10, 20, 30, 40, 60, 120, 180, 240, 360 min)取出锥形瓶迅速过滤, 测定滤液中AOS浓度以研究不同吸附时间下的吸附量。吸附热力学研究中, AOS初始浓度为1, 1.5, 2, 2.5, 3, 3.5 g/L, 溶液pH为5, 分别在25, 35, 45, 55℃温度下进行吸附实验, 以研究初始浓度和温度对于吸附的影响。
准确量取15 mL 2 g/L的 AOS溶液置于150 mL锥形瓶中, 加入0.25 g活性炭, 将锥形瓶置于恒温水浴振荡器在25℃下振荡12 h以达到吸附平衡。振荡结束后过滤吸附液, 采用苯酚-硫酸法测定滤液中AOS浓度[19]。AOS在活性炭上的吸附量q(g/g)用以下公式计算:
2 结果和讨论
2.1 pH对吸附效果的影响
溶液pH条件会影响活性炭和吸附质的特性, 进而影响液相中活性炭的吸附行为[20-21]。本文研究了pH 1~12条件下, AOS在活性炭上的吸附容量变化,结果如图1所示。AOS在活性炭上的吸附量随溶液pH的增大而迅速降低, 酸性条件有利于活性炭吸附AOS, 吸附量在pH为1时达到最大值0.116 g/g。AOS糖环结构中含有—COOH基团, 强酸性的条件下其解离减弱, 以分子形式存在的羧酸增加, 减少了其与活性炭表面的静电排斥作用, 因此酸性越强,其在活性炭上的吸附量越大。pH 5为褐藻胶低聚糖溶液的初始 pH值, 最为常用, 且在 pH 5条件下,AOS的吸附量(0.082 g/L)已达到最大吸附容量的71%, 因此后续实验不再进行 pH调整, 均在此 pH的条件下进行。

图1 不同pH条件下AOS在活性炭上的吸附量(g/g)Fig.1 Adsorption capacities (g/g) of AOS on activated charcoal in the solutions with different pH values
2.2 吸附动力学研究
为了研究活性炭对于AOS的吸附机制, AOS初始浓度2 g/L, pH 5, 25℃条件下进行了吸附动力学实验研究。吸附量随时间变化曲线如图 2所示。在初始5 min, 吸附量迅速增加, 在第5 min, 吸附量已达0.059 5 g/g, 达到平衡吸附量的71%。5~60 min, AOS在活性炭上的吸附量增加缓慢, 在60 min以后吸附量基本保持稳定, 达到吸附平衡, 最大吸附量为0.083 7 g/g。

图2 反应时间对AOS在活性炭上的吸附量(g/g)的影响Fig. 2 Effects of contact time on the adsorption capacity(g/g) of AOS on activated charcoal
吸附动力学模型可以更好地反映吸附机制,AOS吸附量随时间的变化曲线分别用准一级动力学和准二级动力学模型进行拟合。准一级吸附动力学模型假设吸附速率与吸附剂上未占用位点的数目成正比[22], 公式如下:式中qe和qt分别是平衡时和t时间时的单位吸附量(g/g), k1是一级吸附速率常数(1/min),t为反应时间(min)。

准二级吸附动力学模型假设吸附速率与未占用吸附位点的数目的平方成正比[23], 公式如下:

其中qe和qt分别表示平衡时和t时间的单位吸附量(g/g), k2为准二级吸附速率常数(g/g min),t为反应时间(min)。以t和t/qt分别为横纵坐标作图, 拟合线性关系根据斜率和截距分别计算qe和k2值。
吸附动力学模型拟合结果如图3和表1所示。用准二级动力学模型拟合的相关系数更高,R2=1, 且计算得到的吸附容量qe(0.083 4 g/g)与实验值(0.083 7 g/g)更加符合。因此AOS在活性炭上的吸附过程符合准二级吸附, 表明吸附过程不是简单的物理吸附, 还存在化学吸附, AOS与活性炭间的化学吸附是吸附过程的限速步骤[23]。

图3 吸附动力学曲线Fig. 3 Adsorption kinetic plots: (a) pseudo first-order model;(b) pseudo second-order model

表1 活性炭吸附AOS的动力学参数Tab. 1 Kinetic parameters for the adsorption of AOS on activated charcoal
2.3 吸附等温线
温度会影响活性炭的吸附性能。分别在 25℃,35℃, 45℃, 55℃温度下进行了不同初始浓度(1, 1.5,2, 2.5, 3, 3.5 g/L)下的吸附实验, 吸附等温线如图4a所示。AOS在活性炭上的吸附量随着初始浓度增大而升高。随着温度升高, 相同初始浓度下的吸附量降低, 表明AOS在活性炭上的吸附为放热反应。这与Li等[24]报道的活性炭吸附中性糖-菊糖同样为放热反应的过程相似。
Langmuir 和Freundlich方程是常用的研究吸附热力学反应的模型, 分别用这两个模型来研究 AOS在活性炭上的吸附热力学机制。Langmuir模型假定吸附位点活性均一, 用于描述单分子层均相吸附,其方程为:

式中,qmax是最大吸附容量(g/g), kL(L/g)为平衡常数,以Ce和Ce/qe分别为横纵坐标作图, 根据拟合的线性关系的斜率和截距分别求得qmax和kL值。
Freundlich模型假设吸附位点活性不均匀, 其方程为:

式中,Ce是吸附平衡时的AOS浓度(g/L),qe为相应平衡浓度时的吸附量(g/g), kf(L/g) 和1/n是与吸附容量和吸附强度有关的常数。以lnCe和lnqe分别为横纵坐标作图, 拟合线性关系根据斜率和截距分别求得n和kf值。
两种吸附等温线模型拟合的结果如图 4b、c和表2所示。结果显示, 在35℃, 45℃和55℃下, 吸附等温线用Langmuir模型模拟结果良好,R2大于0.99。且 Langmuir模型的R2总体优于 Freundlich模型的R2值, 表明AOS在活性炭上的吸附更符合Langmuir等温线模型, 属于单分子层的均相吸附。

表2 Langmuir和Freundlich吸附模型模拟参数Tab. 2 Parameters for Langmuir and Freundlich isotherms models

图4 AOS在活性炭上的吸附等温线(a); Langmuir等温线模型(b); Freundlich等温线模型(c)Fig. 4 Adsorption isotherms of AOS on the (a) activated charcoal; (b) Langmuir model; (c) Freundlich model
2.4 热力学计算
根据 Van’t Hoff方程及其推导公式[25], 有如下关系:
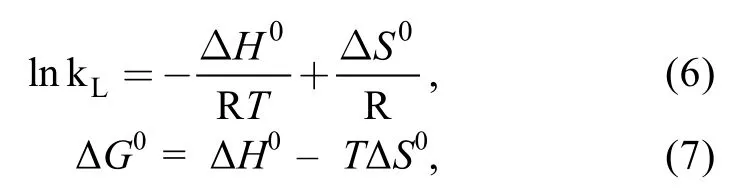
式中, R为气体常数(8.314 J/mol K),T为绝对温度(K)。以1/T和 lnkL分别为横纵坐标做图, 拟合线性关系, 如图 5所示, 根据斜率和截距可以求得反应的焓变ΔH0(kJ/mol)和熵变ΔS0(kJ/mol K)。根据公式(7)进而可以计算得到反应的吉布斯自由能ΔG0(kJ/mol)。计算结果如表 3所示。反应的 ΔH0为-35.2 kJ/mol, 证明AOS在活性炭上的吸附是放热反应。反应熵降低, ΔG0为负, 表明吸附是自发反应过程。ΔG0随温度升高而增大, 表明低温更有利于吸附反应的进行。
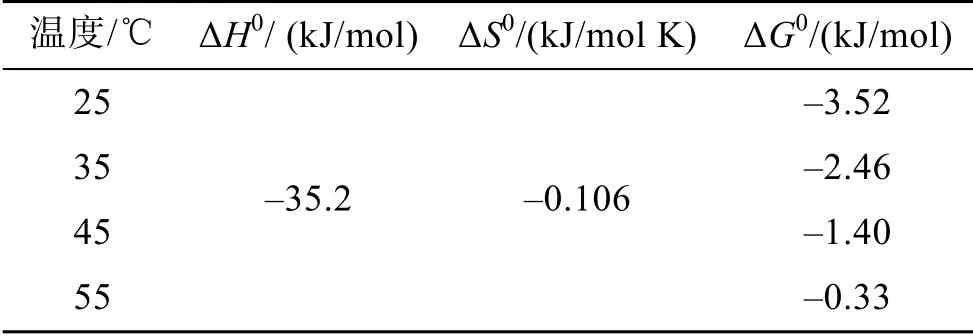
表3 不同温度下活性炭吸附AOS的热力学常数Tab. 3 Thermodynamic parameters for the adsorption of AOS on activated charcoal at different temperatures

图5 lnkL对1/T的线性关系Fig. 5 Linear correlations between lnkL and 1/T
3 结论
本研究以海洋来源酸性糖-褐藻胶低聚糖(AOS)为研究对象, 系统探讨了不同的溶液pH、反应时间、温度、初始糖浓度条件下AOS在活性炭上的吸附性能及其动力学和热力学机制。结果表明, AOS在活性炭上的吸附量随溶液pH降低而增大, pH为1时吸附量可达0.116 g/g。吸附量在最初的5分钟内达到平衡吸附量的 71%, 在 60分钟后达吸附平衡, 吸附量容量在25℃, pH 5条件下为0.083 7 g/g。吸附过程符合准二级吸附动力学(R2=1), 表明吸附过程存在化学吸附。吸附热力学研究表明AOS在活性炭上的吸附为自发的放热反应, 低温有利于吸附过程的进行,吸附等温线符合 Langmuir模型, 为单分子层的均相吸附。

