巧用守恒发速解化学题
◇ 山东 苗延强
守恒思想贯穿于整个高中阶段化学教材的学习.教师运用守恒定律,进行解题技巧教学时,要强调化学反应体系中某些相互反应的组分在发生化学反应前后的形态,进一步找出化学反应整体变化中某一个特定的等量关系,达到巧用守恒法速解化学题的目的.本文主要对高中阶段水溶液的三大守恒定律的运用进行了阐述,并将守恒定律和相关例题结合.
1 电荷守恒
电荷守恒就是指溶液中的正电荷总数与负电荷总数相等,也可说为溶液中阳离子所带的正电荷总量等于阴离子所带的负电荷总量.因此,在书写电荷守恒式时,要在全面掌握溶液中含有离子的基础上构建等式.
例如,在构建NaHS 溶液电荷守恒式时,NaHS是可溶性盐,在溶于水后完全电离,即NaHS=Na++HS-,基于已经学过的电离和水解平衡知识可知,水溶液中并不只存在两种离子,因为HS-在溶液中还有弱电离和水解,即
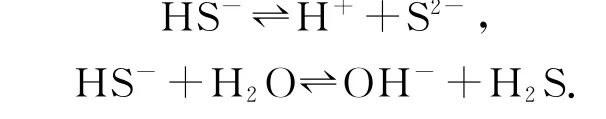
除此之外,也要考虑水自身的电离,即
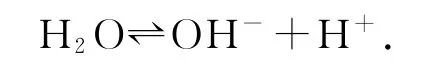
在全面考虑溶液中所有离子的情况下,可以将NaHS溶液所涉及的离子进行整理,阳离子为Na+、H+,阴离子为HS-、OH-、S2-.
基于n(正电荷)=n(负电荷)可列出n(正电荷)=n(Na+)+n(H+),n(负电荷)=n(HS-)+n(OH-)+2n(S2-),从而得出初步的电荷守恒式为

也可以用离子的浓度来表示,即
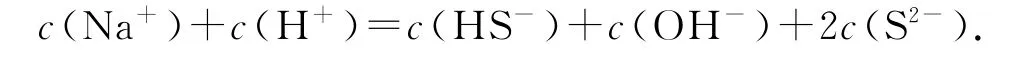
由此可以总结电荷守恒式的快速书写步骤:
1)要准确判断溶液中的所有离子,还要特别注意离子自身所带的电荷量,写出溶质的电离和水解式.
2)找出所写溶液中的所有阳离子和阴离子,将阳离子浓度写在等式左边,阴离子浓度写在等式右边.
3)在离子浓度前写上相应的系数,系数计算方法为该离子电荷量的绝对值.
2 物料守恒
物料守恒的概念为:电解质中原子的个数比在溶解前后是不会发生变化的.以NaHS 溶液为例,在NaHS溶液中Na原子与S原子的个数比为1∶1,那么其在溶解后两种原子的比例是不会发生变化的,即n(Na)=n(S).
在NaHS 溶液中,S 原子总数等于HS-、S2-、H2S微粒数之和,即

然后在等式两边同时除以NaHS 溶液体积,可得出NaHS溶液的物料守恒公式:

写物料守恒式时要注意,不能用H、O 原子和其他原子的比例进行列式.
3 质子守恒
质子守恒式的含义是溶液中所有物质得到的质子总数和所有微粒失去的质子总数相等.
还是以NaHS 溶液为例,在考虑其完全电离、HS-的弱电离和水解及水的电离后,可以发现完全电离过程中不涉及质子得失,HS-弱电离和水解是失去和得到质子的过程,水电离是一个水分子失去质子,另一个水分子得到质子的过程.即
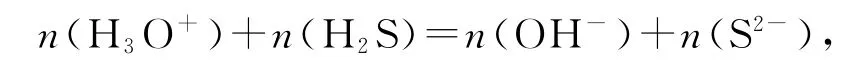
等式两边同时除以NaHS溶液体积得出质子守恒式

通常情况下,H3O+都会简写为H+,也就是

在书写质子守恒式时,相对来说比较容易,我们可以在书写完一种溶液的物料守恒和电荷守恒式后,再进行该溶液质子守恒式的推导,只要保证将不参与质子得失的微粒消去即可.
电荷守恒、物料守恒和质子守恒是高中阶段水溶液学习的三大重要的守恒定律,同时也是高考备受青睐的知识点,高中生学好三大守恒定律,能够有效解决高中化学阶段水溶液中离子平衡学习的很多难题.

