大豆多肽-锌螯合物的制备工艺优化及其结构表征
郑英敏,袁 杨,苏东晓,何 山,许庆陵,曾庆祝
(广州大学化学化工学院,广东广州 510006)
大豆分离蛋白是从大豆油脂工业副产物——豆粕中提取出的一种蛋白质[1]。作为富含人体所需的8种必需氨基酸,其含量满足人体需求的植物蛋白[2],大豆分离蛋白因其高营养价值、出色的加工性能和低成本而广泛应用于食品行业中[3]。据报道,通过Alcalase酶酶解得到的大豆多肽已被证实具有抗氧化性和ACE抑制活性[4-5],而通过Flavourzyme酶酶解的大豆蛋白水解物则具有促进脂肪代谢的生理功能[6]。
锌是人体中仅次于铁的第二大过渡金属元素,以二价阳离子形式存在,并在细胞代谢和凋亡过程包括中起着关键作用。锌是铜锌超氧化物歧化酶、碳酸酐酶、抗氧化酶和其他基质金属蛋白酶的酶促辅因子,参与碳水化合物、脂肪和蛋白质的代谢调节[7]。据报道,缺乏锌会导致多种疾病,包括生长受损、免疫系统缺陷、皮炎、腹泻、性和骨骼成熟延迟,味觉受损,妊娠结局不良以及神经行为改变等[8]。
从饮食中补充的锌元素容易与植酸形成不溶性络合物从而降低锌的生物利用度[9]。多肽在一定配比、温度、pH等条件下与微量金属离子通过螯合反应制得多肽金属离子螯合物[10]。大量研究表明,金属离子氨基酸螯合物比无机盐具有更好的稳定性,更强的抗干扰性和更高的生物利用度。乳清多肽-亚铁螯合物[11]和牡蛎-锌螯合物[12]在模拟胃肠液消化实验中比相应的无机盐显示更好的离子溶解度。在Caco-2细胞的实验中,乳清多肽的锌及钙螯合物的离子吸收明显高于无机盐[13-14]。胶原蛋白肽的钙螯合物能显著增加大鼠股骨矿物质密度和股骨钙含量[15]。Chaud等[16]通过动物实验证明,酪蛋白肽-亚铁螯合螯合物在大鼠血红蛋白转化率上与硫酸亚铁效果一致。因此,蛋白肽的金属离子螯合物形式被认为是新的营养补充剂。除此之外,多肽金属离子螯合物还显出抑菌性[17]、抗疲劳功能[18]和抗氧化性[19-20]。
已有作者如马利华[21]和赵薇等[22]研究过豆粕多肽锌螯合物的体外抗氧化性能和制备方法,但缺少对其结构的研究,因此本文通过酶解大豆分离蛋白制备大豆多肽,进而制取多肽-锌螯合物,并采用紫外光谱、傅立叶红外光谱、荧光光谱、电子扫描显微镜和Zeta电位等手段方法对大豆多肽-锌螯合物的初级结构进行表征,以期为多肽-锌螯合物的进一步深入研究奠定基础。
1 材料与方法
1.1 材料与仪器
大豆分离蛋白、氯化锌(分析纯)、溴化钾(光谱纯) 上海麦克林生化科技有限公司;Alcalase酶 2.4 L FG,诺维信生物技术有限公司;其余试剂 均为国产分析纯。
PHS-3C酸度计 上海精密科学仪器有限公司;PL403电子分析天平 梅特勒-托利多仪器有限公司;HH4C水浴振荡器 金坛市鸿科仪器厂;GL-2050MS冷冻离心机 卢湘仪仪器有限公司;SCIENTZ-18N真空冷冻干燥机 宁波新芝生物科技股份有限公司;Vivaflow200超滤膜 德国赛多利斯;NexION电感耦合等离子体质谱仪 美国PerkinElmer公司;300UV-2600紫外-可见光分光光度计 日本岛津仪器有限公司;TENSOR II+Hyperion2000傅立叶变换红外光谱仪 布鲁克公司;F-4500荧光分光光度计 日本日立公司;JSM-7001F扫描电子显微镜 日本JEOL公司;Nano-2s ZEN3600纳米粒度电位仪 英国马尔文仪器有限公司。
1.2 实验方法
1.2.1 大豆多肽制备 将大豆分离蛋白溶解在蒸馏水中,浓度为10%。用1 mol/L NaOH将大豆分离蛋白悬液的pH调节至8.0,并在55 ℃水浴中加热10 min,然后加入Alcalase酶,酶与底物比例为1∶50 (W/W)。然后在55 ℃和pH8.0的条件下酶解3 h。酶解结束后,将酶解液置于沸水浴中加热5 min灭酶。冷却至室温,调节pH至7.0随后8000 r/min离心15 min。取上清液经截留分子量5 kDa超滤膜分离,经冷冻干燥后即为大豆多肽[23]。
1.2.2 单因素实验
1.2.2.1 ZnCl2浓度对大豆多肽锌螯合能力的影响 称取一定质量的大豆多肽分别溶解于125、250、375、500和625 μmol/L的ZnCl2溶液中,使大豆多肽浓度为1 mg/mL,将混合液pH调节至4.0。将混合液置于60 ℃水浴中反应3 h。得到大豆多肽-锌螯合物溶液,经无水乙醇沉淀、冷冻干燥制得多肽-锌螯合物固体备用,并测定其锌螯合能力。
1.2.2.2 螯合温度对大豆多肽锌螯合能力的影响 称取一定质量的大豆多肽溶解于375 μmol/L的ZnCl2溶液中,使大豆多肽浓度为1 mg/mL,调节pH至4.0。将混合液置于不同温度(40、50、60、70、和80 ℃)中水浴反应3 h。得到大豆多肽-锌螯合物溶液,经无水乙醇沉淀、冷冻干燥制得多肽-锌螯合物固体备用,并测定其锌螯合能力。
1.2.2.3 pH对大豆多肽锌螯合能力的影响 称取一定质量的大豆多肽溶解于375 μmol/L的ZnCl2溶液中,使大豆多肽浓度为1 mg/mL,用1 mol/L HCl和NaOH溶液调节混合液pH(2.0、3.0、4.0、5.0和6.0)。将混合液置于60 ℃水浴中反应3 h。得到大豆多肽-锌螯合物溶液,经无水乙醇沉淀、冷冻干燥制得多肽-锌螯合物固体备用,并测定其锌螯合能力。
1.2.2.4 螯合时间对大豆多肽锌螯合能力的影响 称取一定质量的大豆多肽溶解于375 μmol/L的ZnCl2溶液中,使大豆多肽浓度为1 mg/mL,调节pH至4.0。将混合液置于60 ℃水浴中分别反应1、2、3、4和5 h。得到大豆多肽-锌螯合物溶液,经无水乙醇沉淀、冷冻干燥制得多肽-锌螯合物固体备用,并测定其锌螯合能力。
1.2.3 正交试验 以锌螯合能力为评价指标,在单因素试验基础上选取ZnCl2浓度、温度、pH、时间为试验因素,选用L9(34)正交表进行3因素3水平正交实验优化(表1),确定大豆多肽螯合锌的最佳条件。
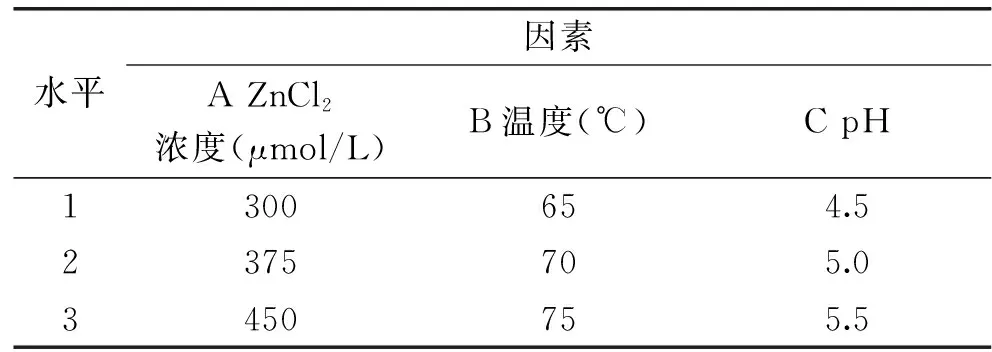
表1 正交试验因素及水平Table 1 Factors and levels of orthogonal test
1.2.4 锌螯合能力的测定 根据GB 5009.14-2017食品中锌的测定中的电感耦合等离子体质谱法法,测定单因素实验及正交试验中大豆多肽-锌螯合物固体的锌含量,结果用每克多肽上螯合的锌质量表示,即mg/g多肽。
1.2.5 大豆多肽-锌螯合物结构表征
1.2.5.1 紫外吸收光谱 取一定质量的大豆多肽及大豆多肽-锌螯合物固体溶解于去离子水中,使其浓度为1 mg/mL。在测量之前,用去离子水对紫外可见分光光度计进行基线调零,测定样品溶液190~600 nm的吸光值。
1.2.5.2 红外光谱 分别取2 mg的大豆多肽及大豆多肽-锌螯合物与200 mg光谱纯KBr于玛瑙研钵中研磨均匀。制成薄片后测定红外吸收光谱。以4 cm-1的分辨率记录样品在4000~400 cm-1的光谱,平均扫描16次。
1.2.5.3 荧光光谱 取一定质量的大豆多肽分别溶解于0、2、4、6、8和10 μmol/L ZnCl2溶液中,使其浓度为100 μg/mL,调节溶液pH至5.5,于75 ℃恒温水浴中反应1 h。样品在激发波长280 nm下测定荧光光谱[24]。
1.2.5.4 扫描电子显微镜 取一定量大豆多肽、大豆多肽-锌螯合物粉末于导电胶上,经喷金镀膜处理后放入扫描电镜抽真空,观察样品形貌。
1.2.5.5 Zeta电位 分别称取一定质量的大豆多肽和大豆多肽-锌螯合物溶解于去离子水中,使其浓度为1 mg/mL,用HCl或NaOH将溶液pH调节至2.0、3.0、4.0、5.0、6.0、7.0和8.0,测定其Zeta电位。
1.3 数据处理
2 结果与分析
2.1 单因素实验结果
2.1.1 ZnCl2浓度对大豆多肽锌螯合能力的影响 由图1可知,ZnCl2浓度在125~375 μmol/L范围,大豆多肽锌螯合能力随ZnCl2浓度的上升而增大。当ZnCl2浓度为375 μmol/L时,大豆多肽螯合能力为(16.76±0.35) mg/g。由此可知,当ZnCl2浓度为375 μmol/L时,大豆多肽中的锌螯合位点已达到饱和状态。所以在后续的正交实验中,选择ZnCl2浓度为375 μmol/L。
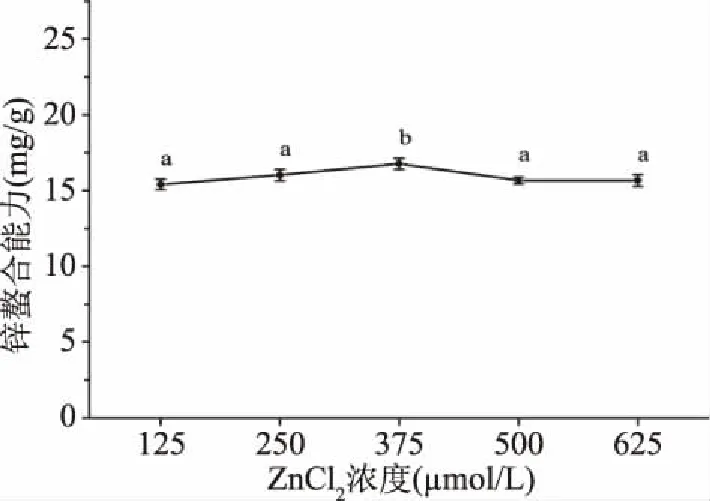
图1 ZnCl2浓度对大豆多肽锌螯合能力的影响Fig.1 Effect of ZnCl2 concentration on zinc-chelating capacity of soy peptides 注:不同小写字母表示显著性差异(P<0.05);图2~图4同。
2.1.2 螯合温度对大豆多肽锌螯合能力的影响 由图2可知,温度对大豆多肽锌螯合能力的影响较大。随着温度的增加,大豆多肽的锌螯合能力也随之增加,在70 ℃时达到最大(24.65±0.48 mg/g),随后下降。在40~70 ℃内,反应温度越高,螯合反应的反应速率和平衡系数越大,然而,过高温度会导致多肽变性,从而导致大豆多肽锌螯合能力下降[25]。因此,选择70 ℃进行后续实验。
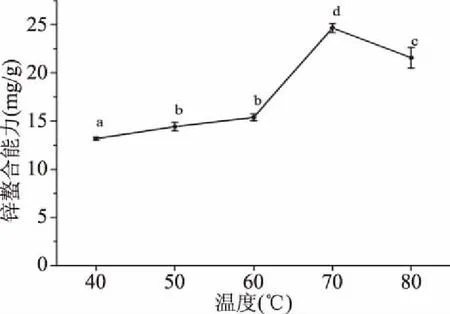
图2 温度对大豆多肽锌螯合能力的影响Fig.2 Effect of temperature on zinc-chelating capacity of soy peptides
2.1.3 pH对大豆多肽锌螯合能力的影响 图3展现了不同pH下的多肽锌螯合能力。在pH5.0时多肽的锌螯合能力达到最大,为(18.05±0.59 mg/g)。当pH小于5.0时,多肽的锌螯合能力随着pH的减小而下降,这是因为H+会与金属离子竞争给电子基团,使多肽的锌螯合能力降低[26]。当pH大于5.0时,多肽的锌螯合能力也减小,因为反应体系中的Zn2+与OH-生成不溶性Zn(OH)2沉淀,使得体系中的Zn2+不能充分与大豆多肽进行螯合反应[12]。因此选择pH5.0进行后续实验。
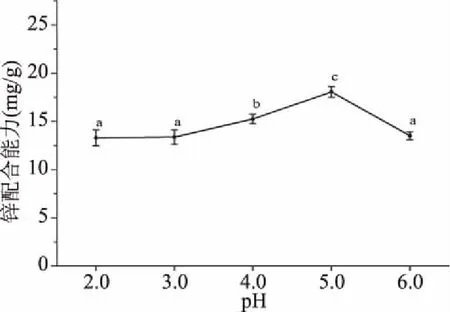
图3 pH对大豆多肽锌螯合能力的影响Fig.3 Effect of pH on zinc-chelating capacity of soy peptides
2.1.4 螯合时间对大豆多肽锌螯合能力的影响 从图4得知,大豆多肽与锌的螯合能力随着螯合时间的上升而上升,在反应为3 h时达到最大值(16.04±0.63 mg/g),随后下降。然而反应时间的改变对大豆多肽的锌螯合能力影响并不显著。因此在后续的正交实验中将选择1 h作为螯合时间,并不再作为后续正交实验的实验因素。
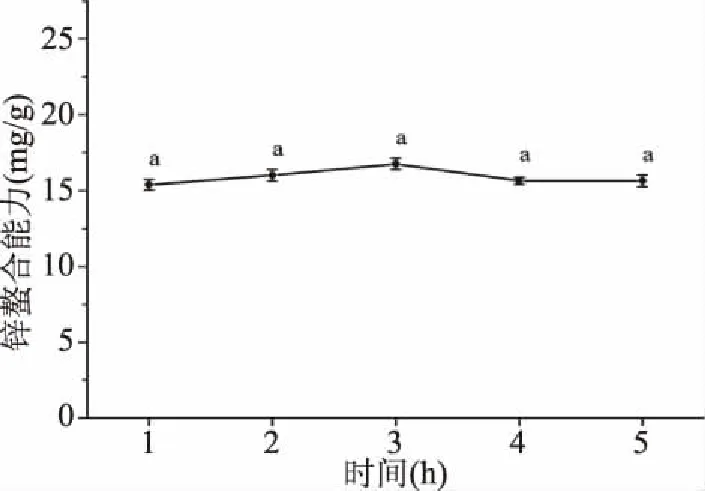
图4 时间对大豆多肽锌螯合能力的影响Fig.4 Effect of time on zinc-chelating capacity of soy peptides
2.2 正交实验结果
由表2中R值可知,试验中温度对大豆多肽锌螯合能力影响最大,其次为pH,最后是ZnCl2浓度。由正交实验结果可知,最佳的反应条件为第7组A3B1C3,即ZnCl2浓度450 μmol/L,温度65 ℃,pH5.5。但通过极差分析得到的优方案为A3B3C3,即ZnCl2浓度450 μmol/L,温度75 ℃,pH5.5。再就这两组方案进行对比实验,最终确定出最优反应条件为A3B3C3,在此条件下大豆多肽螯合能力为(26.96±1.22) mg/g。
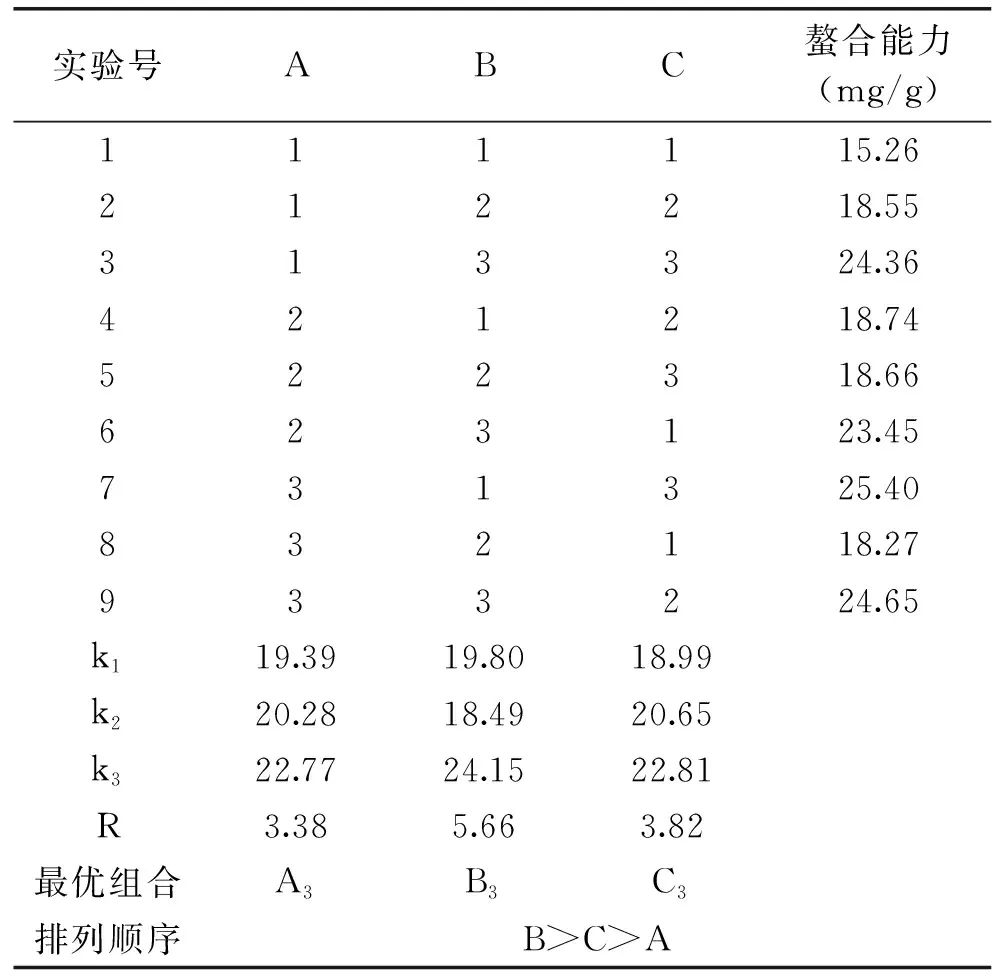
表2 大豆多肽锌螯合能力正交优化试验结果Table 2 Results of zinc-chelating capacity of soy peptides by orthogonal optimization test
2.3 大豆多肽-锌螯合物结构表征
2.3.1 紫外吸收光谱 图5为大豆多肽和大豆多肽-锌螯合物的紫外吸收光谱。大豆多肽在205 nm处出现强的吸收峰,在273 nm处出现一个弱吸收峰。这两个吸收峰分别是由肽键的发色基团(C=O)发生π→π*跃迁和酪氨酸中的苯环引起的[27-28]。而大豆多肽-锌螯合物的紫外吸收峰发生明显的移动和强度变化。大豆多肽-锌螯合的最大吸收峰移动至224 nm,吸收强度降低,而较弱的吸收峰发生蓝移且吸收强度增大。结果表明,当大豆多肽-锌螯合物生成,发色基团(-C=O,-COOH)和助色基团(-OH,-NH2)发生偏振变化[29]。黄瓜种子肽-钙螯合物[28]和猪骨胶原肽-钙螯合物[30]也呈现出相似的紫外光谱。紫外光谱的变化证明大豆多肽和锌离子之间发生了螯合反应。
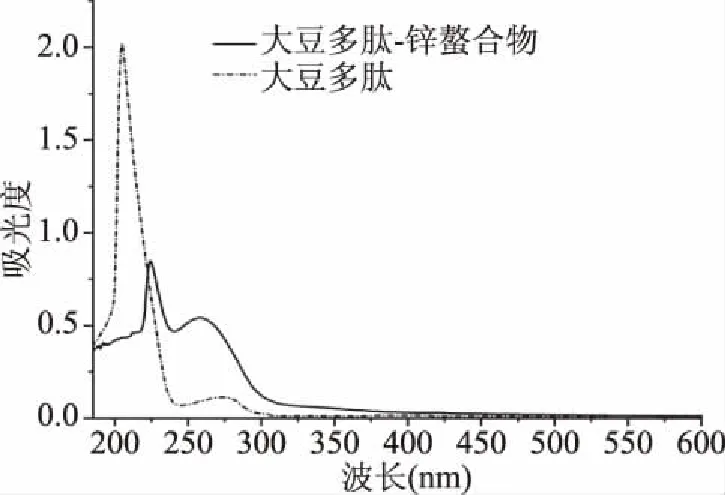
图5 大豆多肽-锌螯合物及大豆多肽紫外吸收光谱Fig.5 UV spectra of soy peptides-Zn chelate and soy peptides
2.3.2 傅立叶红外光谱 图6为大豆多肽及大豆多肽-锌螯合物的红外光谱。在大豆多肽的红外光谱中,出现了由N-H键的拉伸振动引起的吸收峰[12,31](3471.62 cm-1),而在大豆多肽-锌螯合物中该吸收峰移动至3417.27 cm-1。这表明感应效应或偶极场效应改变了-NH2的电子云密度[27],说明-NH参与了多肽与锌离子的螯合反应。在大豆多肽的红外光谱中,波长为1657.81 cm-1的吸收峰对应-C=O[27,32]。在大豆多肽-锌螯合物中,该吸收峰移动至1650.65 cm-1;出现了一个由-COO-Zn引起的新吸收峰[33](1242.64 cm-1),以上表明多肽中的羧基为螯合位点之一。与锌离子螯合后,大豆多肽中的吸收峰(864.70和529.70 cm-1)分别移动至857.54和536.86 cm-1,这说明多肽与锌离子的螯合反应使-N-H电子云密度降低[29]而-O=C-NH2电子云密度增加[33]。总结红外光谱结果,可以推断出大豆多肽与锌离子的螯合位点为羧基、氨基以及肽键[14,34]。
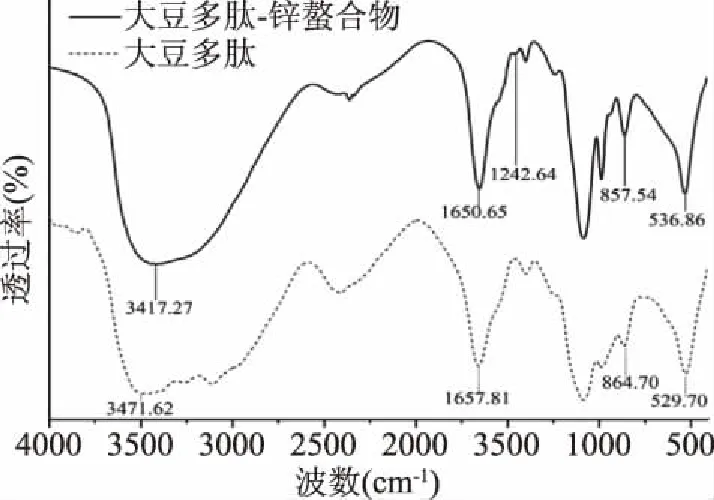
图6 大豆多肽-锌螯合物及大豆多肽红外光谱Fig.6 FTIR spectra of soy peptides-Zn chelate and soy peptides
2.3.3 荧光光谱 苯丙氨酸、酪氨酸和色氨酸等芳香族氨基酸可以产生内源性荧光,因此可以用荧光光谱来探究蛋白质或多肽和其他物质间的相互作用[14]。在280 nm激发波长下,发射峰305和348 nm分别对应酪氨酸和色氨酸[29]。从图7中可得知,随着Zn2+浓度的增加,大豆多肽-锌螯合物在305和348 nm出的荧光强度逐渐下降,这是由锌离子导致多肽的折叠造成的[24]。根据Beyer等[35]的报道,金属离子能促进多肽的折叠。因此多肽和锌离子的螯合反应使多肽发生折叠,从而使荧光强度略微下降。
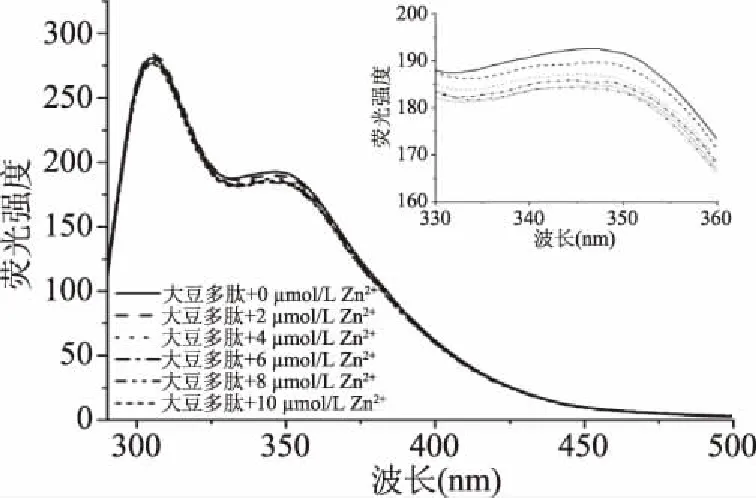
图7 大豆多肽-锌螯合物及大豆多肽红外荧光光谱Fig.7 Fluorescence spectra of soy peptides-Zn chelate and soy peptides
2.3.4 扫描电子显微镜 图8分别为大豆多肽粉末及大豆多肽-锌螯合物粉末的形态图。可以看出,二者均为不规则的颗粒体,大豆多肽粉末为比较平滑的块状外观,而大豆多肽-锌螯合物粉末则呈现出颗粒凹凸状态。有文献报道,金属离子能使Aβ肽迅速聚集,形成寡聚物[36]。Dionisio等[37]指出锌离子可能在两个多肽的结合位点上充当桥接配体。因此,可以推测,大豆多肽粉末和大豆多肽-锌螯合物粉末的形貌区别可能是由于多肽与锌离子发生了螯合反应,形成了多肽-锌螯合物微颗粒。

图8 大豆多肽及大豆多肽-锌螯合物扫描电子显微镜图谱Fig.8 SEM of soy peptides and soy peptides-Zn chelate
2.3.5 Zeta电位 图9为大豆多肽和大豆多肽-锌螯合物在不同pH下的Zeta电位。可以看出,大豆多肽和大豆多肽-锌螯合物的Zeta电位变化程度不同,当pH超过2.7,大豆多肽-锌螯合物的Zeta电位开始低于大豆多肽的Zeta电位。在本实验的pH范围内,随着pH的增加,多肽-锌螯合物的稳定性比大豆多肽差,说明锌离子和多肽的部分基团结合形成螯合物以后促进了聚集作用的发生,更加有利于形成微颗粒[38]。
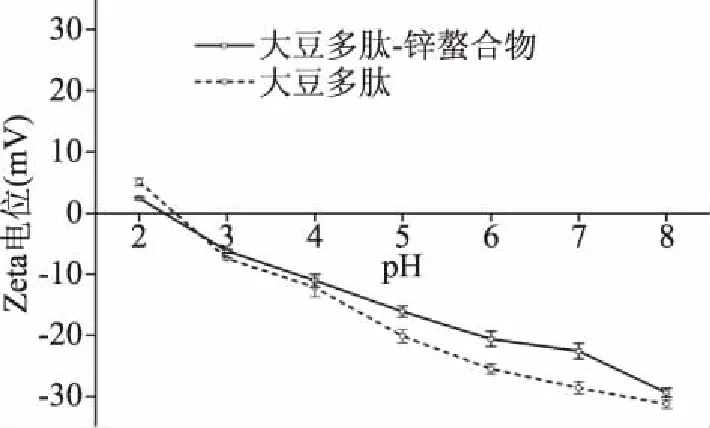
图9 大豆多肽及大豆多肽-锌螯合物在不同pH下的Zeta电位曲线Fig.9 Zeta potential curve of soy peptides and soy peptides-Zn complex at different pH values
3 结论
本研究通过单因素及正交试验确定大豆多肽-锌螯合物的制备条件为:多肽与锌的反应温度75 ℃,溶液pH5.5以及氯化锌浓度为450 μmol/L。在此条件下的锌螯合能力为(26.96±1.22) mg/g。通过紫外吸收光谱和红外光谱确定生成了大豆多肽-锌螯合物,其螯合位点为多肽的羧基、氨基和肽键。荧光光谱、电子扫描显微镜和Zeta电位的结果表明,在Zn2+与大豆多肽的螯合过程中,受到Zn2+的影响,加强了多肽分子内和分子间的相互作用,从而促进折叠和聚集形成多肽-锌螯合物的微颗粒。基于大豆多肽的锌螯合物为开发新的锌补充剂提供了研究思路和理论基础。

