鳀鱼鱼肉与白鲢鱼鱼糜混合热聚集行为分析
,*
(1.渤海大学食品科学与工程学院,国家鱼糜及鱼糜制品加工技术研发分中心,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013; 2.蓬莱京鲁渔业有限公司,山东烟台 265600)
鳀鱼,是一种常见的低值海水鱼。近十年,国内鳀鱼的捕捞量每年为70万吨左右[1]。鳀鱼不仅味道鲜美而且营养丰富,其蛋白质含量占总质量的12%~18%,含有各种必需氨基酸,是一种优质的动物性蛋白[2]。白鲢鱼,是一种常见的淡水鱼。近十年,国内白鲢鱼的养殖量每年为400万吨左右[1]。虽然白鲢鱼的产量很大,但是凝胶特性较常见的阿拉斯加鳕鱼、金线鱼等海水鱼的差,且具有土腥味,严重影响了其鱼糜制品的品质[3]。鱼肉中的蛋白质主要分为三类:盐溶性蛋白、水溶性蛋白和不溶性蛋白,其中含量最多的是盐溶性蛋白中的肌原纤维蛋白[4]。鱼糜凝胶的形成过程实质上是肌原纤维蛋白的热聚集过程,其凝胶性能决定了鱼糜制品的口感和品质。
鱼糜的原材料以海水鱼为主,个体较大的海水鱼资源正日趋匮乏,而个体较小的低值海水鱼产量丰富[5]。将合适比例的淡水鱼和海水鱼进行混合,是提高混合体系凝胶特性的一种有效措施。国内外学者对混合鱼糜的凝胶特性及其热聚集行为进行了许多的研究。陈汉勇等[6]将带鱼鱼糜分别添加到红杉鱼糜和罗非鱼鱼糜中,两种鱼糜的凝胶特性均得到了改善。当青花鱼鱼糜与短鲭鱼以1∶2 (W/W)混合时,混合鱼糜与青花鱼鱼糜的凝胶强度相近[7]。Abdollahi等[8]分别从鲱鱼与鲤鱼中分离得到蛋白质,然后1∶1 (W/W)混合后,弹性模量增速提高。对于混合不同种类的鱼糜能够提高凝胶强度的机制,需要进一步研究。
本文主要研究不同混合比例下鳀鱼鱼肉与白鲢鱼鱼糜热聚集行为,以期能够为解释混合鱼糜的凝胶特性提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
冷冻鳀鱼 辽宁大连市鑫荣水产市场;白鲢鱼鱼糜,AAA级 湖北洪湖市井力水产食品有限公司;食盐 中盐榆林盐化有限公司;Tris 天津市风船化学试剂科技有限公司。
UMC5真空斩拌锅 德国Stephan机械有限公司;TA.XT-plus型质构仪 英国Stable Micro System公司;DiscoveryDHR-1流变仪、DSCQ2000差示热量扫描仪 美国TA公司;SORVALL Stratos冷冻高速离心机 美国Thermo公司;NanoBrook粒度仪 美国布鲁克海文仪器公司;970CRT荧光分光光度计 上海精密科学仪器有限公司;LabRAM HR Evolution共焦拉曼光谱仪 堀场(中国)贸易有限公司;E-1045镀金仪、S-4800冷场发射扫描电镜 日本日立高新技术公司。
1.2 实验方法
1.2.1 鳀鱼鱼肉的制备 将冷冻鳀鱼在流动水中进行解冻。对鳀鱼进行处理(去头去尾去内脏)后获得鱼肉,然后在低温(<10 ℃)下将鱼肉斩拌切碎成泥状,放置于-78 ℃冰箱中贮藏。
1.2.2 设定混合比例 将鳀鱼鱼肉与白鲢鱼鱼糜分别按照0∶10、1∶9、2∶8、3∶7、4∶6和10∶0的质量比混合。
1.2.3 凝胶的制备 将冷冻白鲢鱼鱼糜和制备的鳀鱼鱼肉在4 ℃下解冻6 h,切成小块(约2.0 cm的立方体)。按照上述的比例混合鳀鱼鱼肉和白鲢鱼鱼糜,首先空斩3 min,然后加2.5% NaCl进行斩拌3 min,最后在真空(-0.6 Pa)条件下,将水分含量调节到78%,斩拌5 min,整个过程中保持在10 ℃以下。经过二段式加热形成凝胶(40 ℃加热30 min,90 ℃加热20 min),加热完成后,将凝胶迅速放在冷水中冷却,然后放置于4 ℃冰箱中备用。测定的指标包括凝胶强度、动态流变和热稳定性。
1.2.4 凝胶强度的测定 将凝胶样品于常温(25 ℃)下切成直径为2.0 cm,高为2.0 cm圆柱体,使用质构仪测量其凝胶强度[9]。测量参数如下:探针型号P/5s;测前速度1 mm/s;测后速度1 mm/s;压缩距离15 mm;触发力10 g。每组样品平行测量十次。
1.2.5 动态流变的测定 将鱼糜凝胶放置于平板间(40 mm),间距为1000 μm。测量参数如下[10]:加热速率2 ℃/min;加热范围20 ℃~90 ℃;固定的扫描频率0.1 Hz;应变2%。
1.2.6 热稳定性的测定 根据Susan等[11]的方法稍作修改。准确称取5 mg鱼糜凝胶于铝盘中并密封,同时以空铝盘作为空白对照。测量参数如下:起始温度20 ℃;结束温度90 ℃;升温速率10 ℃/min;氮气流速50 mL/min。由DSCQ2000分析软件得到样品相变过程的焓变ΔH。
1.2.7 肌原纤维蛋白的提取 根据李学鹏等[12]的方法稍作修改。将上述设定比例混合的鳀鱼鱼肉与白鲢鱼鱼糜放入料理机中打碎。先加入4倍体积的10 mmol/L Tris-HCl(pH7.2)提取液,高速匀浆3次,每次匀浆30 s。整个匀浆过程处于低温环境(<10 ℃)下。再将匀浆液于4 ℃、5000 r/min离心20 min,去除上清液,沉淀再用4倍上述提取液重复提取2次。除去上清液,最后得到的沉淀用10 mmol/L Tris-HCl(含0.6 mol/L NaCl、pH7.2)溶液溶解,将溶解后的样品于4 ℃、5000 r/min离心20 min,收集上清液,即为肌原纤维蛋白溶液。
1.2.8 蛋白样品的预处理 取1.2.7制备的不同混合比例下的肌原纤维蛋白溶液,在40 ℃下水浴30 min,即为第一段加热后的蛋白样品;再取部分一段式加热后的蛋白溶液继续在90 ℃下水浴加热20 min,即为第二段加热后的蛋白样品。将未加热的肌原纤维蛋白溶液作为对照组,即为未加热的蛋白样品。将制备的样品放置于4 ℃冰箱里备用。
1.2.9 粒径的测定 使用NanoBrook粒度仪测定粒径分布。用10 mmol/L Tris-HCl(含0.6 mol/L NaCl pH7.2)缓冲液将不同混合比例的蛋白溶液浓度调成0.5 mg/mL。测量参数如下:测定温度25 ℃;平衡时间2 min。
1.2.10 内源荧光的测定 使用荧光分光光度计测定内源荧光光谱[13]。用10 mmol/L Tris-HCl(含0.6 mol/L NaCl pH7.2)缓冲液将不同混合比例的蛋白溶液浓度调成2.5 mg/mL。测量参数如下:激发波长295 nm;狭缝均为10 nm;扫描范围300~450 nm;灵敏度3。
1.2.11 拉曼光谱的测定 根据Poowakanjana等[14]的方法稍作修改。将不同混合比例的蛋白样品冻干后,放置于载玻片上。使用高分辨率拉曼光谱仪,激发光源为半导体激光器。测量参数如下:激光波长532 nm;功率100%;采集时间60 s;扫描次数3次;光谱分辨率0.6 cm-1;空间分辨率400 nm;拉曼位移范围400~3600 cm-1。用Alix的方法[15]计算蛋白质二级结构中α-螺旋、β-折叠、β-转角和无规则卷曲的百分比。
1.2.12 扫描电子显微镜的测定 将冻干后的蛋白样品,使用镀金仪进行离子溅射镀金,然后用扫描电镜观察。
1.3 数据处理
实验数据用SPSS 19.0软件进行分析和处理(平均差值用95%置信区间进行T检验),用Origin 9.0软件作图。
2 结果与分析
2.1 混合鱼糜凝胶强度的变化
破断力反映的是鱼糜凝胶的硬度,破断距离反映的是鱼糜蛋白之间的结合。凝胶强度是破断力与破断距离的乘积,是表征鱼糜凝胶硬度和弹性的主要指标[16]。图1为混合鳀鱼鱼肉与白鲢鱼鱼糜破断力、破断距离和凝胶强度的变化。由图1可知,纯白鲢鱼鱼糜凝胶的破断力、破断距离和凝胶强度均高于纯鳀鱼鱼肉(P<0.05)。随着鳀鱼鱼肉含量的增加,混合体系的破断力和凝胶强度先增大后减小。当鳀鱼鱼肉与白鲢鱼鱼糜的质量比例为1∶9、2∶8和3∶7时,混合体系的凝胶强度与白鲢鱼鱼糜相比显著提高(P<0.05),由4629.17 g·mm分别提高到7568.01、6804.22和5805.38 g·mm。凝胶强度和蛋白质的变性有关,在加热过程中,肌球蛋白之间以及肌球蛋白和肌动蛋白之间相互交联,形成致密的凝胶网络结构,从而增强凝胶强度。余永名等[17]将鲢鱼鱼糜与金线鱼鱼糜以5∶1的质量比混合时,混合鱼糜的凝胶强度高于白鲢鱼鱼糜。将金鲳鱼鱼肉添加到罗非鱼鱼糜中,能够增强混合鱼糜蛋白质之间的结合作用,混合样品的破断力得到提高[18],与本实验的结果相似。
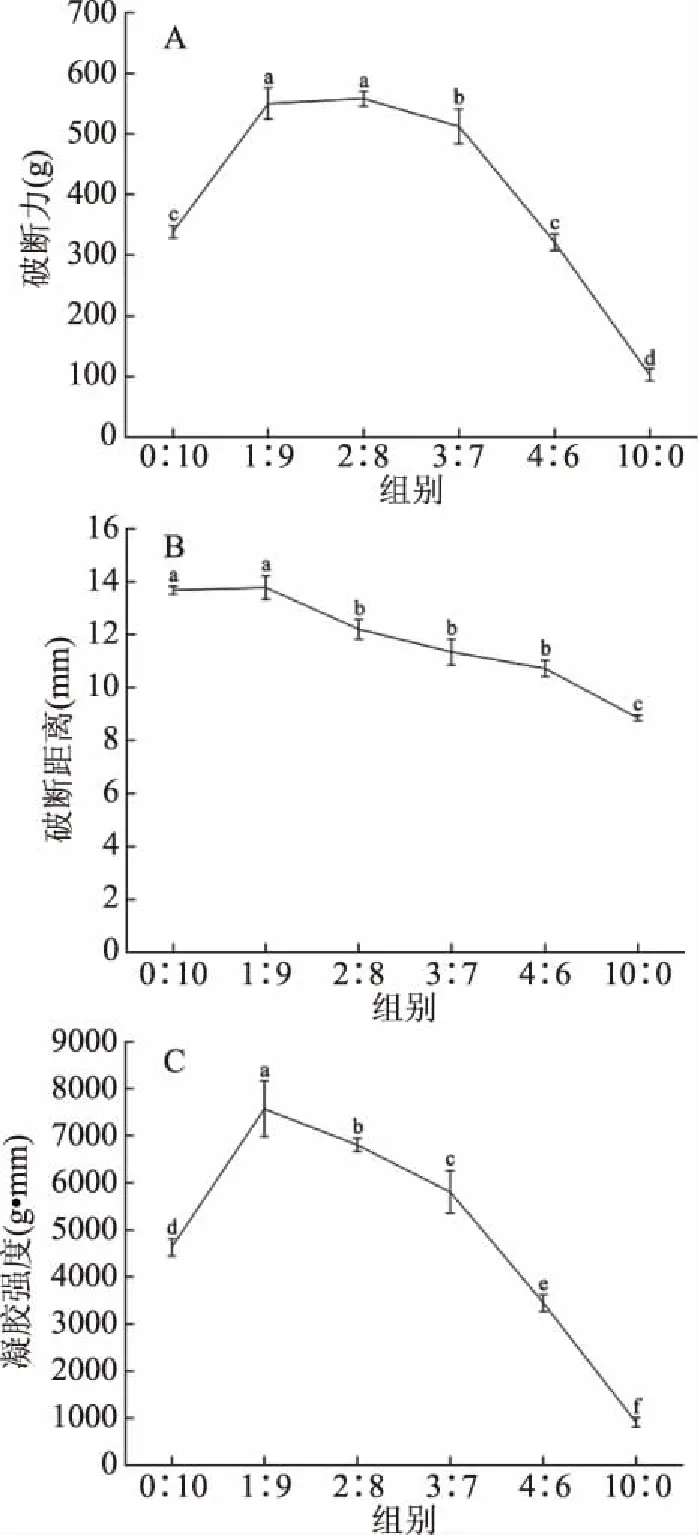
图1 混合鳀鱼鱼肉与白鲢鱼鱼糜破断力(A)、破断距离(B)和凝胶强度(C)的变化Fig.1 Changes in breaking force(A),breaking distance(B)and gel strength(C)of blended anchovy mince and silver carp surimi注:鳀鱼鱼肉∶白鲢鱼鱼糜=0∶10、1∶9、2∶8、3∶7、4∶6和10∶0(全文同);不同字母表示同一指标各组间数据差异显著(P<0.05)。
2.2 混合鱼糜动态流变的变化
动态流变常常用于研究鱼糜的热聚集。混合鳀鱼鱼肉与白鲢鱼鱼糜储能模量(G′)、损耗模量(G″)和阻尼系数(tanδ)的变化如图2所示。G′能够反映凝胶的弹性以及转变温度,G′值越大,凝胶强度越大[19]。由图2A可知,在40~50 ℃之间出现了一个过渡峰,其对应的温度为肌球蛋白的变性温度[20]。随着温度的升高,G′逐渐增大。当温度升到70 ℃左右时,G′达到最大值,这可能是因为在该温度下已经形成了完整的凝胶网络结构[21]。当鳀鱼鱼肉和白鲢鱼鱼糜的质量比例为1∶9和2∶8时,G′值相对较高。随着温度的继续升高,G′趋于稳定。从图2A、图2B可以看出,在整个升温过程中,G″值明显低于G′值,表明混合体系是以弹性为主的稳定体系[22]。tanδ为G″和G′比值的正切值,tanδ值越大,凝胶强度越小[23]。由图2C得,当鳀鱼鱼肉和白鲢鱼鱼糜的质量比例为1∶9和2∶8时,混合体系的tanδ值较低,说明这两种比例下的凝胶强度较大,与前面凝胶强度的分析结果相一致。
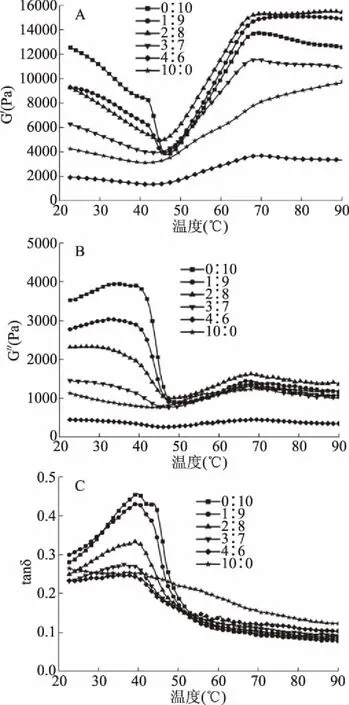
图2 混合鳀鱼鱼肉与白鲢鱼鱼糜储能模量(A)、损耗模量(B)和阻尼系数(C)的变化Fig.2 Changes in storage modulus(A),loss modulus(B)and damping factor(C)of blended anchovy mince and silver carp surimi
2.3 混合鱼糜热稳定性的变化
图3是混合鳀鱼鱼肉与白鲢鱼鱼糜加热过程中的差示热量扫描图。在DSC图中,向上的峰是吸热峰,代表的是蛋白质的折叠变性行为;向下的峰是放热峰,代表的是蛋白质的聚集行为[24]。DSC图中对应的峰面积为焓变值(ΔH),ΔH值越大,表示变性需要的能量越多,其对应的体系稳定性越高[25]。
从图3中可以看出:各组别在加热过程中均出现两个峰,Peak1代表的是肌球蛋白的变性,Peak2代表的是肌动蛋白的变性[26],峰面积代表的是表1中的ΔH。表1是混合鳀鱼鱼肉与白鲢鱼鱼糜DSC参数的变化。由表1可知,各组别的变性温度和焓变值都不同。当鳀鱼鱼肉和白鲢鱼鱼糜的质量比例为0∶10、1∶9和2∶8时,ΔH1值较高,表明该比例下混合体系稳定性较强。这可能是因为不同来源的蛋白质之间相互作用,提高了混合体系的稳定性。当鳀鱼鱼肉含量进一步增加时,ΔH1值逐渐减小,表明混合体系的稳定性降低。
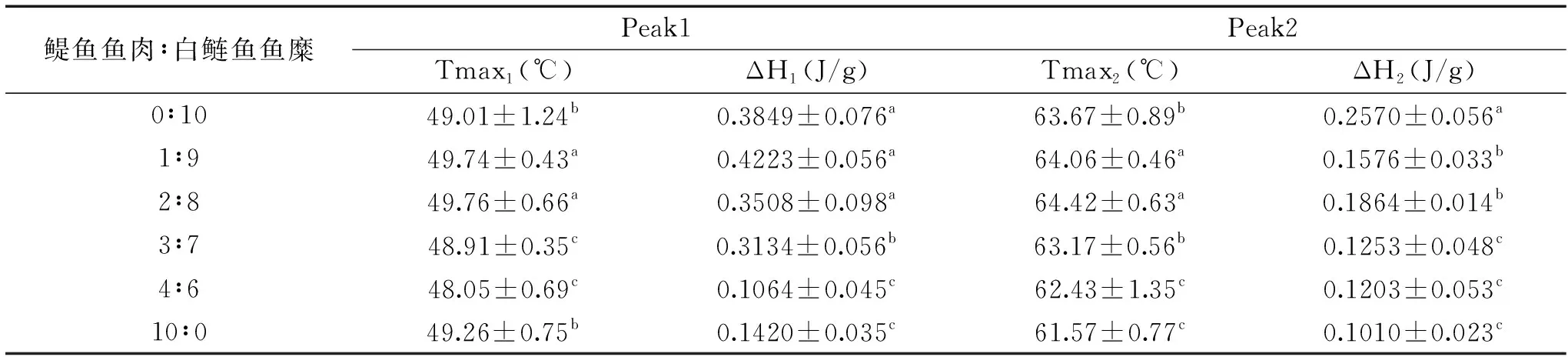
表1 混合鳀鱼鱼肉与白鲢鱼鱼糜热稳定性的变化Table 1 Changes in thermal stability of blended anchovy mince and silver carp surimi
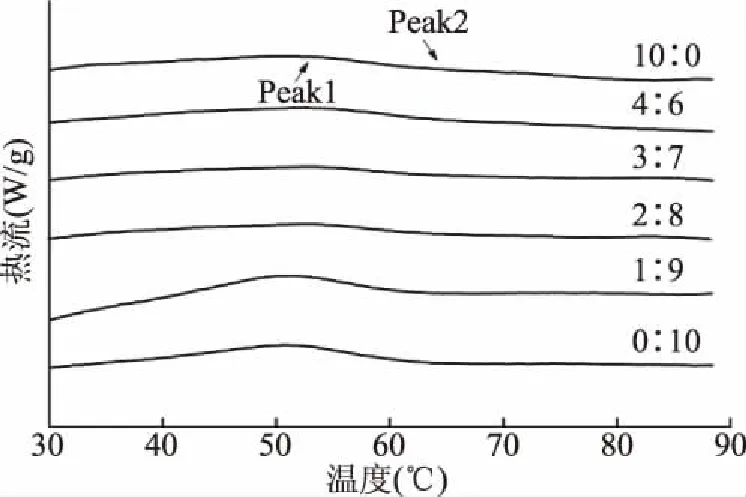
图3 混合鳀鱼鱼肉与白鲢鱼鱼糜在加热过程中的差示热量扫描图Fig.3 Differential scanning calorimetry(DSC)in the heating process of blended anchovy mince and silver carp surimi
2.4 混合鱼糜中肌原纤维蛋白粒径的变化
粒径是蛋白质结构的宏观表现。不同的温度和不同来源的蛋白质之间相互交联都会影响其粒径的大小[27]。图4是混合鳀鱼鱼肉与白鲢鱼鱼糜在加热过程中粒径的变化。由图4可知,在加热前后各组别的粒径分布都只有一个峰,表明混合体系中形成聚集体的大小比较均一。未加热时,各组别的粒径大小分布比较集中,粒径大部分集中在180 nm处。这说明未加热时,混合体系没有发生剧烈变性。经过第一段加热后,各组别的粒径与未加热时相比均提高50%,粒径大部分集中在400 nm处。随着加热的继续,混合体系的粒径逐渐增加,第二段加热后的混合体系粒径大部分集中在1500 nm处。这表明肌原纤维蛋白经过热凝胶,通过蛋白质之间的相互作用形成较大的聚集体,从而导致混合体系粒径的增加[28]。经过二段式加热后,不同混合比例的鳀鱼鱼肉和白鲢鱼鱼糜的粒径均大于纯鳀鱼,说明混合体系的蛋白质交联程度大于纯鳀鱼的蛋白质交联程度。
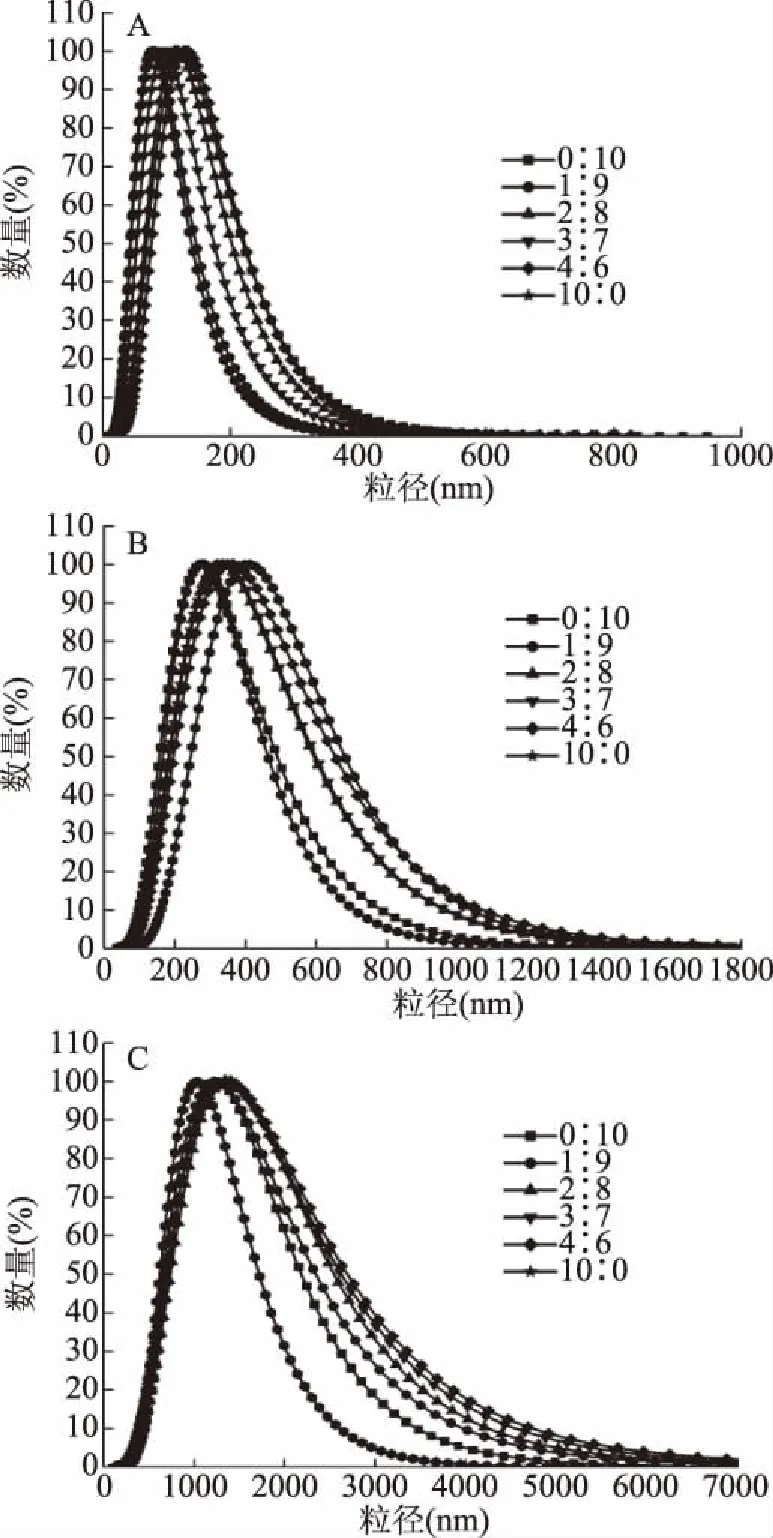
图4 混合鳀鱼鱼肉与白鲢鱼鱼糜在加热过程中粒径的变化Fig.4 Changes in particle size of blended anchovy mince and silver carp surimi during heating注:(A)是未加热;(B)是第一段加热;(C)是第二段加热。
2.5 混合鱼糜中肌原纤维蛋白内源荧光的变化
内源荧光光谱经常用来研究蛋白质分子构象和色氨酸、酪氨酸残基微环境的变化[29]。混合鳀鱼鱼肉与白鲢鱼鱼糜在加热过程中内源荧光的变化如图5所示。未加热时,各组别的荧光图谱形状没有较大变化,但是其最大荧光强度发生了变化。当鳀鱼鱼肉与白鲢鱼的质量比例为1∶9时,混合体系的最大荧光强度最低,其余混合比例体系的最大荧光强度均处于鳀鱼和白鲢鱼的中间。其中,鳀鱼的最大荧光强度过大,可能是因为鳀鱼中所含有的荧光物质含量过多。随着加热的进行,混合体系的最大荧光强度明显减小。与未加热时相比,第一段加热后和第二段加热后最大荧光强度分别降低了38.8%和44.4%,这可能是因为加热初期蛋白结构变化比较显著。经过二段式加热后,混合体系的最大荧光强度降低,表现出荧光猝灭现象,且发生了不同趋势的红移现象。其中,当鳀鱼鱼肉与白鲢鱼的质量比例为10∶0、1∶9和2∶8时,红移趋势较大。红移的趋势越大,表示蛋白质在变性过程中构象改变的程度越大[30]。袁丽等[31]研究得到,随着温度的升高,鳙鱼的肌球蛋白表现出其荧光猝灭现象显著,且发生了明显的红移现象,与本实验的结果相似。
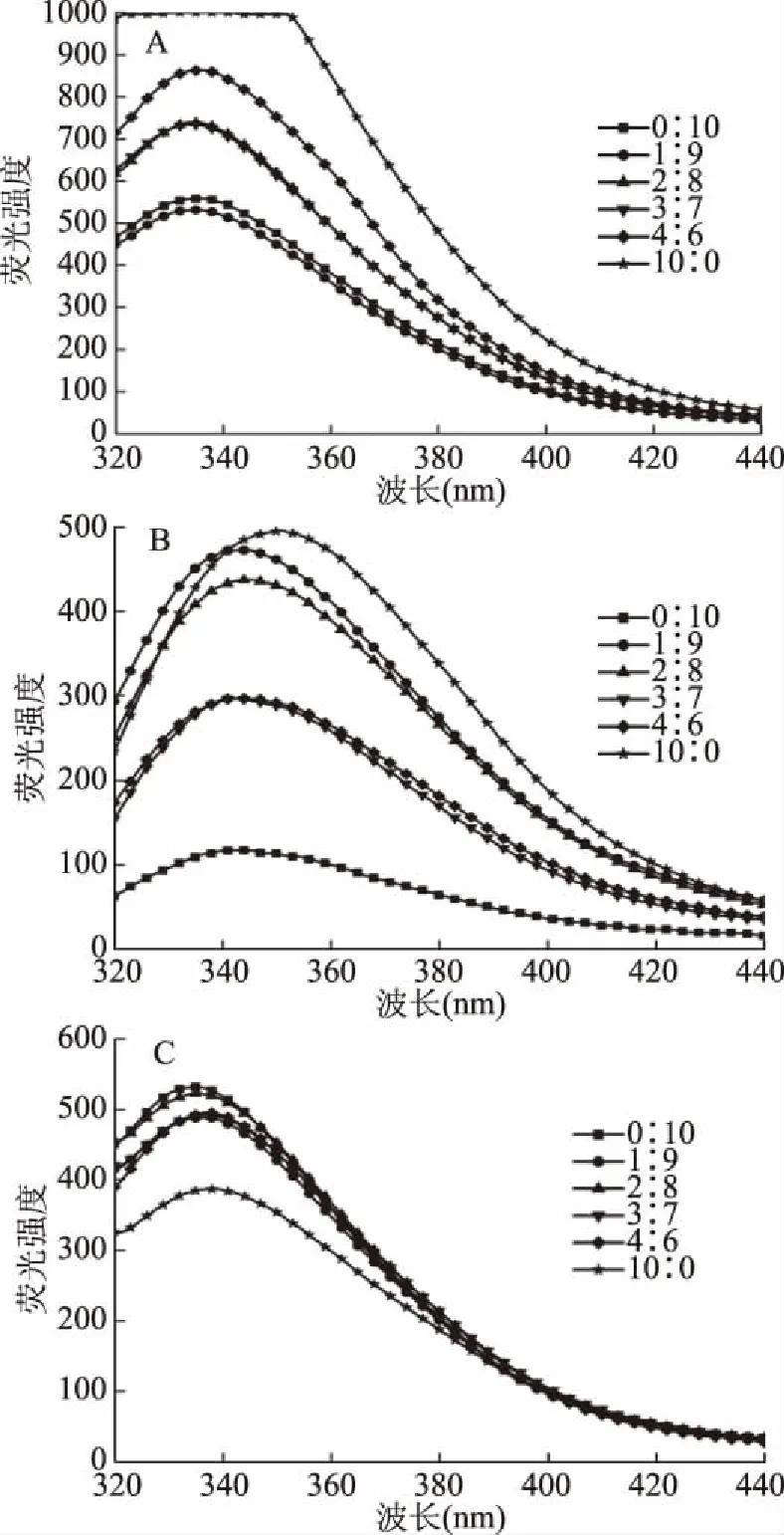
图5 混合鳀鱼鱼肉与白鲢鱼鱼糜在加热过程中内源荧光的变化Fig.5 Changes in intrinsic fluorescence of blended anchovy mince and silver carp surimi during heating注:(A)是未加热;(B)是第一段加热;(C)是第二段加热。
2.6 混合鱼糜中肌原纤维蛋白二级结构的变化
在蛋白质的拉曼光谱中,酰胺Ⅰ带(Amide Ⅰ)和酰胺Ⅲ带(Amide Ⅲ)是蛋白质构象的主要特征峰[32]。混合鳀鱼鱼肉与白鲢鱼鱼糜在加热过程中蛋白质二级结构的变化如图6所示。加热前后,各组别的蛋白质二级结构含量不同。未加热时,当鳀鱼鱼肉与白鲢鱼鱼糜的质量比例为1∶9和2∶8时,α-螺旋的相对含量较低,这表明在低温状态下,不同来源的蛋白之间会发生轻微的交联。第一段加热后,各组别的α-螺旋相对含量逐渐降低,β-折叠相对含量逐渐升高,表明在40 ℃时,混合体系发生了一定程度的交联,当鳀鱼鱼肉与白鲢鱼鱼糜的质量比例为0∶10、1∶9和2∶8时,α-螺旋的相对含量相差不大。随着加热的继续进行,各组别的α-螺旋相对含量继续降低,β-折叠相对含量继续升高,但是较第一段加热后变化不明显。其中,当鳀鱼鱼肉与白鲢鱼鱼糜的质量比例为1∶9时,α-螺旋的相对含量最低,β-折叠的相对含量最高,表明在该比例下,蛋白质的交联程度最大,混合体系的稳定性最高。鳀鱼鱼肉蛋白质二级结构含量的变化与混合体系的不同,可能是因为鳀鱼鱼肉的热稳定性较差,受热后蛋白结构发生了变化。拉曼光谱结果表明,混合体系的α-螺旋含量降低,β-折叠含量增多,有利于蛋白网络结构的形成[33]。这与前面凝胶强度以及热稳定性的结果相一致。
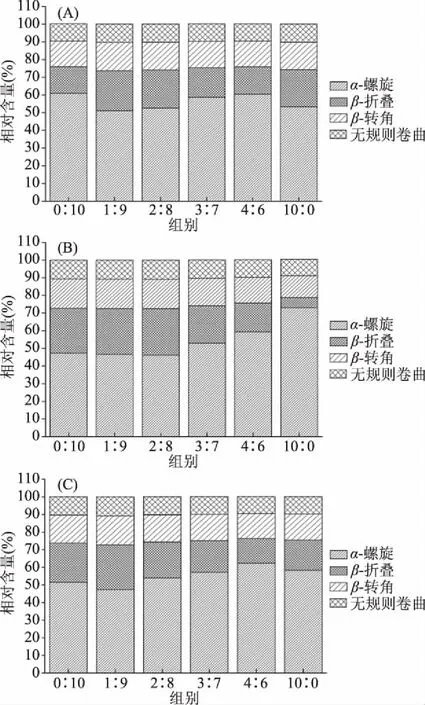
图6 混合鳀鱼鱼肉与白鲢鱼鱼糜在加热过程中蛋白质二级结构的变化Fig.6 Changes in protein secondary structure fractions of blended anchovy mince and silver carp surimi during heating注:(A)是未加热;(B)是第一段加热;(C)是第二段加热。
2.7 混合鱼糜中肌原纤维蛋白微观结构的变化
扫描电镜可以直观地看出蛋白质网络结构的变化。蛋白质表面越平整,其结构形成的越好[34]。图7是混合鳀鱼鱼肉与白鲢鱼鱼糜在加热过程中扫描电子显微镜的变化。未加热时,不同混合比例的微观结构也不同。说明混合体系在混合初期就发生了轻微的交联。第一段加热后,混合体系之间逐渐交联,表面变得逐渐平整。当鳀鱼鱼肉与白鲢鱼鱼糜的质量比例为0∶10、1∶9、2∶8和3∶7时,混合体系的微观结构相似。这可能是因为在加热时蛋白质分子受热变性,交联成大的聚集体。第二段加热后,混合体系的微观结构更加致密均匀。其中,当鳀鱼鱼肉与白鲢鱼鱼糜的质量比例为1∶9时,混合体系的微观结构最为致密。

图7 混合鳀鱼鱼肉与白鲢鱼鱼糜在加热过程中扫描电子显微镜的变化(5000×)Fig.7 Changes in microstructure of blended anchovy mince and silver carp surimi during heating(5000×)注:(A)是未加热;(B)是第一段加热;(C)是第二段加热。
3 结论
混合合适比例的鳀鱼鱼肉与白鲢鱼鱼糜能够提高混合体系的凝胶强度。通过研究鳀鱼鱼肉与白鲢鱼鱼糜在不同混合比例下的热聚集行为,得到当鳀鱼鱼肉和白鲢鱼鱼糜的质量比例为1∶9时,混合体系的热聚集效果最佳。但由于鳀鱼是一种海水鱼,其体内可能含有各种内源酶,会增强混合体系的凝胶特性,具体的机理还需进一步实验研究。

