棉花连作土壤中二甲戊灵降解优势菌的分离及其降解能力
韩亚杰1,王丹琪1,包慧芳
(1.石河子大学化学化工学院,新疆石河子 832003;2.新疆农业科学院微生物应用研究所,新疆乌鲁木齐 830091)
施加化肥和农药是保障农业增产增收的有效措施,预计2020年全球农药市场规模可达600亿美元以上[1]。随着人们环保意识的增强,农药的毒性问题和残留问题越来越受到关注。农药可以导致水生生物中毒和死亡,其中杀虫剂和除草剂是这类事故的主要“元凶”[2]。1992年,美国地下水中含50多种农药,其中涕灭威的浓度高达515 ng/L,1994年地下水中可检测的农药品种上升至157种,并且在湖泊中的鱼类体内检测到滴滴涕、艾氏剂等有毒农药[3]。自上世纪中叶开始,农药降解菌陆续被分离,对其降解代谢途径及关键降解基因也进行了较为详细的研究。研究发现真菌尖孢镰刀菌(Fusariumoxysporum),米曲霉菌(Aspergillusoryzae),香菇(Lentinulaedodes),短密青霉(Penicilliumbrevicompactum)和蜡蚧菌(Lecanicilliumsaksenae)可以在液体培养中对特丁津和二甲戊乐灵进行生物降解[4]。
除草剂二甲戊灵上市已经40年,主要应用于棉花、玉米和烟草的田间除草剂[5-7],在新疆应用较为广泛。二甲戊灵的化学结构比较复杂,施用后在土壤中的吸附性强,而且很难被解吸,持效期长。除草剂二甲戊灵已经被美国环境保护署EPA正式列入持久性生物累积性有毒物质(PBT)名单,它可引发小鼠罹患甲状腺滤泡细胞腺瘤,对水体里的鱼类和无脊椎生物高毒,同时也是人类潜在的致癌物[8-9]。近些年,国内外报道了利用微生物或者是微生物产生的酶去降解二甲戊灵,主要集中在土壤中二甲戊灵降解菌的分离、纯化,涵盖了细菌和真菌[10-14],但是关于酵母菌降解二甲戊灵的报道较少。由于酵母菌具有耐渗透压、耐酸以及高的代谢效率等特点,因此在降解有机污染物方面同样具有重要的作用。人们还发现酵母菌在分解有机污染物时会产生丰富的酵母蛋白,即美化了环境又可以对代谢产生的蛋白进行综合利用[15]。周江亚等[16]分离了1株降解苯酚的热带假丝酵母菌,对苯酚的降解率高达99.10%。刘斌斌等[17]分离了一株对甲胺磷具有极高降解活性的鲁氏酵母菌(Saccharomycesrouxii)WY3后发现,经过WY3处理12 h后的样品未检出甲胺磷。肖琳等[18]利用酵母菌降解苯二甲酸工业废水,对酵母菌代谢产生的细胞蛋白进行小鼠的急性毒性、蓄积毒性和致突变试验分析,研究显示小鼠内脏未见病变,同时发现小鼠很喜欢吃酵母菌代谢产生的细胞蛋白。由此得知,酵母菌对有机污染物的生物降解是一种可持续发展的技术手段,其可将有机污染物转化为细胞蛋白,优越性可见一斑。
本文从棉花连作并常年施加除草剂二甲戊灵的土壤中分离了5株降解二甲戊灵的优势菌,并研究了降解能力最高菌株XSP6的降解性能,以期对农药污染的水体和土壤生物修复提供理论依据。
1 材料与方法
1.1 材料与仪器
二甲戊灵标准品 上海阿拉丁生化科技股份有限公司;33%的施田补乳油 江苏丰山集团有限公司;石油醚 分析纯,天津永晟精细化工有限公司;无机盐培养基 NaNO33 g,K2HPO41 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeSO40.01 g,按需加入不同质量的蔗糖,1000 mL去离子水,自然pH,高压灭菌;PDA培养基马铃薯200 g,蔗糖20 g,1000 mL自来水,自然pH,高压灭菌。
MLS-3750型高压灭菌锅 日本三洋公司;SW-CJ-ZFD型超净工作台 上海博讯实业有限公司;LRH-150型恒温培养箱 上海一恒科学仪器有限公司;ZQZY-70BS型恒温振荡器 上海知楚仪器有限公司;5418R型冷冻离心机 德国Eppendorf公司;R-210型旋转蒸发仪 瑞士BUCHI科技有限公司;LC-10A型高效液相色谱仪 日本岛津;Axio Observer型荧光倒置显微镜 德国ZEISS公司;FR-980型凝胶成像仪 上海复日科技有限公司;PCR扩增仪 BIO-RED伯乐;UV-2100紫外可见分光光度计 优尼柯(上海)仪器有限公司。
1.2 实验方法
1.2.1 二甲戊灵降解菌的富集筛选 配制土壤稀释液(土壤∶无菌水=1∶10),28 ℃振荡培养30 min,静止后吸取上层清液,按着5%的量接种到含二甲戊灵100 mg/L的无机盐培养液中,28 ℃振荡培养5 d取适量富集液接种到含二甲戊灵200 mg/L的无机盐培养液中,如此转接直至二甲戊灵的浓度达到4500 mg/L。取富集后的菌液利用稀释平板涂布法获得单菌落,再经过三次划线得到纯菌,以15%甘油管保存在-80 ℃冰箱。
1.2.2 二甲戊灵降解优势菌的复筛 挑选5株生长良好的酵母菌分别接种至10 mL无机盐培养液,控制初始二甲戊灵浓度为300 mg/L、蔗糖含量为0.5%,分装至锥形瓶中,再向每个锥形瓶中加入培养至对数生长期的菌悬液0.8 mL,置恒温振荡培养箱28 ℃、120 r/min培养。培养结束后加入5 mL饱和NaCl溶液,用30 mL石油醚萃取,萃取液经旋转蒸发仪浓缩,吹干后加入3 mL色谱纯甲醇溶解定容,经0.22 μm尼龙(NY)滤膜过滤,高效液相色谱法进行测定。本实验采用标准曲线法进行定量。
1.2.3 菌株形态观察和生理生化鉴定 使用显微镜对分离菌株进行形态学观察。同时进行菌株的生理生化测定[1,3]。
1.2.4 26S rRNA鉴定 按照Ezup柱式酵母基因组DNA抽提试剂盒提取酵母菌XSP6的基因组DNA。以酵母菌XSP6的基因组DNA为模板,利用通用引物NL1-F和NL1-R对菌株的26S rRNA的基因片段进行扩增,正向引物NL1-F:5′-GCATATCAATAA GCGGAGGAAAAG-3′,反向引物NL1-R:5′-GGTCCGTGTTTCAAGACGG-3′。酵母菌26S rRNA基因基因扩增体系:0.5 μL基因组DNA;2.5 μL 10×Buffer;1 μL dNTPs(2.5 mmol/L);0.5 μL引物NL1-F(10 μmol/L);0.5 μL引物NL1-R(10 μmol/L);0.2 μL Easy-Taq DNA polymerase(5 U/μL);25 μL ddH2O。PCR 扩增循环参数为:94 ℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min,4 ℃终止反应。扩增产物采用1%琼脂糖凝胶电泳检测,电泳条件150 V、100 mA。PCR产物由生工生物工程有限公司进行测序。测序结果在NCBI数据库中进行BLAST(Basic Local Alignment Search Tool,http://www.ncbi. nlm. nih. gov/BLAST)搜索[19],并与数据库中已上传的26S rRNA基因序列进行同源性对比,并利用Mega 5.0进行系统发育分析。
1.2.5 酵母菌XSP6降解率的测定
1.2.5.1 二甲戊灵浓度 调整二甲戊灵浓度分别为50、150、300 mg/L,分装于锥形瓶后接种培养,5 d后取出无机盐培养基,使用石油醚萃取降解产物,最后以HPLC法测定并计算农药的降解率。
1.2.5.2 接种量 根据上述试验的结果选择适宜的二甲戊灵浓度,调整接种量分别在1%、1.5%、2.5%、5%,5 d后取出无机盐培养基,使用石油醚萃取降解产物,最后以HPLC法测定并计算农药的降解率。
1.2.5.3 外加碳源 根据上述试验结果选择适宜的二甲戊灵浓度和接种量,配制含碳源蔗糖0.5%、1.0%、1.5%、2.0%不同浓度的无机盐培养液,5 d后取出无机盐培养基,使用石油醚萃取降解产物,最后用标准曲线法进行定量,同时计算农药的降解率。
1.2.6 降解率的测定 高效液相色谱条件:C8色谱柱(Waters公司),甲醇∶水(85∶15)为流动相,流速为1 mL·min-1,柱箱温度为30 ℃,检测波长为238 nm[20]。本实验采用标准曲线法进行定量。配制标准样品浓度为50、100、150、300、500 mg/L,用色谱纯甲醇定容至10 mL的容量瓶中,混匀;经0.22 μm尼龙(NY)滤膜过滤,高效液相色谱法进行测定。以质量浓度x(mg/L)为横坐标,峰面积y为纵坐标,得到线性回归方程y=48240x+580356.9233。
1.3 数据处理
采用Origin软件进行数据处理与绘图,所有样品均测量3次,取平均值并给出标准偏差。
2 结果与分析
2.1 菌种的富集分离
富集培养法是一种有效且有用的分解细菌的方法,其能够以较高的效率分解杀虫剂[21]。本实验以棉花连作并常年施用二甲戊灵的土壤作为菌种来源,经过富集培养的方法,平板涂布后获得单菌,挑取单菌平板划线三次最后得到单菌,分离获得20株单菌,选取生长良好的5株菌,分别命名为YL128、YL127、YL125、YLW和XSP6,筛选的这5株菌进行后续的降解能力复筛。研究报告显示,FLN-7可以降解除虫脲[22],Aspergillussojaestrain JPDA1能够降解久效磷[23],Paracoccussp.QCT6可降解嗪草酮[24]。Ni等发现,在二甲戊灵作为碳源的情况下,Paracoccussp.可以有效降解二甲戊灵[25]。朱鲁生在二甲戊灵降解细菌HB-7的实验证实,菌株HB-7在以高浓度二甲戊灵为唯一碳源的平板上生长良好,而且降解率高[26]。
2.2 酵母菌降解能力复筛
YL128、YL127、YL125、YLW和XSP6对二甲戊灵的降解率见图1。从图1中可以看出,虽然本实验筛选的5株菌均可耐受高浓度的二甲戊灵,但是在无机盐培养基中,这5株菌对农药的降解能力是不同的,其中酵母菌XSP6在5 d内对300 mg/L二甲戊灵的降解率为50.3%,明显高于其他菌株,故选择菌株XSP6做进一步研究。Ni等通过富集培养的方法分离了13株微生物,结果显示只有三株能够降解二甲戊灵,P13菌株能够降解99.8%的二甲戊灵[25]。
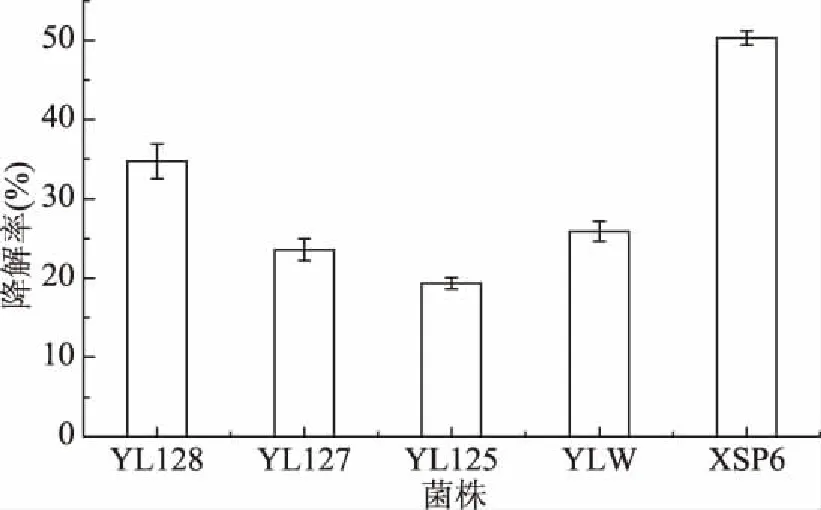
图1 不同菌株对二甲戊灵的降解Fig.1 Degradation of pendimethalin with different strains
2.3 菌株的鉴定结果
2.3.1 菌株的形态及生理生化特征 XSP6菌株的酵母菌形态明显,菌落乳白色,菌体圆滑有光泽、伴有凸起且边界整齐。通过显微镜对菌株形态进行观察,发现XSP6为卵圆形,见图2。表1详细列出了XSP6菌株的形态及生理生化特征信息。结合形态学分析,最终确定XSP6菌株为酵母菌。

表1 形态及生理生化特征Table 1 Morphology and physiological and biochemical characteristics
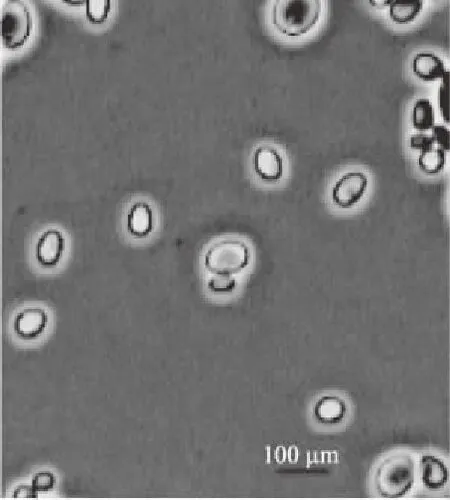
图2 XSP6的形态特征Fig.2 Morphology of XSP6
2.3.2 26S rRNA基因序列分析 测得酵母菌XSP6的26S rRNA基因序列长度为496 bp。将得到的基因序列与数据库中的序列进行比对,获得各序列的同源性信息,并利用Mega 5.0软件构建系统发育树,结果见图3。序列比对结果表明,菌株XSP6与Candidatropicalis的26S rRNA序列相似度最高,综合菌株的形态特征、常规生理生化特征和26S rRNA序列测定/同源性比较结果,初步鉴定酵母菌XSP6是热带假丝酵母。热带假丝酵母是一种较常见的假丝酵母,又称热带念珠菌。
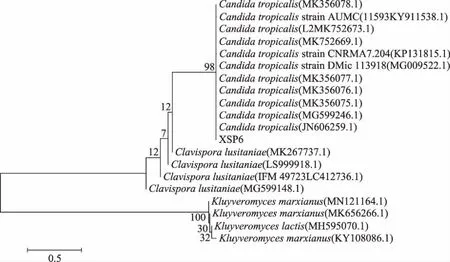
图3 酵母菌XSP6的26S rRNA D1/D2基因序列系统发育树Fig.3 Phylogenetic tree of XSP6 basedon 26S rRNA D1/D2 gene sequence
2.4 二甲戊灵的初始浓度对酵母菌降解率的影响
二甲戊灵的初始浓度对酵母菌XSP6降解率的影响如图4所示,酵母菌XSP6在实验浓度范围内对二甲戊灵降解率是随其浓度增加而逐渐增加。胡佳月等认为,随着培养液中二甲戊灵质量浓度的升高,降解率逐渐降低。当二甲戊灵质量浓度升至1000 mg/L时,菌株JY-2 和JY-5的降解率仅为25.87%和30.44%[27]。林爱军等认为,二甲戊灵低质量浓度时,菌株体内的降解活性较高,有利于其降解;而达到一定质量浓度后,菌株生长受到抑制,降解率下降[28]。

图4 二甲戊乐灵浓度对降解率的影响Fig.4 Effect of the concentration of pendimethalin on biodegradation rate
2.5 接种量对降解率的的影响
接菌量对农药降解率的影响如图5所示。从图5可以看出,当接种量在1%~2.5%区间时,二甲戊灵的降解率随着接种量的增加而增加,但是当接种量从2.5%升到5%后,降解率表现出略微下降的趋势。推测这种现象的原因是:提高接种量可以促使菌体大量繁殖,降解能力快速增强;当接种量过多,培养体系中的营养物质匮乏,造成菌体之间在空间、营养上的竞争,导致菌体出现“早衰”,降解率降低;同时,菌体降解产生的代谢产物可能会降低微生物与二甲戊灵的接触,也导致降解率降低。由此可知,2.5%的接种量时二甲戊灵的降解率最高。与陈婷等的研究结果相似,随着接种量的增大,菌株B90A对六氯环己烷(hexachlotocyclohexane,HCH)的降解率也相应提高,适宜接菌量为5%[29]。
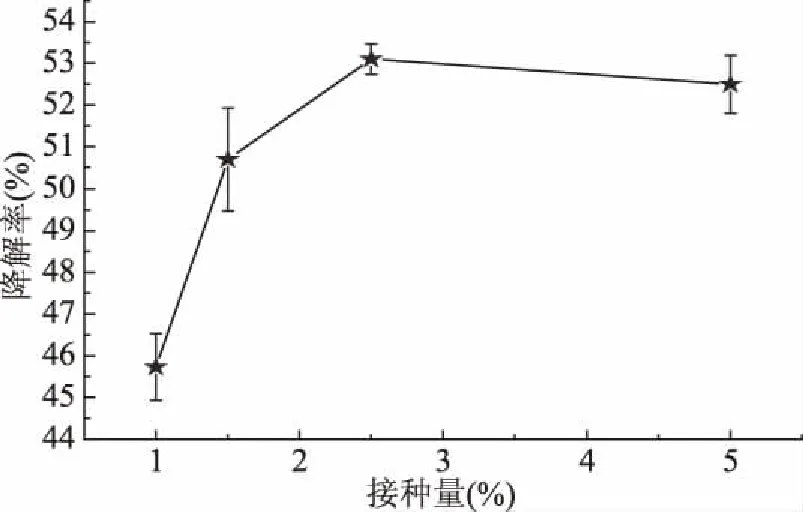
图5 接种量对生物降解率的影响Fig.5 Effect of the inoculation quantity on biodegradation rate
2.6 蔗糖浓度对二甲戊灵降解率的影响
不同碳源浓度对农药降解率大小的影响详见图6。由图6可知,蔗糖浓度由0.5%增加至1.5%时,二甲戊灵的降解率增长迅速,当蔗糖浓度由1.5%增加至2.0%,二甲戊灵的降解率呈缓慢下降趋势。酵母菌XSP6在蔗糖浓度2.0%时降解率最大为66.2%,表明菌株在降解二甲戊灵时有最适合的蔗糖浓度,才能发挥最佳降解效率。推测出现这种现象的原因为,无外加碳源时,细菌生长收到抑制,降解率较高[30];加入少量外加碳源能够促进细菌的迅速增长[31]。
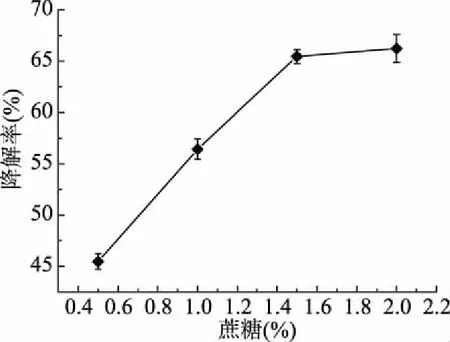
图6 蔗糖浓度对生物降解率的影响Fig.6 Effect of the concentration of sucrose on biodegradation rate
蔗糖是比农药更易被微生物利用的碳源,因此菌体对农药的降解率变化不显著。由此可知,降解酶的产量受到生存环境中底物的影响,它只有在合适的条件下,才可以有效降解农药。朱鲁生等发现,微生物降解农药需要合适的外加碳源质量分数来保证细胞的正常代谢[26]。
3 结论
从棉花连作并常年施加除草剂二甲戊灵的土壤中,经富集筛选获得YL128、YL127、YL125、YLW和XSP6降解农药的菌株,其中XSP6的降解效果最好。对XSP6进行生理生化测定和26S rRNA D1/D2区序列分析,初步鉴定其为热带假丝酵母(Candidatropicalis)。当接种量2.5%、外加碳源2%时,热带假丝酵母菌XSP6 5 d内对300 mg/L二甲戊灵降解率最高为66.2%。关于微生物降解酶的研究有待进一步完成。本研究筛选的酵母菌XSP6对农药污染的水体和土壤生物修复提供了理论依据。随着研究的深入,酵母菌在环境污染治理中的应用将会越来越广阔。

