miRNA-1246靶向MAPK14在长波紫外线诱导人成纤维细胞光老化中机制的研究
胡翠 李巍 张婷 鲁慧 吴亚芳 钱华
苏州大学附属儿童医院皮肤科215025
长期慢性紫外线照射可诱导皮肤成纤维细胞基质金属蛋白酶(MMP)合成、线粒体损伤、蛋白质氧化损伤和端粒缩短等,使皮肤加速衰老甚至出现癌变[1-2]。本研究小组前期发现,微小RNA(miRNA)-1246是紫外线照射诱导光老化中出现显著下调的miRNA之一[3],其靶点基因丝裂原活化蛋白激酶14(MAPK14,又称p38)是MAPK 信号通路关键分子,与MMP 及胶原降解等细胞光老化机制具有密切关系。本研究通过建立长波紫外线(UVA)照射诱导的人皮肤原代成纤维细胞(HSF)的光老化模型,检测miR-1246和MAPK14 的表达,并用慢病毒转染上调miR-1246 的表达,观察其对细胞增殖和光老化的影响,探讨其内在的分子机制。
材料与方法
一、材料与仪器
DMEM 培养基、胎牛血清、胰蛋白酶(美国Gibco 公司);UVA 照射仪(上海希格玛公司);Dispase酶、胶原酶(美国Sigma公司);Trizol试剂盒(美国Invitrogen 公司);MAPK14 鼠单克隆抗体(美国Sigma 公司);MMP-1 兔单克隆抗体(美国Abcam公司);增强化学发光试剂(ECL)(美国Bethyl 公司);山羊抗兔IgG抗体、山羊抗小鼠IgG抗体(上海碧云天生物技术研究所);人源has-miR-1246 慢病毒表达载体、慢病毒转染试剂盒(上海吉凯基因化学技术有限公司);噻唑蓝(MTT,美国Sigma公司),实时定量PCR 试剂盒、SYBR 荧光染料试剂(日本Takara 公司);ABI7300 实时定量PCR 仪(美国ABI公司)。
二、HSF的分离和培养
HSF分离自本院泌尿外科收集的5例3 ~12岁健康儿童包皮环切术后皮肤标本。本研究通过苏州大学附属儿童医院医学伦理委员会批准(批号:2020CS003),患儿监护人均签署知情同意书。
包皮标本用含1%青链霉素的磷酸盐缓冲液(PBS)漂洗3次,清除皮下脂肪和血管后,将标本剪成宽为3 mm 的皮条,使用Dispase 酶在37 ℃消化3 ~4 h,分离表皮与真皮。将真皮剪成碎沫后再使用胶原酶于37 ℃消化2 ~4 h。过200 目筛网收集细胞悬液,离心后将细胞重悬于含10%胎牛血清和1%青链霉素的DMEM 培养基,于37 ℃、5%CO2培养箱培养。取对数生长期细胞传代,用于进一步实验。
三、连续UVA照射诱导HSF老化
取对数生长期HSF,加入少量PBS覆盖培养皿底面,置于冰水中,用紫外线治疗仪(型号SS-04,UVA:320 ~400 nm)进行照射,单次照射780 s,剂量为10 J/cm2,照射后弃PBS,重新加入培养基,于次日再次重复操作,连续照射14 d,于首次照射后和照射后第3、7、14天,采用RT-PCR检测miR-1246的相对表达,以相同处理不照射UVA 的细胞为对照。
四、RT-PCR检测目的基因的相对表达
取各实验组细胞,按Trizol 试剂盒方法提取总RNA,反转录获得cDNA。使用SYBR Green I 染料法进行相对定量分析。采用20 μl 反应体系,引物由上海吉凯基因化学技术有限公司合成,序列见表1。扩增条件:95 ℃预变性5 s,95 ℃变性5 s,60 ℃延伸30 s,共40 个循环。每个样品设3 个复孔,结果取平均值,用2-ΔΔCt法计算目的基因的相对表达值。
五、慢病毒转染上调HSF 细胞miR-1246 的表达及验证
取对数生长期HSF 细胞,按照慢病毒转染手册,转染以异硫氰酸荧光素(FITC)标记的miR-1246 慢病毒表达载体至HSF 细胞,慢病毒表达载体的构建和鉴定由上海诺百生物技术有限公司完成,将细胞分为转染FITC-miR-1246 的miR-1246转染组以及转染FITC-miR无义序列的阴性对照组和不做任何处理的空白对照组,观察转染后第7、14 天时细胞的荧光情况以确定转染效率,通过RT-PCR检测miR-1246的相对表达。
六、双荧光素酶报告基因系统验证miR-1246与靶点基因MAPK14结合
通过miRNA 靶基 因 预 测网站(http://www.targetscan.org/vert_72/)分析miR-1246 与靶点基因MAPK14的互补序列,由上海诺百生物技术有限公司构建合成有互补序列的野生型(WT)MAPK14及无互补序列的突变型(MUT)MAPK14 荧光素酶报告基因质粒(图1),分别与miR-1246及其空白质粒共转染于24 孔人胚胎肾细胞(HEK293T)培养板,48 h后收取细胞,PBS洗2遍,每孔加100 μl被动裂解缓冲液,水平摇床裂解20 min,吹打均匀,吸取20 μl细胞裂解液于酶标板,加入50 μl荧光素酶分析缓冲液,检测萤火虫荧光素酶活性,然后加入50 μl 底物缓冲液,立即检测海肾荧光素酶活性,记录前后两次测得荧光数据,其比值代表各孔样本的相对荧光强度,配对程度越高相对荧光强度越低。
七、UVA 照射及上调miR-1246 的表达对HSF细胞的影响
取对数生长期细胞,分为4 组,分别是空白对照组、UVA 组(按照方法三的剂量连续照射)、miR-1246组(转染has-miR-1246)、UVA+miR-1246组(转染has-miR-1246,按照方法三的剂量连续照射),14 d 后,收集各组细胞,采用MTT 检测细胞增殖活性,β半乳糖苷酶染色检测细胞老化,RT-PCR及Western 印迹检测MMP-1、MAPK14 mRNA 及蛋白的表达。
1.MTT 检测细胞增殖活性:取各组细胞,调整为5×104~10×104/ml 的细胞悬液,取100 μl 加入96 孔板,置37 ℃、5%CO2培养箱培养24 h,每组设5 个复孔。更换培养基,每孔加20 μl MTT(5 g/L)溶液,于37 ℃、5% CO2培养箱培养4 h,吸去上清液,加入150 μl二甲基亚砜,振荡10 min,使用酶标仪于490 nm测定各孔吸光度(A值),反映细胞增殖活性。
2.β半乳糖苷酶染色检测细胞老化:取各组细胞,使用PBS清洗后加入适量细胞固定工作液固定细胞,采用PBS 清洗后,加入细胞染色工作液于37 ℃孵育20 min至16 h,至光镜下观察出现蓝染的阳性细胞;弃去染色工作液,用PBS清洗;随机挑选3 处视野,采用德国ZEISS 公司VIDAS 型计算机全自动图像分析系统计算β 半乳糖苷酶表达阳性细胞比率,阳性细胞率(%)= 蓝染细胞面积/细胞总面积×100%。
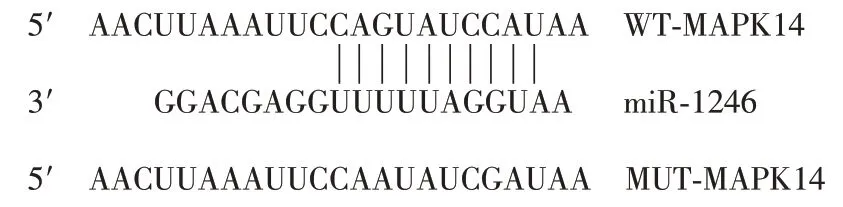
图1 根据miR-1246与MAPK14基因之间的互补序列设计的互补和不互补序列 野生型(WT)有互补序列,突变型(MUT)无互补序列

表1 引物序列
3.Western印迹检测蛋白表达:取各组细胞,裂解后收集上清液,进行蛋白定量。各组取等量蛋白,经电泳、转膜、封闭,分别与MMP-1 抗体及MAPK14抗体(1∶1 000)孵育过夜;洗涤后与相应的二抗结合反应,使用ECL发光显色,以GAPDH作为参照,目的条带灰度值与GAPDH 条带的比值为相对表达水平。
八、统计学处理
结 果
一、UVA照射对HSF中miR-1246表达的影响
起始时照射UVA与照射3 d时,UVA组与对照组miR-1246 的相对表达差异均无统计学意义(t=1.29、2.52,均P >0.05)。在照射7 d、14 d 时,UVA组均低于对照组,差异均有统计学意义(t=29.84、31.93,均P <0.01)。见图2。
二、慢病毒载体介导miR-1246 过表达及实时定量PCR 验证
转染后7、14 d 时的转染效率均大于90%(图3)。RT-PCR 显示,转染后7、14 d 时miR-1246表达水平(10.15 ± 0.18、9.79 ± 0.40)高于对照组(4.20 ± 0.34、3.61 ± 0.34),差异有统计学意义(t =22.72、41.92,P均<0.01);转染组7、14 d 的miR-1246相对表达水平差异无统计学意义(t = 1.56,P >0.05)。
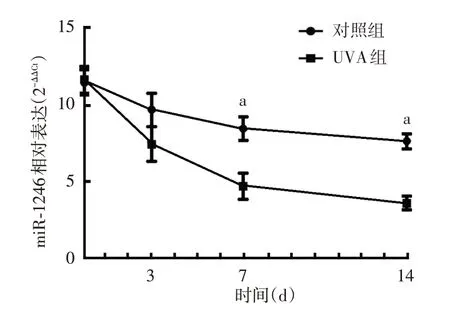
图2 RT-PCR 检测UVA 照射对人皮肤原代成纤维细胞miR-1246表达的影响 a:两组比较,P <0.05
三、miR-1246与靶点基因MAPK14结合的验证
与野生型MAPK14 双荧光素酶报告载体共转染时,miR-1246 质粒组细胞荧光活性(0.41±0.09)低于空白质粒组(1.22±0.218),差异有统计学意义(t=4.69,P <0.05);与突变型MAPK14双荧光素酶报告载体共转染时,miR-1246 质粒组细胞荧光活性(1.16±0.16)与空白质粒组(1.21±0.18)差异无统计学意义(t=0.25,P=0.82)。
四、上调miR-1246 表达对HSF 细胞增殖的影响
MTT结果显示,空白对照组、UVA组、miR-1246组、UVA+miR-1246组细胞增殖活性(0.82±0.03、0.23±0.02、0.81±0.02、0.61±0.02)差异有统计学意义(F = 34.90,P <0.05),UVA 组低于空白对照组(t = 28.14,P <0.01);UVA + miR-1246 组低于miR-1246 组(t=10.61,P <0.01),高于UVA 组(t=20.30,P <0.01)。
五、上调miR-1246 表达对HSF 细胞增殖的影响
β 半乳糖苷酶染色检测显示,空白对照组、UVA组、miR-1246组、UVA+miR-1246组阳性细胞率(3.93%±1.11%、81.29%±2.53%、5.50%±1.15%、54.13% ± 2.09%)差异有统计学意义(F = 16.14,P <0.05),其中UVA组高于空白对照组(t=48.46,P <0.01);而UVA+miR-1246 组高于miR-1246 组(t = 35.31,P <0.01),低于UVA 组(t = 14.32,P <0.01)。见图4。
六、上调miR-1246 表达对老化相关基因的影响

图3 荧光显微镜观察转染荧光标记的miR-1246表达载体的人皮肤原代成纤维细胞转染效率 转染后7、14 d时转染率均大于90%
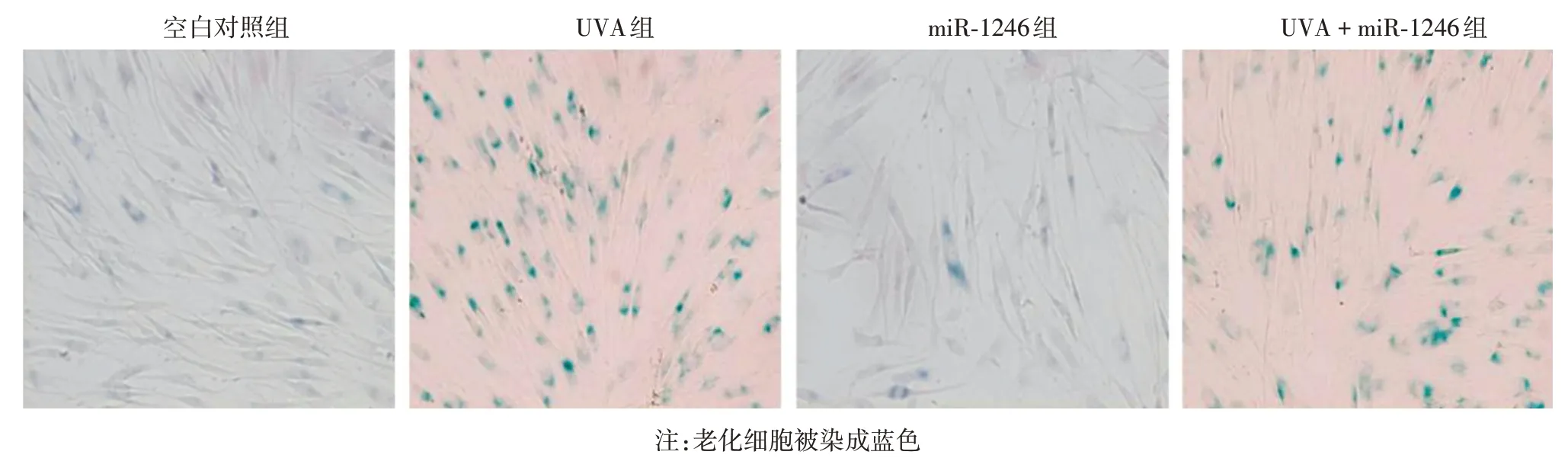
图4 β 半乳糖苷酶染色检测上调miR-1246 表达对人皮肤原代成纤维细胞老化的影响 UVA 组老化细胞比例高于空白对照组;而UVA+miR-1246组高于miR-1246组,低于UVA组
RT-PCR 显示,空白对照组、UVA 组、miR-1246组、UVA + miR-1246 组MAPK14 mRNA、MMP-1 mRNA 的相对表达差异均有统计学意义(F =15.24、34.56,均P <0.05),其中UVA组高于空白对照组(t = 10.49、7.70,P <0.05),UVA + miR-1246组高于miR-1246 组(t=11.58、12.60,P <0.01),低于UVA组(t=11.63、6.17,P <0.05)。见图5。
七、上调miR-1246 表达对老化相关基因蛋白表达的影响
Western 印迹显示,空白对照组、UVA 组、miR-1246 组、UVA+miR-1246 组MAPK14、MMP-1的相对表达差异均有统计学意义(F = 23.56、32.74,P <0.05),其中UVA 组高于空白对照组(t=12.53、15.35,P <0.05),UVA + miR-1246 组高于miR-1246 组(t=24.78、32.15,P <0.01),低于UVA组(t=10.43、15.64,P <0.05)。见图6。
讨 论

图5 RT-PCR 检测上调miR-1246 表达对人皮肤原代成纤维细胞MAPK14、MMP-1 mRNA表达的影响 a:两组比较,P <0.05
光老化是一个复杂的过程,由多种基因和生长因子共同调控。UVA 照射在光老化的发病机制中发挥重要作用。miRNA 是一类具有转录调节功能的非编码小RNA,其在多种生理和病理过程如基因表达、细胞增殖、分化、凋亡、组织代谢和肿瘤生成中有重要作用[4]。miR-1246位于人2q31.1,通常与其靶基因mRNA以序列互补性的机制负调控靶基因,作用方式是miR-1246 5′端种子序列(第2-7nt)与靶基因mRNA 3′UTR区进行碱基配对,配对的紧密程度决定miRNA对靶基因的抑制程度[5-6]。

图6 上调miR-1246 表达对对人皮肤原代成纤维细胞老化相关蛋白水平的影响 6A:Western 印迹检测MAPK14、MMP-1蛋白的水平;6B:a,两组比较,P <0.05
本研究证实,UVA 照射可以诱导miR-1246 表达下调。通过miR-1246慢病毒表达载体转染成纤维细胞,上调miR-1246 的表达并维持在较高水平后发现,miR-1246 的表达上调能促进UVA 诱导的光老化细胞的增殖活性,β半乳糖苷酶染色检测亦显示,上调miR-1246 的表达可降低UVA 诱导的光老化细胞比例。以上均提示,上调miR-1246 的表达可以抑制UVA 照射诱导的细胞老化,miR-1246具有抗光老化作用。
近来研究发现,p38 信号通路是MAPK 通路的一个重要分支,它在炎症细胞、应激、凋亡、细胞周期和生长等多种生理和病理过程中起重要作用。MMP-1 是皮肤光老化的主要相关蛋白酶,也是MAPK信号转导通路的下游效应分子,并可降解多种胶原和蛋白聚糖,对于维持皮肤的光泽和弹性具有重要作用[7]。本研究中,UVA照射成纤维细胞后MAPK14 以及MMP-1 mRNA 及蛋白表达水平均显著增高。既往文献显示,p38激活可使转录激活因子AP-1 活化,与MMP-1 基因结合,促进MMP-1 转录,使之水平增加[8],本文结果与之相符,与之对应的是UVA 照射后成纤维细胞增殖活性下降,老化细胞比例增加。
进一步研究发现,上调成纤维细胞miR-1246的表达,可下调MAPK14、MMP-1 mRNA 及蛋白的表达,同时MTT 结果显示,上调miR-1246 表达后照射UVA 较单纯照射UVA 组细胞活性增加,老化细胞比例降低。通过双荧光素酶报告基因系统也验证了miR-1246 有MAPK14 mRNA 靶向结合的能力。因此,我们推测UVA 照射可能通过降低miR-1246表达,上调基因MAPK14的表达,活化MAPK 信号转导通路,促进MMP-1 增加,加速成纤维细胞光老化,增殖活性下降。
综上,本研究证实,miR-1246在UVA诱导的光老化细胞显著下调,上调其表达则能提高光老化细胞的增殖能力,降低老化相关蛋白的表达,而miR-1246 的调控作用可能是通过作用于靶基因MAPK14 实现,提示miR-1246 的表达下调在UVA诱导光老化的形成和进展中可能发挥重要的作用。
此外,本实验并未进行下调miR-1246 表达后是否会促进UVA 诱导的光老化、降低细胞增殖活性的研究,有待进一步证实。
利益冲突所有作者均声明不存在利益冲突

